Исследования преципитирования в ходе процесса разложения фосфоросодержащих соединений
Автор: Ганбаров М.М., Атаев М.М., Газвини К.К.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 4 (78), 2018 года.
Бесплатный доступ
В работе исследована кинетика процесса использование фосфоросодержащие минеральные соединения их разложением, которые являются актуальными проблемами. В начале работы осведомлено, что процесс происходит в двух стадиях. Эти стадии процессы отличаются друг друга в основном по скорости осуществления процесса, так как скорость первой стадии гораздо больше, чем второго. Этот факт является причиной глубокого исследования кинетики данного процесса. Кроме того, изучение таких процессов связаны нескольких производственных проблемами. В работе анализированы эти вопросы, так же представлены сведения по методике проведенных опытов, режимные параметры, соотношение компонентов, концентрация компонентов, требуемое время для осуществления процесса. Так же определена зависимость степени преципитирования при различных массовых соотношениях компонентов от времени осуществления процесса. В работе показаны виды существования преципитата, как монетит и брушит. На основе полученных данных графически представлены растворимость различных фаз и скорость превращение, так же диаграмма осаждения основного полученного продукта...
Кинетика, минеральные соединения, суперфосфат, серная кислота, фосфорной кислоты
Короткий адрес: https://sciup.org/140244282
IDR: 140244282 | DOI: 10.20914/2310-1202-2018-4-312-315
Текст научной статьи Исследования преципитирования в ходе процесса разложения фосфоросодержащих соединений
Исследования процесса разложения фосфоросодержащих минеральных соединений серной кислотой для различных целей показали, что процесс разложения происходит в основном в две стадии. Вторая стадия процесса имеет меньшую скорость по сравнению с первой [1, 2].
Данный вопрос связан с получением минеральных и органоминеральных удобрений. Необходимо глубоко исследовать существующие процессы для решения нижеследующих актуальных вопросов: развитие соответствующего производства, интенсификация применяемых процессов, максимальное использование сырья, ликвидация вредных воздействий на окружающую среду при использовании полученных продуктов.
С целью выяснения указанных вопросов нами проведены исследования. В исследованиях использованы апатитовый концентрат в виде фосфоросодержащего минерального соединения и серная кислота. Опыты выполнены по известной методике [3]. После завершения процесса около 30–50% от общего объема полученной пульпы суперфосфата подается в реактор-нейтрализатор. В реакторе-нейтрализаторе при 65 °C на пульпу суперфосфата добавляется определенное количество суспензии ракушечника и проводится нейтрализация фосфорной кислоты в соотношении СаО/Р 2 О 5 = 1,0 в течение 60 мин. Остальная масса суперфосфатной пульпы помещается в камере термостата и выдерживается при температуре 150–160 °C. Полученная смесь из реактора-нейтрализатора добавляется к основной массе суперфосфатной пульпы в камеру и выдерживается 1,5 ч. Проведен анализ полученного продукта. Изучен процесс преципитирования в течение 240 мин в различных условиях. Степень преципитирования определялась отношением количества растворенной формы Р 2 О 5 в цитрате на общее количество Р 2 О 5 .
Кроме этого, в условиях различных массовых соотношений СаО/Р 2 О 5 при температуре 65 °C реакционной смеси изучена зависимость степени преципитирования от продолжительности процесса.
Известно, что преципитат может существовать в виде монетита СаНРО4 и брушита СаНРО4·2Н2 O. Они содержат соответственно 52,17 и 41,25%. Брушит осаждается из фосфорнокислых растворов при 40–50 °C как метаста-бильная фаза, выше 50 °C выделяется безводная соль – монетит. На основе полученных результатов на рисунке 1 показана растворимость метастабильной фазы СаНРО4·2Н2O и стабильной фазы СаНРО4 при 65 °C, на рисунке 2 – скорость полиморфного превращения СаНРО4·2Н2 O→ СаНРО4.
Результаты анализа процесса преципити-рования, полученные на основе опытных данных, представлены в таблице 1.
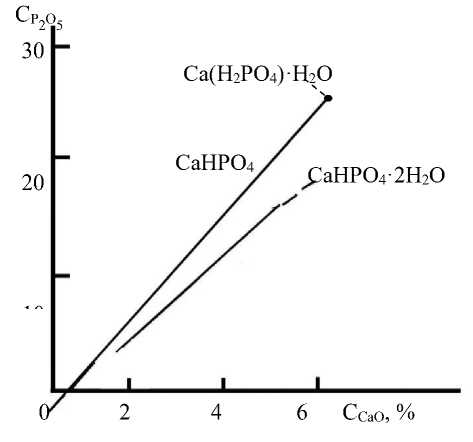
Рисунок 1. Растворимость метастабильной фазы СаНРО 4 ·2Н 2 O и стабильной фазы СаНРО 4 в системе СаО–Р 2 О 5 –Н 2 O при 65 °C
-
Figure 1. The solubility of the metastable phase СаНРО 4 ·2Н 2 О and СаНРО 4 stable phase in the system CaO–P 2 O 5 –H 2 O at 65 °C
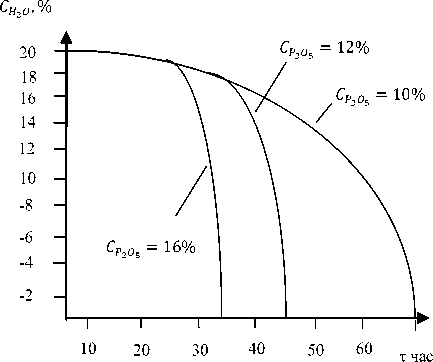
Рисунок 2. Изменение фазового превращения СаНРО 4 ·2Н 2 O в безводную соль во времени при 65 °C при различных концентрациях Р 2 О 5 в жидкой фазе, равновесной с двуводной солью
Figure 2. The change of phase transformation СаНРО 4 ·2Н 2 О in anhydrous salt in time at 65 °C with various concentrations of P 2 O 5 in the liquid phase in equilibrium with dvuvodny salt
Таблица 1.
Влияние массового соотношения СаО/Р 2 О 5 и продолжительности процесса на степень преципитирования
Table 1.
Influence of mass ratio CaO/P 2 O 5 and duration of the process on the degree of precipitation
|
Массовое соотношение Mass. correlation СаО/Р 2 О 5 |
Степень преципитирования в течение процесса (мин) нейтрализации Precipitation degree during of process neutralization (min) |
|||||
|
30 |
60 |
90 |
120 |
180 |
240 |
|
|
0,9 |
54,70 |
70,84 |
73,85 |
75,20 |
80,55 |
86,46 |
|
1,0 |
58,42 |
77,60 |
80,46 |
82,05 |
87,60 |
90,66 |
|
1,1 |
60,16 |
78,20 |
81,15 |
80,80 |
87,00 |
90,00 |
|
1,2 |
60,22 |
76,36 |
82,00 |
80,76 |
87,30 |
90,88 |
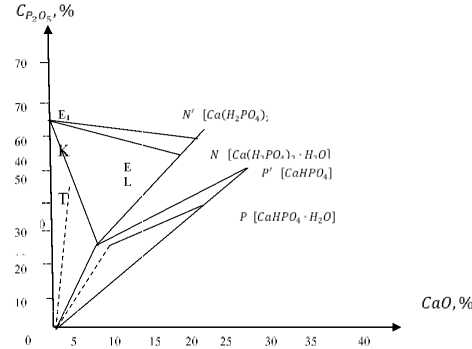
Рисунок 3. Диаграмма процесса осаждения дикальцийфосфата из фосфорной кислоты: OE – стабильная и ML – метастабильная ветви изотермы системы СаО–Р 2 О 5 –Н 2 O при 65 °C; KT – ветвь растворимости СаНРО 4 в системе СаО–Р 2 О 5 –Н 2 O при соответствующей температуре
Figure 3. Diagram of the deposition of dicalcium phosphate from phosphoric acid: OE-stable and ML-metastable branches of Cao–P 2 O 5 –H 2 O system isotherm at 65 °C; KT – branches solubility in CaO–P 2 O 5 –H 2 O system at the appropriate temperature
Как видно из таблицы 1, независимо от продолжительности процесса нейтрализации для проведения процесса преципитирования при температуре 65 °C массовое соотношение должно быть СаО/Р 2 О 5 = 1,0, т.к. его дальнейшее увеличение практически не влияет на процесс, даже в некоторых случаях уменьшается степень преципитирования.
В условиях соотношений СаО/Р 2 О 5 = 1,0 в течение 240 мин процесса степень преципити-рования равняется 90,66%. А при 60 минутах
Список литературы Исследования преципитирования в ходе процесса разложения фосфоросодержащих соединений
- Ибрагимова С.М., Алосманов М.С. Исследо-вание процесса экстрагированной фосфорной кислоты с использованием нового сырья//Азербайджанский химический журнал. 2014. № 4. C. 90-92.
- Гасанов А.А., Атаев М.Ш., Газвини К.А. Исследование кинетических закономерностей в процессе использования микроэлементо содержащей вулканитовой золы при производстве суперфосфата//Наука, техника и образование. 2016. № 6 (24). C. 24-26.
- Газвини К.А. Опытное исследование кинетики процесса разложения фосфата//Эко Энегетика научно-технический журнал. 2017. № 3. C. 54-58.
- Atkins P.W., Overton T.L., Rourke J.P., Weller M.T. et al. Shriver and Atkins Inorganic Chemistry, Fifth Edition. New York: W.H. Freeman and Company. 2010. 824 p.
- Schr?dter K., Bettermann G., Staffel T., Wahl F. et al. Phosphoric Acid and Phosphates//in Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2008 DOI: 10.1002/14356007.a19_465.pub3
- Childers D.L., Corman J., Edwards M., Elser J.J. Sustainability Challenges of Phosphorus and Food: Solutions from Closing the Human Phosphorus Cycle//Bioscience. 2011. № 61. P. 117-124.
- Mayer B.K., Baker L.A., Boyer T.H., Drechsel P. et al. Total value of phosphorus recovery//Environ. Sci. Technol. 2016. V. 50. P. 6606-6620.
- Peng L., Dai H., Wu Y., Peng Y. et al. A comprehensive review of the available media and approaches for phosphorus recovery from wastewater//Water Air Soil Pollution. 2018. V. 229. P. 115 DOI: 10.1007/s11270-018-3706-4


