Источник ионов наноэлектроспрей для масс-спектрометра МХ 5310
Автор: Краснов Илья Александрович, Корнев Д.И., Краснов Н.В., Подольская Е.П., Мурадымов М.З.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии
Статья в выпуске: 4 т.20, 2010 года.
Бесплатный доступ
Настоящая работа посвящена сравнению источников ионов наноэлектроспрей и электроспрей для масс-спектрометра МХ 5310 (ИАП РАН). Источник ионов наноэлектроспрей позволил снизить расход анализируемой пробы до 50-100 нл/мин. Показано увеличение эффективности использования пробы, а также уменьшение порога детектирования (с 10-8 до 10-9 М) по сравнению со штатным источником ионов. Была подтверждена возможность проведения успешных масс-спектрометрических анализов биологических проб, прошедших многостадийную биохимическую пробоподготовку на примере фрагментов сывороточного альбумина крысы, модифицированных остатком инсектицида параоксона.
Наноэлектроспрей, масс-спектрометр мх 5310, сывороточный альбумин крысы, параоксон
Короткий адрес: https://sciup.org/14264675
IDR: 14264675 | УДК: 621.384.668.8+
Текст научной статьи Источник ионов наноэлектроспрей для масс-спектрометра МХ 5310
Метод электрораспыления при атмосферном давлении (ЭРИАД, ESI) был разработан в восьмидесятые годы [1, 2]. Этот метод основан на распылении образца при атмосферном давлении под действием электрического поля. Анализируемое вещество в жидкой фазе пропускается через металлический капилляр с приложенным к нему высоким напряжением относительно сопла прибора. Как правило, в качестве растворителей применяют смеси таких полярных и относительно летучих растворителей, как вода, метанол или ацетонитрил. Под действием электрического поля положительно заряженные частицы раствора скапливаются на срезе капилляра, образуя конус. При достаточно сильном приложенном поле образуется струя капель, эмитируемая из вершины конуса в направлении противоэлектрода. За время движения капель от капилляра к соплу растворитель испаряется. В определенный момент силы кулоновского расталкивания начинают превышать силы поверхностного натяжения — капля распадется на множество малых заряженных капель и процесс повторяется многократно [3]. В конечном итоге создаются условия для полевой десорбции ионов из капель. Электроспрей является удобным методом ионизации термолабильных высокомолекулярных биологических соединений. За счет использования дополнительных газовых потоков становится возможным увеличение скорости потока растворителя в источниках этого типа до значений, необходимых для стыковки жидкостных хроматографов с масс-спектрометрическими де- текторами [4]. Однако в общепринятом варианте данных источников используются капилляры с внутренним диаметром 100 мкм и насосы с минимальной скоростью потока в 1 мкл/мин, что делает затруднительной работу с малыми объемами проб, получаемых при пробоподготовке биологических образцов. Например, при выделении белков и пептидов, не стехиометрически модифицированных различными агентами, из внутренних сред организма объемы получаемых образцов не превышают 10–15 мкл, а в некоторых случаях, при низких концентрациях искомых маркеров, и менее микролитра [5].
Метод наноэлектроспрей (nano-ESI) был разработан Вильмом и Манном в 1994 г. [6, 7]. Основной целью при разработке такого источника было достижение минимальных расходов образца. В варианте наноэлектроспрея используемые эмитти-рующие капилляры имеют намного меньший внутренний диаметр отверстия, с которого происходит распыление (1–30 мкм), что уменьшает масштаб факела распыления и увеличивает количество пробы, захватываемой транспортной системой. В общем случае при распылении растворов с низкой вязкостью давление не прикладывается в отличие от классического источника ионов "электроспрей" (ESI), где поток пробы создается насосом. Весь распыляемый раствор в источнике наноэлектроспрей содержится в капилляре с вытянутым концом, который является эмиттером. Поток жидкости создается благодаря воздействию электрического поля на жидкость в эмиттирующем капилляре. Скорость потока в такой системе в первую очередь ограничивается диаметром отверстия на конце эмиттера. Скорости потоков составляют 10–100 нл/мин, что позволяет работать с малыми объемами образцов в течение длительного времени. В источниках типа nano-ESI возможно применение в качестве растворителя чистой воды, что труднодостижимо в ESI. Вода является предпочтительным растворителем при анализе белков и пептидов, т. к. не вызывает нарушений их структур высокого порядка (денатурации) [8–10]. Однако стоит отметить, что из-за малых вводимых объемов пробы в распылительный капилляр (0.5– 10 мкл) соотношение поверхность/объем велико, что делает значительным влияние примесей, вымываемых с поверхности капилляра (например, Na+), и эффектов сорбирования компонентов образца на поверхности капилляра [10].
Последние десятилетия происходит быстрое развитие методов идентификации биоорганиче-ских соединений, в том числе с помощью методов масс-спектрометрии. Это связано с высокой чувствительностью масс-спектрометрических детекторов и возможностью определить молекулярную массу исследуемого соединения. Одной из важнейших задач, решаемых с помощью масс-спектрометрии, является поиск и идентификация модификаций белков. При проведении таких исследований возникают проблемы как с поиском белков, несущих модификации, так и с выделением модифицированного белка. Существующие методы пробоподготовки позволяют решать обе проблемы, однако процент модифицированного белка по отношению к немодифицированному бывает достаточно низким и задача по определению модификации может решаться двумя способами:
-
1) разработка методик по обогащению образца искомым соединением;
-
2) повышение чувствительности анализа концентрированием пробы.
Примером такого рода задачи может служить поиск и идентификация аддуктов фосфорорганических соединений с белками крови.
В предыдущих работах методом тандемной масс-спектрометрии нами были обнаружены и идентифицированы триптические пептиды сывороточного альбумина, содержащие модификации фосфорорганическими соединениями [11]. Была разработана методика по обогащению образца пептидами, несущими модификацию ФОС. Эксперимент был выполнен с помощью прибора Axima ("Shimadzu"). Но при повторении анализа с использованием времяпролетного масс-спектрометра МХ 5310, оснащенного источником ионов ESI, искомые пептиды обнаружены не были. Возникла необходимость в модернизации масс-спектрометра, а именно в оснащении масс-спектрометра источником ионов nano-ESI.
Таким образом, целью данной работы было оборудовать масс-спектрометр МХ 5310 источни-

Рис. 1. Источник ионов наноэлектроспрей. Установлен на масс-спектрометре МХ 5310
ком ионов nano-ESI и показать возможность анализа биологических проб, содержащих следовые количества пептидов, модифицированных остатками ФОС.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В штатном источнике ионов масс-спектрометра МХ 5310 образец из стеклянного шприца поступает в пластмассовый капилляр со скоростью 4 мкл/мин при помощи насоса Harvard 55-1199. Диаметр пластмассового капилляра составляет 0.1 мм, на его конце располагается металлический капилляр внутренним диаметром 100 мкм, к которому приложено напряжение 3–4 кВ. Аксиально с этим капилляром расположен металлический капилляр большего диаметра, по которому подается азот [12].
Систему прямого ввода пробы nano-ESI собирали на основе следующих компонент.
-
– Трехкоординатная система позиционирования эмиттера;
-
– боросиликатные трубки (внутренний диаметр 1 мм) с оттянутым концом с диаметром отверстия 1–5 мкм с электропроводящим палладий-золотым покрытием фирмы "Proxeon";
-
– токоизолирующие фторопластовые элементы;
-
– ограничительное сопротивление (50 мОм);
– медно-бериллиевый зажим для игл, передающий на иглу высокое напряжение, необходимое для электрораспыления.
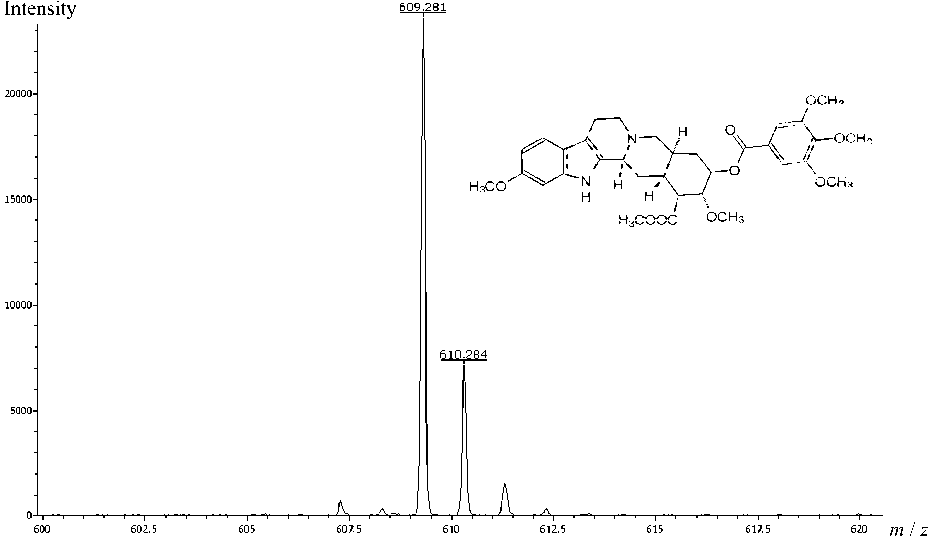
Рис. 2. Тестовое соединение резерпин (MW = 608.28 Да, МН+= 609.28 Да) и его масс-спектр (ESI-MХ 5310, [С] = 10–5 М)
Далее — штатный блок источника ионов масс-спектрометра МХ 5310 заменяли собранным источником nano-ESI (рис. 1). Для удобства настройки положения эмиттера относительно сопла была установлена видеокамера Navitar Lu100m. Подаваемое на эмиттер напряжение изначально подбиралось исходя из метода расчета потенциалов [13].Раствор анализируемого соединения вводили в боросиликатный эмиттер с палладий-золотым покрытием фирмы "Proxeon" с помощью аналитического шприца "Hamilton" в объеме 1 мкл. Распыление с конца иглы происходило за счет электроосмотических процессов, без приложения давления. Оптимальный электрораспылительный потенциал для данной установки составил 2400 В. Управление настройками оборудования и запись масс-спектров проводились с помощью штатных средств управления и регистрации спектров масс-спектрометра МХ 5310.
Для определения предела чувствительности и сравнения источников ионов были подготовлены растворы тестового соединения резерпина в концентрациях от 10–10 М (6.1·10–5 мг/л) до 10–5 М (6.1 мг/л).
После апробирования источника ионов nano-ESI с использованием растворов резерпина был проведен анализ пептидов сывороточного альбумина крысы, модифицированных ФОС. Образцы триптических пептидов коммерческого сывороточного альбумина крысы и альбумина, выделенного из сыворотки крови крысы, модифицированных параоксоном, были получены с использованием методов аффинной и металл-аффинной хроматографии [14].В экспериментах по выделению сывороточного альбумина из сывороток крови использовали колонки Aurum (Serum protein mini kit, Affi-Gel Blue/Affi-Gel protein A, Bio-rad). Для получения удобных для масс-спектрометрического анализа фрагментов альбумина массой 1000– 3000 Да проводили гидролиз белка ферментом трипсином. Для выделения пептидов, содержащих модификацию ФОС, полученную смесь триптических пептидов сывороточного альбумина разделяли с помощью металл-аффинной хроматографии на сорбенте, содержащем ионы железа. Более полно методика пробоподготовки приведена в [15].
В результате пробоподготовки объемы конечных проб не превышали 2 мкл, что не позволило использовать при анализе штатный ESI-источник масс-спектрометра МХ 5310. С помощью масс-спектрометра МХ 5310, оснащенного источником ионов nano-ESI, был проведен поиск фрагментов сывороточного альбумина крысы, модифицированных параоксоном
YФОСTQKAPQVSTPTLVEAAR и RHPYFYФОСAPELLYYAEK.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для сравнения параметров источников ионизации nano-ESI и штатного блока электрораспыления были получены спектры тестового соединения резерпина (рис. 2) в концентрации 10–5 М (6.1 мг/л) при одинаковом для каждого источника количестве выталкивающих импульсов системы ортогонального ввода ионов в масс-анализатор.
Сравнительные характеристики источников ионов ESI и nano-ESI для раствора резерпина в концентрации 6.1 мг/л, или 10–5 М. (Основные параметры масс-спектрометра МХ 5310 идентичны; напряжения электрораспыления: 3200 В — для штатного источника ионов, 2400 В — для источника ионов nano-ESI)
|
Характеристика |
ESI |
nano-ESI |
|
Расход растворов Отношение сигнал/физический шум при 100 000 единичных выталкивающих импульсов Отношение сигнал/химический шум при 100 000 единичных выталкивающих импульсов Время анализа до достижения соотношения сигнал/шум 10 000 Количество анализируемого в-ва, введенного в прибор (до достижения соотношения сигнал/шум 10 000) |
5 мкл/мин 950 380 ~170 с 6.1·10–5 мг, или 10–10 моль |
50–100 нл/мин 4337 1734 ~ 40 с 1.3·10–7 мг, или 10–13 моль |
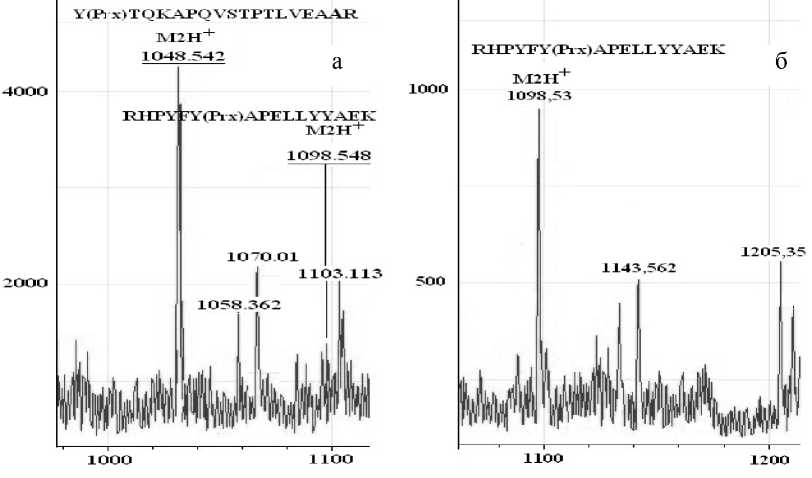
Рис. 3. Фрагменты масс-спектров (система nanoESI-МХ 5310), содержащие сигналы модифицированных пептидов, полученных с помощью металл-аффинной хроматографии: а — сывороточного альбумина крысы, обработанного параоксоном in vitro ; б — сывороточного альбумина крысы, полученного из обработанной параоксоном сыворотки крысы с использованием разработанной универсальной методики
Результаты такого сравнения приведены в таблице. При снижении расхода пробы на 2 порядка (с 5 мкл/мин ESI до 50 нл/мин nano-ESI) наблюдается увеличение сигнала исследуемого соединения в 4 раза по сравнению со штатным источником. Также были определены пределы обнаружения тестового соединения для каждого источника ионов, которые при накоплении спектра в течение 10 мин составили 6.1·10–3 мг/л (10–8 М) для штатного источника ESI и 6.1·10–4 мг/л (10–9 М) для источника nano-ESI. Время распыления 1 мкл образца для источника nano-ESI в среднем составило 15 мин, что соответствует скорости потока растворителя в 50–70 нл/мин. Такая продолжительность анализа позволяет находить оптимальные инструментальные параметры для конкретных образцов. Результаты, полученные с использованием тестового образца, позволили надеяться на возможность успешного применения масс-спектрометра МХ 5310, оснащенного источником ионов nano-ESI, для детектирования модифицированных ФОС пептидов.
Результаты анализа проб, полученных в результате выделения пептидов сывороточного альбумина крысы, содержащих модификацию ФОС, показали, что при использовании источника nano-ESI в масс-спектрах надежно детектируются оба ранее идентифицированных пептида
YФОСTQKAPQVSTPTLVEAAR с MH+=2096.08 Да и RHPYFYФОСAPELLYYAEK с MH+=2196.065 Да в двухзарядной форме. В случае сыворотки крови крысы, обработанной с помощью методов аффинной хроматографии, триптического гидролиза и металл-аффинной хроматографии, детектируется пептид RHPYFYФОСAPELLYYAEK (MH+ = = 2196.065 Да) (рис. 3).
Таким образом, для масс-спектрометра МХ 5310, оснащенного источником nano-ESI, при проведении тестовых анализов было показано увеличение эффективности использования пробы, что позволило анализировать пробы с единицами пикограмм искомого соединения, содержащегося в объеме 1–2 мкл. Это было продемонстрировано на примере обнаружения сигналов триптических пептидов сывороточного альбумина крысы, модифицированных ФОС.


