Исторические аспекты развития тотального эндопротезирования височно-нижнечелюстного сустава: от простого к сложному
Автор: Епифанов С.А., Штемпель М.С., Миронюк Ю.Д.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: История медицины
Статья в выпуске: 1 т.20, 2025 года.
Бесплатный доступ
Тотальное эндопротезирование височно-нижнечелюстного сустава (ВНЧС) является важным направлением в лечении пациентов с тяжелой патологией сустава, включая анкилозы, артриты, артрозы, травмы и врожденные аномалии. Рассмотрены исторические аспекты развития данной методики, начиная с первых упоминаний патологий ВНЧС в древности и заканчивая современными технологиями протезирования, такими как CAD/CAM.Описана эволюция подходов к лечению пациентов с заболеваниями сустава, включая использование различных материалов, таких как металлы, силикон, тефлон и полимеры. Отдельное внимание уделено их преимуществам и недостаткам, включая биосовместимость, прочность и побочные эффекты.Приведены ключевые этапы развития методов эндопротезирования: от удаления пораженного сустава до разработки модульных имплантатов. Рассмотрены результаты использования материалов, таких как Silastic, Proplast и тефлон, а также влияние этих технологий на состояние костных структур и общую функцию сустава.Особо выделена роль междисциплинарного подхода в диагностике и лечении патологий ВНЧС, что позволило значительно улучшить результаты лечения и повысить качество жизни пациентов. Подчеркнута важность дальнейшего совершенствования материалов и технологий для обеспечения долговечности и функциональности имплантатов.
Височно-нижнечелюстной сустав (внчс), анкилоз, имплантат, тотальное эндопротезирование
Короткий адрес: https://sciup.org/140309969
IDR: 140309969 | DOI: 10.25881/20728255_2025_20_1_166
Текст научной статьи Исторические аспекты развития тотального эндопротезирования височно-нижнечелюстного сустава: от простого к сложному
Тотальное эндопротезирование височно-нижнечелюстного сустава (ВНЧС) является важным этапом в лечении ряда заболеваний, связанных с нарушениями его функции и дегенеративными изменениями. Развитие хирургических мето- дов и имплантационных технологий позволило значительно улучшить качество жизни пациентов с тяжелыми заболеваниями ВНЧС, такими как артриты, артрозы, анкилозы, травмы и врожденные аномалии. Несмотря на значительные достижения в области медицины, актуальность исследования исторического развития методов тотального эндопротезирования остается высока, поскольку оно помогает понять эволюцию подходов, выявить ключевые этапы и опреде-

лить перспективы для дальнейшего совершенствования технологий.
Анкилоз суставов и нарушения их подвижности беспокоят человечество на протяжении веков. Как отмечает Schwartz, первые упоминания о данной патологии встречаются в древних рукописях, датируемых пятым тысячелетием до н.э. Свидетельства медицинской осведомлённости врачей древнего Египта о многих заболеваниях, включая дисфункцию ВНЧС, были найдены при раскопках в устье реки Нил [1; 2].
Достоверные манускрипты, описывающие болезни суставов, появились в XVI веке и были написаны французским хирургом Ambrois Paret, который первым разработал метод удаления поражённого сустава. Это хирургическое вмешательство оставалось популярным в Европе до XIX века как единственный способ помощи при воспалительных заболеваниях суставов [15]. Barton предложил использовать материалы, которые могли бы служить для создания ложных суставов при разделении суставных поверхностей ВНЧС. В начале XVIII века он предложил идею создания «ложного сустава», и его предложения касались использования биологически несовместимых материалов для разделения суставных поверхностей. Хотя в это время ещё не существовало тех технологий, которые позволяют точно имитировать функции суставов, он предложил несколько материалов, среди которых были:
-
1. Металлы . Barton начал с идей о создании конструкций из металлов, которые могли бы быть использованы для установки в сустав, чтобы разъединить суставные поверхности. Однако имплантационные материалы из металла того времени часто имели проблемы с биосовместимостью и вызывали воспалительные процессы.
-
2. Ксенотрансплантат (слоновья кость). Также рассматривалась возможность использования костных пластинок для создания промежуточных слоев между суставными поверхностями, что позволяло бы ослабить трение между ними и улучшить подвижность сустава.
-
3. Каменные материалы. В качестве альтернативы использовались различные камни, но такие материалы часто ломались и не обеспечивали стабильности соединения суставных поверхностей.
-
4. Растительные материалы. В некоторых случаях также использовались
растительные или природные материалы для создания мягких прокладок между суставами, что могло временно помочь в облегчении боли или ограничении движения [1; 2].
Идея Barton стала отправной точкой для дальнейших исследований и разработки более эффективных методов замены суставов и использования имплантатов, однако, как показала практика, материалы того времени не обеспечивали достаточную долговечность и функциональность. С развитием медицины и технологий стали применяться более современные биосовместимые материалы, такие как силикон, тефлон и другие полимеры.
Значительный вклад в диагностику патологий ВНЧС внес американский ЛОР-хирург J. Costen, чьи исследования сыграли ключевую роль в развитии современных методов диагностики и понимания заболеваний этого сустава. В 1934 г. Costen впервые описал так называемый «синдром Костена», который представляет собой комплекс симптомов, связанных с нарушениями функционирования ВНЧС, таких как боль, шум в ушах, головные боли и трудности с открыванием рта, что позволило выделить дисфункцию ВНЧС в отдельную группу заболеваний. Он был одним из первых, кто начал систематически исследовать функциональные расстройства ВНЧС и их связь с различными заболеваниями, такими как воспаление, травмы и анкилозы. В отличие от предыдущих подходов Костен не рассматривал эти заболевания исключительно как зубные или стоматологические, а поднимал вопрос о комплексной природе патологии, в которой важную роль играют не только зубы, но и сам сустав, мышцы и нервные структуры, окружающие его [3].
Costen также обращал внимание на клинические симптомы, такие как щелчки в суставе, боли при движении челюсти, головные боли и ощущение заложенности уха, которые стали основой для диагностики синдрома ВНЧС и в дальнейшем позволили разработать методы его лечения и предотвращения. Он активно использовал рентгенографию для диагностики заболеваний ВНЧС, что позволило выявить изменения в суставных поверхностях и мягких тканях, его подходы стали основой для дальнейшего внедрения рентгенологического исследования в диагностическую практику. Кроме того, Costen первым подчеркнул необходимость междисциплинарного подхода к диагностике и лечению патологий ВНЧС, отмечая важность взаимодействия разных специалистов – ЛОР-врачей, стоматологов, хирургов и терапевтов – для правильной оценки состояния сустава и назначения соответствующего лечения. Таким образом, работа J. Costen стала основой для дальнейших исследований в области диагностики и лечения заболеваний ВНЧС, систематизировав знания о функциональных нарушениях сустава и предложив методы диагностики, которые до сих пор используются в современной медицине [3].
Введение силиконовых полимеров, как материалов для импланатов, в медицину стало важным шагом к достижению стабильных результатов лечения заболеваний ВНЧС. Silastic, запатентованный компанией «Dow Corning» в 1948 г., стал первым медицинским силиконом, использованным для разделения суставных поверхностей. Описание его применения в хирургии было дано в 1966 году в сборнике под редакцией Wesolowski S. и Martinez A. [4].
С вхождением силикона в медицинскую практику возникла ложная надежда, так как первоначальные результаты операции были многообещающими. Однако позже было установлено, что силикон, находящийся между суставными поверхностями, разрушался под действием трения, вызывая гиперчувствительность и формирование гигантских клеток в области поражения.
Brown J. и Fryer M. предложили удалять силикон через год после имплантации, когда формируется грубая фиброзная капсула. Однако, в долгосрочной перспективе, это приводит лишь к отсроченному реанкилозированию. С 1983 г. появляется множество публикаций о выраженном воспалительном ответе на имплантаты Silastic как у людей, так и у животных. Силиконовые фрагменты обнаруживаются в лимфатических узлах на стороне имплантации вместе с гигантскими клетками инородных тел. Eriksson L. и Westesson P. в 1992 г. зафиксировали неудовлетворительные результаты у пациентов, перенёсших операцию дискэктомии с использованием силиконовых вкладышей, что поставило под сомнение использование этого материала в хирургии ВНЧС [7].
В 1993 г. компания «Dow Corning» прекратила производство полимера Silastic для хирургического применения, но многие хирурги продолжают использовать его в дискэктомиях. Однако его фиксация в области ВНЧС остаётся проблемной: методы, включающие подшива-

ние к суставной впадине, могут нарушать целостность материала.
Другим полимером, применяемым в хирургии ВНЧС, является тефлон. В 1972 г. Cook опубликовал исследования, показывающие, что использование тефлона между резецированным мыщелковым отростком и телом челюсти приводит к минимальным воспалительным изменениям и устойчивому формированию ложного сустава без реанкилозирования. Несмотря на критику, утверждающую, что тефлон может фрагментироваться, Cook сохранял устойчивость к данным аргументам, отмечая меньшую функциональную нагрузку в ВНЧС [5].
В конце 70-х компания «Vitek» предложила пропласт – пористый тефлон, стимулирующий врастание мягких тканей. Разработан двухкомпонентный протез ВНЧС, который стал важным шагом в создании модульных имплантатов. Несмотря на сообщения о повышенной активности макрофагов вокруг имплантатов, ряд авторов отмечает положительные отзывы о данном материале.
В 1989 г. Ryan делится опытом применения пропласта и тефлона. Хотя пациенты выражали удовлетворение, 20% случаев завершались развитием открытого прикуса из-за увеличения остеокласти-ческой активности. При использовании таких имплантатов, как пропласт, происходит увеличение резорбции костной ткани в области установки имплантата. Это может привести к укорочению ветви нижней челюсти, так как активность остеокластов вызывает потерю костной массы и нарушение нормальной структуры костей. Вследствие этого могут развиваться остеолиз и другие костные изменения, что, в свою очередь, ухудшает функциональное состояние суставов и приводит к изменению их анатомической конфигурации. Bronstein в 1987 г. указывает на более значительные костные изменения, связанные с пропластом по сравнению с Silastic, тогда как Morgan в 1988 г. подчеркивает отсутствие данных по отдалённым результатам использования тефлона в ВНЧС [6].
Florine и соавт. заметили у пациентов с аллопластическими имплантатами значительные деструктивные изменения костных структур сустава в течение 2–4 лет. Они пришли к выводу, что фрагменты тефлона слишком велики для резорбции лимфатической системой.
В 1990 г. на заседании FDA (Food and Drug Administration – Агентство Министерства здравоохранения США) было решено провести повторные осмотры

Рис. 1. Височно-нижнечелюстной имплантат Silastic, армированный полиэтилентерефталатными волокнами, который был имплантирован пациенту на 3 недели.
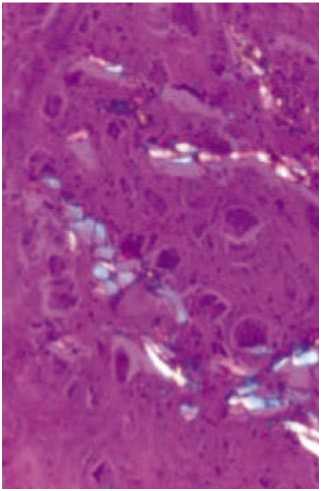
Рис. 2. Частицы силикона, обнаруженные в резецированных тканях.
всех пациентов с тефлоновыми/Proplast имплантами. Многочисленные сообщения хирургов указывают на ухудшение состояния суставов и обострение артроза у более чем половины пациентов. Одновременно обнаруживаются атипичные очаги костной пролиферации, что говорит об аномальной остеогенной активности.
По данным Henry и Wolford, спустя более 5 лет только 12% суставов не имели радиографических изменений. В исследованиях рассматривались как традиционные вмешательства на ВНЧС, так и инновационные методы, например, CAD/CAM протезирование, которое продемонстрировало отличные результаты без морбидности донорской зоны [8].

Рис. 3. А – конструкция шарнира Christensen изготовлена из литого кобальт-хромомо-либденового сплава, обеспечивающего соединение металла с металлом. Существует одна форма мыщелка и на выбор предлагается 44 различных формы компонента ямки. Эти компоненты ямки акже используются для гемиартропластики. Б – тотальный височно-нижнечелюстной протез, изготовленный по индивидуальному заказу, состоит из кованого титанового вкладыша для ямки, покрытого титановой сеткой для роста кости в ямке и крепления к суставной поверхности из сверхвысокомолекулярного полиэтилена. Специально подобранный элемент нижней челюсти состоит из стержня и мыщелковой головки из кованого ко-бальт-хромомолибденового сплава.
Подходы к уменьшению травматичности, такие как гемиартропластика, предполагают замену одной из суставных поверхностей аллопластическим имплантатом. Гибридные протезы появились в 1970-х. Исследования Kent и соавт. показали успешность гемиартропластики на уровне 87,3% по субъективным и объективным критериям [8].
Долговременные наблюдения показывают, что функциональная нагрузка может приводить к необратимым изменениям и ухудшению качества жизни пациентов. Вклад Christensen в тотальное протезирование ВНЧС остается значимым, несмотря на неудачное долговременное применение его материалов. Важно использовать износостойкие материалы, чтобы обеспечить функциональность и комфорт. Kent в начале 1980х при поддержке компании «Vitek» разрабатывает тотальный протез ВНЧС отвечающий требованиям износостойкости. Компонент суставной впадины изготавливается

из Proplas/Teflon или политетрафторэтилена. Мыщелковы отросток был выполнен из никель-хрома или стандартного титанового имплантата фирмы «Synthes». Процент успеха при использовании данных протезов составил 91,5%, из осложнений автор отмечал раннюю инфекцию в области протеза, эрозию суставной ямки, переднюю дислокацию суставной головки [13].
Schonnenburg с соавт. в 1985 г. и 1990 г. опубликовали опыт использования тотального протеза ВНЧС состоящего из мыщелка, изготовленного из сплава хром-кобальт-молибден и суставной впадины из полиэтилена ультравысокой плотности. Данный химический состав был аналогичен протезам, используемыми травматологами-ортопедами в хирургии тазобедренного и коленного сустава [15].
В 1995 г. Mercury с соавт. сообщили о первых результатах использования индивидуально-изготовленного тотального протеза ВНЧС по CAD/CAM технологии. Основываясь на исследованиях Mercury компания «TMJ Concepts» получила одобрение FDA на выпуск индивидуально изготовленных протезов ВНЧС с 1999 г. [8].
В 2000 г. Quinn J. представили вниманию хирургической общественности свои исследования с использованием стандартного тотального протеза ВНЧС производства «Biomet Microfixation». Данный тип протеза так же одобрен FDA. Последние два приведенных эндопротеза остаются актуальными и по сей день [10].
Современные подходы к тотальному эндопротезированию ВНЧС значительно изменились благодаря внедрению компьютерных технологий. Исследования Klein, T. et al. и Turner, J. et al. подчеркивают роль 3D-моделирования и 3D-печати, которые позволяют разрабатывать индивидуальные имплантаты, идеально подходящие анатомии пациента. Это помогает значительно снизить количество послеоперационных осложнений и повысить успешность операций [10; 15].
Также активно развиваются компьютерная навигация и роботизированные технологии. Lewis, D. et al. (2017) описывают использование роботизированной системы Mako, которая позволяет хирургам точнее выполнять операции и уменьшить время восстановления пациентов [12]. Эти технологии становятся стандартом в некоторых хирургических центрах.
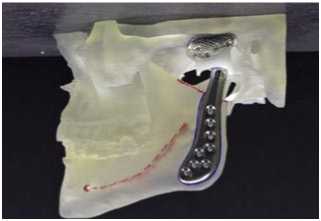
Рис. 4. Стереолитографическая модель и полный титановый имплантат ВНЧС, одобренный FDA.
Вклад отечественных ученых в разработку эндопротезирования ВНЧС представляет собой важный этап в совершенствовании хирургического лечения заболеваний ВНЧС, с которым связано множество исследований, как в области создания имплантатов, так и разработки методов хирургического вмешательства.
Отечественные ученые активно занимались созданием имплантатов для замены поврежденных суставных поверхностей, что позволило значительно улучшить результаты лечения и повысить качество жизни пациентов. В числе пионеров в этой области следует отметить работы таких специалистов, как Н.А. Плотников и П.Г. Сысолятин, А.А.Никитин. Они занимались разработкой модульных эндопротезов ВНЧС, которые включали компоненты как суставной впадины, так и мыщелкового отростка. Преимущества таких имплантатов заключаются в их долговечности, биосовместимости и способности восстанавливать не только анатомическую форму сустава, но и его функциональные возможности [14].
Кроме того, значительные усилия были направлены на создание имплантатов из инновационных материалов. Например, титановые сплавы, обладающие высокой прочностью и устойчивостью к износу, были использованы для создания компонентов, подвергающихся наибольшим нагрузкам. В свою очередь, высококачественные пластики и полимеры применялись для создания более гибких и биосовместимых элементов, что снижало риск отторжения имплантатов и улучшало их интеграцию с окружающими тканями.
Однако, создание самих имплантатов – это лишь часть работы. Важным направлением также было совершенствование хирургических техник, которые позволяли минимизировать травматизм при установке имплантатов. Хирурги,
*»

Рис. 5. Роботизированная система Mako для операций по замене суставов от компании Stryker.
такие как А.А. Лимберг, В.М. Мыш, и П.И. Тихов предложили новые методы установки, которые способствовали снижению риска осложнений и более быстрому восстановлению пациентов после операции. Они внедрили улучшенные методы фиксации имплантатов, что обеспечивало долгосрочную стабильность и предотвращало повторное повреждение сустава. Операции становились более точными, а приживаемость имплантатов – стабильной. [14]
В 1966 г. Н.А. Плотников и А.М. Ткаченко предложили для восстановления подвижности нижней челюсти и ее удлинения использовать ортотопический аллотрансплантат ветви с головкой нижней челюсти, консервированной методом лиофилизации. После остеотомии ветви челюсти и удаления костного конгломерата проводилось формирование ямки в верхнем отделе костного конгломерата на уровне ее естественного расположения. Пересадка суставного конца осуществлялась вместе с частью ветви или тела в зависимости от степени выраженности микрогении. Этот метод позволял сформировать сустав на месте его естественного расположения, обеспечивал устранение микрогении и снижал долю рецидива анкилоза. Позже А.А. Никитин предложил при фиброзных анкилозах использовать лиофилизированный аллогенный полусустав с включением нижнего отдела сустава с суставным диском. Для устранения костных и особенно рецидивирующих анкилозов он рекомендовал производить пересадку полного сустава, содержащего суставную ямку с частью височной кости и суставным покрытием, головку нижней челюсти, суставной диск, капсулу и интракапсулярные связки [14]. В 1981 г. за разработку и внедрение в клиническую практику метода ортотопической аллотрансплантации при дефектах и деформациях нижней челюсти и ВНЧС А.А. Никитин в составе

авторского коллектива удостоен звания лауреата Государственной премии СССР, отмечен серебряной и бронзовой медалями ВДНХ, почетным знаком «Изобретатель СССР».
Важным этапом стало использование инновационных технологий, таких как CAD/CAM системы и 3D-печать, которые значительно улучшили точность разработки и изготовления индивидуальных имплантатов для пациентов. Эти технологии позволяют создавать имплантаты, которые идеально соответствуют анатомическим особенностям конкретного пациента, что в свою очередь снижает количество послеоперационных осложнений и ускоряет процесс восстановления. Современные методы 3D-моделирования позволяют точно воспроизводить форму и размеры суставов пациента, что повышает эффективность лечения и снижает риск отторжения имплантатов [10].
Что касается диагностики заболеваний ВНЧС, отечественные ученые также внесли значительный вклад в совершенствование диагностических технологий. Ведущие специалисты разработали новые методики, такие как улучшенные рентгенологические исследования и методы магнитно-резонансной томографии (МРТ), которые позволяли точно оценивать состояние сустава и проводить более точное планирование операции. Эти достижения сделали возможным более точное и своевременное вмешательство, что сыграло важную роль в повышении эффективности лечения и предотвращении осложнений [14].
Вклад отечественных ученых также заключался в разработке комбинированных подходов к лечению заболеваний ВНЧС, включающих как консервативные методы (медикаментозное лечение, физиотерапия), так и более радикальные способы вмешательства, такие как эндопротезирование. Эта многогранная работа позволила создать комплексный подход к лечению заболеваний ВНЧС, обеспечивая лучший прогноз для пациентов и минимизацию рисков.
По данным наших исследований (Епифанов С.А. и соавт., 2014), наиболее оптимально обоснованным является использование тотального эндопротеза ВНЧС с металлическим компонентом в области мыщелкового отростка нижней челюсти, созданным из титана высокой степени очистки, в сочетании с ответной частью из полиэтилена ультравы-сокой плотности, которая фиксируется в области суставной ямки и суставного бугорка височной кости. Указанные компоненты могут быть стандартными или изготовленными индивидуально [13;16]. Преимущества индивидуально изготовленных имплантатов заключаются в индивидуальной адаптации, где каждый имплантат разрабатывается с учетом анатомических особенностей пациента, что позволяет достичь лучшей совместимости и функциональности. Это, в свою очередь, обеспечивает функциональную эффективность, поскольку точное соответствие анатомии пациента может улучшить жевательную функцию и снизить нагрузку на соседние зубы и суставы. Также следует отметить снижение боли и дискомфорта, так как правильно подобранный и изготовленный имплантат значительно уменьшает болевые ощущения и дискомфорт, связанные с этиологической причиной проведения тотального эндопротезирования ВНЧС. Кроме того, индивидуальные имплантаты способствуют снижению риска осложнений, поскольку точные измерения и учет индивидуальных особенностей минимизируют вероятность развития осложнений и отторжения имплантата в послеоперационном периоде. Наконец, исследования показывают, что индивидуальные имплантаты обеспечивают более долгосрочные результаты по сравнению со стандартными решениями, что, в свою очередь, уменьшает необходимость в повторных операциях.
Таким образом, разработки отечественных ученых в области эндопротезирования ВНЧС, начиная от создания имплантатов и инновационных материалов до внедрения новых хирургических методик и технологий, сыграли ключевую роль в улучшении лечения заболеваний ВНЧС в России и в мире. Разработки отечественных ученых в области тотального эндопротезирования ВНЧС активно используются в международной практике.
Будущее эндопротезирования ВНЧС связано с развитием новых биосовмести-мых материалов, инновационными технологиями 3D-печати и роботизированных систем. Исследования, проведенные Smith, L. et al., предсказывают, что в ближайшие десятилетия технологии, использующие искусственный интеллект и био-принтинг, смогут значительно повысить точность и успешность операций. Это откроет новые возможности для применения эндопротезирования в лечении более широкого спектра заболеваний, включая ранние стадии дегенеративных заболеваний и травм [11].
Биопринтинг – это одна из самых перспективных технологий в совре-
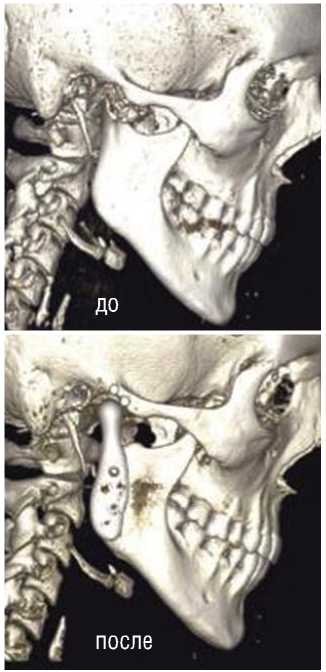
Рис. 6. КТ пациента до и через 36 месяцев после тотального эндопротезирования правого ВНЧС.
менной медицине, которая активно используется в области регенеративной медицины и ортопедической хирургии, включая эндопротезирование суставов, таких как ВНЧС.
Эта технология позволяет создавать трехмерные структуры, которые могут быть использованы для замены поврежденных тканей или для создания полностью функциональных имплантатов. Биопринтинг включает в себя использование живых клеток и биосовместимых материалов, что позволяет создавать имплантаты, которые не только обладают высокими механическими свойствами, но и интегрируются с тканями пациента, минимизируя риск отторжения.
Процесс биопринтинга включает создание трехмерных моделей анатомических структур на основе данных, полученных с помощью высокоточных методов визуализации. Затем с помощью специальных принтеров слои биоматериалов, содержащих клетки, наносятся друг на друга, создавая структуру, которая идеально соответствует анатомии пациента.

Рис. 7. Процесс 3D-биопечати и фотополимеризации на дефекте кости. A – восстановление дефекта кости с помощью 3D-биопечати in situ с альгинатным гидрогелем. Б – воздействие УФ-излучения. В – альгинатный гидрогель, который был напечатан для восстановления дефекта кости, был прозрачным до фотополимеризации. Г – цвет альгинатного гидрогеля стал молочно-белым после воздействия УФ-излучения в течение нескольких секунд. Дефект кости был восстановлен идеально [9; 11].
Одним из основных преимуществ биопринтинга является возможность использования аутологичных клеток. Это значительно снижает вероятность иммунного ответа и отторжения имплантата. В отличие от традиционных металлических или пластиковых имплантатов, биопринтированные структуры могут быть интегрированы в ткани, что ускоряет процесс восстановления и уменьшает количество осложнений [11].
Современные исследования в области биопринтинга для ВНЧС сосредоточены на создании хрящевых и костных компонентов сустава, а также на разработке функциональных материалов, которые могли бы имитировать механические свойства естественного сустава. Основные направления включают:
-
1. Хрящевые имплантаты/ Разработка хрящевых имплантатов, способных заменять поврежденные участки ВНЧС, является важным шагом в биопринтинге. Хрящ – это ткань, которая не имеет собственной способности к регенерации, поэтому биопринтинг позволяет создавать имплантаты, которые могут восполнять дефицит ткани и восстанавливать суставную поверхность.
-
2. Костные имплантаты. Совсем недавно ученые начали разрабатывать костные имплантаты, которые могут восстанавливать поврежденные кости сустава. Материалы для таких имплантатов включают биоразлагаемые полимеры и керамические материалы, которые обладают хорошими механическими свойствами и могут взаимодействовать с костной
-
3. Многоуровневые структуры. В некоторых случаях для более сложных случаев требуется создание многоуровневых имплантатов, которые включают различные типы тканей. Например, для восстановления полностью функционирующего ВНЧС могут потребоваться как костные, так и хрящевые компоненты. Био-принтинг позволяет создавать такие многоуровневые структуры, что дает возможность восстановить все компоненты сустава одновременно.
Отечественными специалистами (Епифанов С.А. и соавт.) предложена методика создания аутогенных носителей тканевых микрографтов или скаффолдов, основанная на взаимодействии фибрина и структур аутотканевого хрящевого имплантируемого материала. Данная методика позволяет получить стабильный сгусток клеток необходимой прочности и объема для его использования в качестве аутотрансплантата, а так же моделировать его в процессе имплантации. Уплотнение матричного геля значимо стимулирует прикрепление тканевых микрографтов к поверхности скаффолда и способствует формообразованию, моделируемому непосредственно на операционном столе [17].
тканью. Принтинг таких имплантатов с клеточными структурами позволяет ускорить процесс заживления и интеграции с тканями пациента.
Несмотря на существующие проблемы, биопринтинг имеет огромный потенциал в будущем. Прогнозируется, что с развитием технологий и улучшением методов печати биопринтинг станет неотъемлемой частью медицинской практики, позволяя создавать не только имплантаты для ВНЧС, но и для других суставов, а также для лечения повреждений мягких тканей и хрящей. Ученые надеются, что в ближайшие десятилетия технология биопринтинга позволит создать имплантаты, которые не только
будут иметь высокие механические характеристики, но и смогут активно взаимодействовать с организмом пациента, восстанавливая не только функциональность сустава, но и его биологическую активность.


