Исторические и современные аспекты хирургического лечения гипертрофической кардиомиопатии у детей (обзор литературы)
Автор: Кожанов Р. С., Егунов О. А., Связов Е. А., Кривощеков Е. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
Гипертрофическая кардиомиопатия (ГКМП) - частая генетически детерминированная патология миокарда, которая может проявляться в любом возрасте. Манифестация данной патологии в детском возрасте всегда означает высокий риск внезапной сердечной смерти и быстрое прогрессирование симптомов. Ежегодная смертность у бессимптомных пациентов старше 1 года составляет 1%. Существует множество рекомендаций по ведению пациентов с обструктивной кардиомиопатией, однако все они составлены для взрослой популяции. Медикаментозное лечение симптоматических пациентов с данной патологией эффективно лишь у 70% пациентов. У остальных 30% следует отдавать предпочтение хирургическому лечению. Для кардиохирурга важно знать основные методы коррекции ГКМП, их преимущества и недостатки. В литературном обзоре показана эволюция методов хирургической коррекции обструктивной ГКМП с середины XX в. по настоящее время. Представлены основные хирургические способы устранения динамического градиента на выводном отделе левого желудочка (ВОЛЖ), коррекции SAM-синдрома (systolic anterior motion syndrome) и митральной недостаточности, оказавших большое влияние на развитие хирургии ГКМП. Приведен клинический опыт устранения обструкции на ВОЛЖ у детей. Наиболее многообещающим на сегодняшний день является метод трансаортальной расширенной септальной миоэктомии. Таким образом, существует необходимость оценки и модификации уже имеющихся способов коррекции обструктивной ГКМП и их осложнений. Работы, направленные на их усовершенствование и устранение недостатков, являются перспективными.
Обструктивная гипертрофическая кардиомиопатия, расширенная трансаортальная миоэктомия, обструкция выводного отдела левого желудочка
Короткий адрес: https://sciup.org/149144446
IDR: 149144446 | УДК: 616.127-007.61-089-053.2 | DOI: 10.29001/2073-8552-2022-564
Текст обзорной статьи Исторические и современные аспекты хирургического лечения гипертрофической кардиомиопатии у детей (обзор литературы)
Гипертрофическая кардиомиопатия (ГКМП) – это генетически обусловленное заболевание сердца с аутосомно-доминантным типом наследования, характеризующееся утолщением стенок левого, реже правого желудочка при отсутствии дилатации его полостей [1, 2].
Распространенность данного заболевания – 1:500, а с учетом субклинических случаев и патогенных мутаций саркомера - 1:200 в популяции [3].
Патологоанатом D. Teare в 1958 г. впервые объединил весь накопленный опыт и обобщил характерные признаки ГКМП: идиопатическую гипертрофию миокарда, обструкцию выводного отдела левого желудочка (ВОЛЖ) и наследственность, дав название заболеванию «семейная гипертрофическая кардиомиопатия» [4]. Данное заболевание имело разнообразные названия, такие как идиопатический гипертрофический субаортальный стеноз, гипертрофическая обструктивная кардиомиопатия и мышечный субаортальный стеноз. Вместе с тем в описании данной патологии всегда присутствовал один и тот же симптом – выраженная обструкция ВОЛЖ, которая является характерным признаком для ГКМП [5].
Первым хирургом, описавшим субаортальный стеноз, был R. Brock в 1957 г., а первую миоэктомию выполнил W. Cleland в 1958 г. (рис. 1) [6, 7].
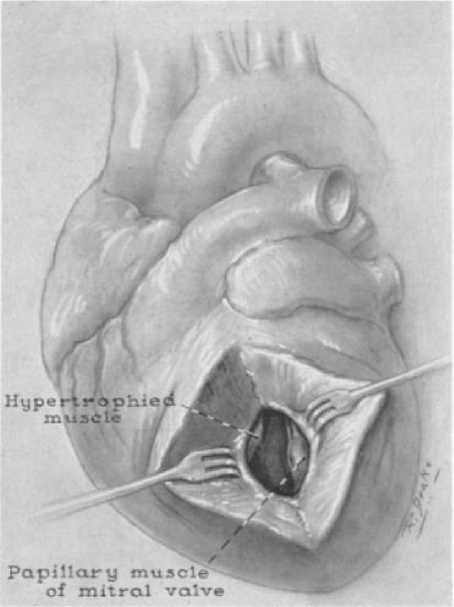
Рис. 1. Гипертрофическая обструктивная кардиомиопатия выводного отдела левого желудочка. Хирургическое обнажение через левый вентрикулотомный разрез
Fig. 1. Hypertrophic obstructive cardiomyopathy of the outflow tract of the left ventricle. Surgical exposure through left ventriculotomy incision
Ведущее место в патогенезе обструктивной ГКМП занимает систолическое движение передней створки митрального клапана (МК) (SAM-синдром), образующееся вследствие эффекта Вентури, и гипертрофия межжелудочковой перегородки (МЖП) [8]. Это приводит к существенной динамической обструкции на ВОЛЖ, недостаточности МК и диастолической дисфункции ЛЖ [9].
Существуют следующие подходы лечения ГКМП у детей – медикаментозная терапия, чрескожная алкогольная септальная аблация (АСА) и хирургическое лечение. Консервативное лечение эффективно приблизительно в 70% случаях [10]. АСА не показана детям вследствие высокого риска повреждения коронарных артерий, полной атриовентрикулярной блокады и остаточной рубцовой ткани в проводящих путях [11–13].
В настоящее время основным методом лечения ГКМП является оперативное вмешательство. Улучшение клинической картины и качества жизни происходит более чем у 90% пациентов [13, 14].
Хирургические подходы для коррекции патогенетических механизмов эволюционировали от простой трансаортальной миотомии с иссечением небольшого количества миокарда в зоне максимальной гипертрофии до трансаортальной расширенной септальной миоэктомии (СМЭ), широко применяющейся в настоящий момент [15]. Данная методика используется как у взрослых, так и у детей с обструктивной ГКМП [16, 17].
Цель данного обзора: описать все возможные хирургические подходы для коррекции обструктивной ГКМП у детей.
Этиология ГКМП
ГКМП наследуется по мендалевскому типу с переменной экспрессивностью и возрастной пенетрантностью [18]. Наиболее частой причиной гипертрофии являются мутации генов белков сердечного саркомера. У 70% генотипированных пациентов обнаруживаются мутации в гене бета-тяжелой цепи миозина (MYH7) и миозинсвязывающего белка С [19]. На данный момент известно более 1500 точечных мутаций, что усиливает межгенетическое разнообразие и делает малоэффективным генотипирование пациентов с ГКМП [20].
Классификация ГКМП
Формы ГКМП можно разделить на симметричную и асимметричную. При симметричной форме отношение толщины МЖП к задней стенке ЛЖ - менее 1,5 см, при асимметричной форме – более 1,5 см.
Наиболее часто используемыми классификациями ГКМП в хирургической практике являются гемодинамическая, анатомическая и морфологическая.
Выделяют следующие гемодинамические варианты:
-
• обструктивная (пиковый градиент давления > 30 мм рт. ст. в покое и при нагрузке);
-
• необструктивная (пиковый градиент давления < 30 мм рт. ст. в покое и при нагрузке);
-
• латентная (< 30 мм рт. ст. в покое и > 30 мм рт. ст. при нагрузке) [14].
Анатомические варианты подразделяются по уровню обструкции на базальную, среднежелудочковую и апикальную [21] (рис. 2).
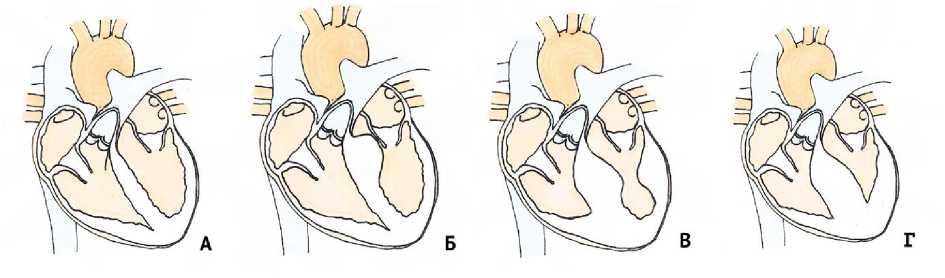
Рис. 2. А – нормальное сердце, Б – базальная обструкция, В – среднежелудочковая, Г – апикальная
Fig. 2. A – normal heart, Б – basal obstruction, B – midventricular, Г – apical
Морфологически можно выделить сигмовидную гипертрофию МЖП, двояковыпуклую («reverse curve»), гипертрофию другой стенки ЛЖ (задняя, боковая) и комбинированную (правый желудочек (ПЖ) и ЛЖ) [22].
Клиническая картина
ГКМП может диагностироваться в любом возрасте. Спектр клинических проявлений ГКМП варьирует от бессимптомного течения до выраженных проявлений сердечной недостаточности, которые включают в себя одышку при физической нагрузке, сердцебиение, перебои в работе сердца, боли в грудной клетке, головокружения вплоть до синкопальных состояний. Для данного заболевания свойственен высокий риск таких осложнений, как терминальная сердечная недостаточность, фибрилляция предсердий и желудочковая тахикардия. Наиболее устрашающим исходом ГКМП является внезапная сердечная смерть [23].
Диагностика
Одним из наиболее информативных исследований для диагностики ГКМП является эхокардиография с цветной допплерографией, с помощью которой можно оценить морфологию желудочков, предсердий, градиент давления на выводном отделе правого и левого желудочков, функции клапанов, а также систолическую и диастолическую функции сердца [24].
В качестве дополнительного способа оценки анатомии сердца используют магнитно-резонансную томографию (МРТ), которая предоставляет дополнительные данные о массе миокарда, объеме и функции ЛЖ, уровне и механизме обструкции ВОЛЖ [24, 25].
Естественное течение
Ежегодная летальность у бессимптомных пациентов с ГКМП старше 1 года составляет 1% [26]. У детей с клиническими проявлениями показатель смертности достигает 6% [17].
Лечение
Этиотропного лечения, позволяющего полностью устранить ГКМП, не разработано, поэтому целью лечения ГКМП является улучшение качества и продолжительности жизни [13].
В первую очередь пациентам с клиническими проявлениями проводят медикаментозное лечение, направленное на снижение выраженности симптомов и профилактику развития осложнений. Примерно в 70% случаях консервативная терапия приносит пользу [27].
В оставшихся 30% пациентам с ГКМП показано хирургическое устранение динамического градиента ВОЛЖ [27].
В настоящий момент трансаортальная расширенная СМЭ является одним из наиболее эффективных методов лечения обструктивной ГКМП у детей [28]. Несмотря на широкое распространение и хорошие результаты миоэктомии у взрослых, ее технические особенности, наличие осложнений и летальность у детей сильно разнятся и зависят от опыта кардиохирургического стационара.
История хирургического лечения ГКМП
Первые попытки хирургического лечения ГКМП были ограничены отсутствием адекватных методов визуализации, не позволяющих в должной мере оценивать морфологию желудочков, механизм SAM-синдрома и уровень обструкции ВОЛЖ. Именно поэтому разработка различных методов хирургической коррекции данной патологии была тесно связана с развитием методов кардиовизуализации [15].
В 1957 г. R. Brock впервые интраоперационно описал случай субаортального мышечного стеноза без каких-либо структурных изменений 8
аортального клапана (АК). До оперативного вмешательства определялись классические симптомы аортального стеноза с градиентом давления более 90 мм рт. ст. Во время операции АК был интактным. Автор отметил характерное утолщение эндокарда, связанное с МК (место непосредственного контакта). Однако R. Brock ошибочно полагал, что этиология мышечной гипертрофии сопряжена с системной гипертензией [6].
В том же году J. Goodwin сообщил о восьми случаях хирургического лечения обструктивной кардиомиопатии, «симулирующей» аортальный стеноз. Он полагал, что основной причиной данного синдрома была «асимметричная гипертрофия сердца» [29].
Первое хирургическое вмешательство с целью резекции утолщенной МЖП было выполнено W. Cleland в 1958 г. У пациента диагностировались классические признаки стеноза АК – стенокардия, одышка при физической нагрузке и обмороки. Градиент давления между ЛЖ и плечевой артерией составлял 60 мм рт. ст. Во время оперативного вмешательства АК был в норме. Указательным пальцем пальпировалась МЖП и определялась ее наиболее выступающая в ВОЛЖ часть. Затем через трансаортальный доступ иссекалась небольшая часть МЖП. Несмотря на небольшой объем резецированной перегородки, операция имела хороший эффект в облегчении симптомов [29].
Затем им же были описаны результаты операций еще у 6 пациентов с 1960 по 1962 гг. Летальность составила два случая из шести. У четверых наблюдалось заметное уменьшение симптомов в течение 4 лет после операции [7].
Одновременно с этим J. Kirklin и F. Ellis в 1959 и 1960 гг. в клинике Mayo прооперировали двух пациентов с обструкцией ВОЛЖ с использованием сочетания трансаортального и трансвентрикулярного доступов. Техническая особенность разработанной ими методики заключалась в том, что после пережатия аорты и аортотомии указательным пальцем левой руки определялся уровень максимальной обструкции, и в соответствии с анатомией коронарных артерий выполнялся разрез длиной около 2,5 см на верхушке ЛЖ. После 9
ушивания аорты и снятия с нее зажима через отверстие в ЛЖ пальпировали МЖП для оценки адекватного устранения гипертрофированного миокарда. Отверстие на желудочке ушивалось двурядным обвивным швом. У обоих пациентов обструкция ВОЛЖ была практически полностью купирована, но только у одного пациента было отмечено полное разрешение симптомов с возобновлением физической активности через 1 год после операции [30].
Клиника Mayo продолжила изучение и применение данной методики. Результаты был описаны еще у 14 больных R. Frye и соавт. в 1965 г. с успешно корригированной обструкцией ВОЛЖ. У 13 из 14 пациентов наблюдалось исчезновение предоперационных симптомов. Был только один послеоперационный летальный исход [31].
На базе Национального института в Bethesda в 1960 г. A. Morrow и соавт. опубликовали уникальный хирургический опыт лечения обструктивной ГКМП. Техника A. Morrow была направлена на устранение «констриктивного кольца» с помощью субаортальной миотомиии. После косой аортотомии и визуализации гипертрофированной мышечной массы, формирующей обструкцию ВОЛЖ, от фиброзного кольца АК в направлении верхушки производился разрез МЖП (2–2,5см) над наиболее выступающей частью. Затем разрез углублялся «тупым путем» левым указательным пальцем на глубину 2–3 см [32].
Позднее в 1964 г. C. Lillehei была предложена трансатриальная методика из правой заднебоковой торакотомии с иссечением гипертрофированной МЖП. Для этого требовалось отсечь створки МК по ФК с последующим их сшиванием [33]. Преимуществом данной методики было то, что обнажалась дистальная часть ЛЖ, в частности средняя и апикальная части МЖП при диффузной ГКМП без аортотомии и вентрикулотомии. Результаты были описаны у 2 пациентов. Только у одного пациента до оперативного вмешательства с помощью катетеризации сердца диагностировалась диффузная гипертрофия МЖП. Недостатком данного метода являлось вмешательство на
МК, которое в будущем приводило к недостаточности и необходимости в протезировании клапана [33].
В 1965 г. O. Julian предложил метод трансапикального доступа. В общей сложности было прооперировано 5 пациентов по поводу субаортального стеноза вследствие фибромышечной гипертрофии. Разрез выполнялся латеральнее и параллельно передней нисходящей артерии на верхушке сердца и составлял примерно 1,5–2 см. Летальных исходов в послеоперационном периоде не было. Техника предназначалась для обструкции средних отделов МЖП и при апикальных формах ГКМП с уменьшенным объемом ЛЖ [28]. Однако автор отмечал, что данный метод нуждается в дальнейшем изучении и сравнении отдаленных результатов после вентрикулотомии ЛЖ с оценкой его функции. Данный способ широко применяется при хирургическом лечении детей и продолжает изучаться в настоящее время [34].
Вместе с тем A. Morrow продолжил совершенствовать технику миотомии. В 1964 г. у 5 пациентов автор описал сочетание миотомии с частичной резекцией гипертрофированной МЖП. Было выполнено два параллельных поверхностных разреза над самой выступающей частью перегородки с расстоянием между разрезами примерно 1 см. Соединив два разреза между собой, резецировался фрагмент миокарда МЖП, что приводило к иссечению примерно 1–2,5 г гипертрофированной ткани. Сам A. Morrow отмечал, что, возможно, резекция не была необходимой, а изолированная миотомия без резекции кусочка мышцы была оптимальной для облегчения обструкции ВОЛЖ и связанных с ней симптомов [35].
К 1975 г. A. Morrow и соавт. прооперировали в общей сложности 83 пациента, используя улучшенный подход с двумя параллельными разрезами и иссечением утолщенного миокарда [36]. Главной технической особенностью было формирование «прямоугольного канала» размером около 1 × 1,5 см и длиной 4 или 5 см, начинающегося чуть ниже фиброзного кольца аорты по направлению к средней части МЖП. A. Morrow акцентировал внимание на глубине разреза, а не на его протяженности [35, 37] (рис. 3).
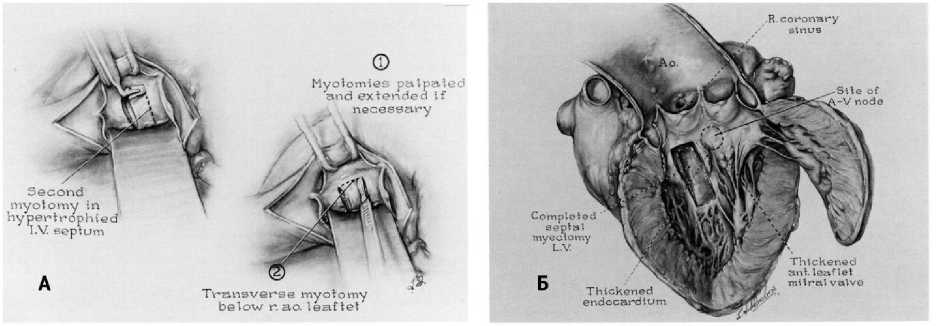
Рис. 3. А. Хирургическая коррекция по A. Morrow, Б. Изображение открытого левого желудочка, иллюстрирующее область и степень резекции перегородки и ее связь со створками аортального клапана и прилегающей перегородкой и проводящей тканью
Fig. 3. A. Surgical correction according to A. Morrow, Б. An image of the open left ventricle illustrating the area and extent of septal resection and its relationship to the aortic valve leaflets and the adjacent septum and conduction tissue
Еще один вариант миоэктомии был предложен D. Cooley в 1967 г. с доступом через ПЖ. Суть способа заключалась в иссечении гипертрофированных мышечных волокон через правую вентрикулотомию с последующей пластикой ВОПЖ аутоперикардиальной заплатой. Данный метод был выполнен 9 пациентам и эффективно уменьшал обструкцию на ВОЛЖ и улучшал диастолическую функцию ЛЖ. В раннем послеоперационном периоде было отмечено 5 летальных исходов вследствие сердечной недостаточности [38].
В 1990-х гг. модифицированная методика по D. Cooley продвигалась институтом НЦССХ им. А.Н. Бакулева и имела явное преимущество в связи с возможностью выполнения операции на работающем сердце [39]. Довольно часто возникала необходимость в последующей коррекции недостаточности МК, поэтому методика не получила дальнейшего развития. В настоящее время данный способ применяется для устранения бивентрикулярной обструкции в сочетании с трансаортальной миоэктомией у синдромальных детей с низкой летальностью [39].
Длительное время СМЭ по A. Morrow являлась оптимальным вариантом лечения ГКМП. Недостаточная субаортальная резекция и аномалии подклапанного аппарата МК не всегда позволяли полностью устранить обструкцию ВОЛЖ и приводили к повторным оперативным вмешательствам. Единственным способом по методике Morrow полностью устранить градиент и эффективно избавиться от недостаточности МК было его протезирование с иссечением подклапанных структур [37].
В 1994 г. B. Messmer представил концепцию трансаортальной расширенной СМЭ при обструктивной ГКМП [40]. Он пришел к выводу, что классическая техника Morrow имела изъян в том, что недостаточная резекция дистальной части гипертрофированной МЖП сохраняет SAM-синдром и симптомы ГКМП. В своей методике B. Messmer с помощью острого ретрактора через АК вводил и зацеплял самую выпуклую часть перегородки. Затем он проводил дополнительную резекцию в месте соединения перегородки и боковой стенки ЛЖ, а также в месте соединения перегородки и задней стенки на уровне средней части МЖП. B. Messmer считал, что SAM-синдром и митральная недостаточность были вызваны чрезмерной гипертрофией и неправильным положением папиллярных мышц, вызывающих смещение створок МК в систолу. Его методика трансаортальной СМЭ включала освобождение от вторичных хорд и аномальных папиллярных мышц, не несущих функций мышц [41] (рис. 4).
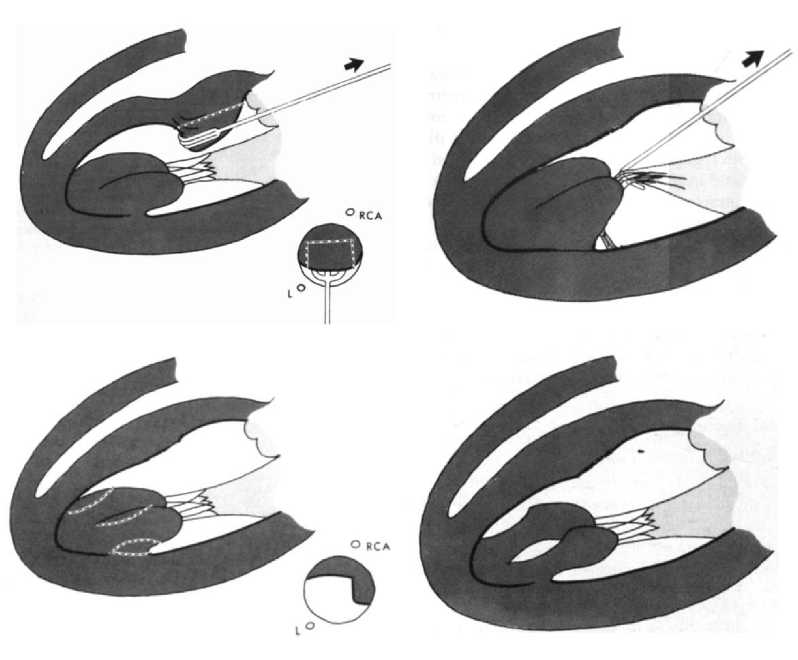
Рис. 4. Хирургическая коррекция, предложенная B. Messmer
Fig. 4. Surgical correction according to B. Messmer
Роль митрального клапана в формировании обструкции ВОЛЖ
Отдельно стоит упомянуть о роли МК в лечении ГКМП.
V.O. Bjork в 1961 г. впервые описал аномальное движение передней створки МК, которое в последующем получило название SAM-синдром [42]. Но потребовалось еще около 20 лет эхокардиографических и ангиографических исследований, прежде чем была доказана связь гипертрофии МЖП с движением передней створки МК как причины градиента на ВОЛЖ и недостаточности МК [43].
В мире до сих пор ведутся споры относительно необходимости вмешательства на МК при ГКМП. Одни авторы считают, что больным с обструктивной ГКМП достаточно СМЭ и нет необходимости в сочетанной хирургической коррекции митральной недостаточности. Другие же полагают, что комбинированное оперативное вмешательство, подразумевающее СМЭ с различными видами пластики МК, наиболее эффективно для устранения градиента на ВОЛЖ, митральной недостаточности и основных симптомов ГКМП [44].
D.A. Cooley и соавт. выступали за протезирование МК для уменьшения обструкции выходного тракта у пациентов с ГКМП [45].
Предложенная современная трансаортальная расширенная СМЭ исключает вмешательство на структурно нормальном МК при адекватно корригированной обструкции ВОЛЖ, даже при гемодинамически значимой недостаточности МК [12, 15, 17, 26].
Современная методика миоэктомии
Современная методика, используемая в клинике Mayo, усовершенствовалась и дополнялась на протяжении 30 лет. Опыт лечения насчитывает более 3000 пациентов с ГКМП. [46].
После кардиоплегической остановки сердца и косой аортотомии визуализируется субаортальная область МЖП и передняя створка МК (ПСМК). Дополнительная визуализация гипертрофированной апикальной и среднежелудочковой части МЖП возможна с помощью перикардиальных швов на правой стороне сердца и швов-держалок на створках АК.
Первый разрез МЖП начинается на 4–5 мм ниже правого коронарного синуса и продолжается по направлению к верхушке сердца. Второй разрез МЖП выполняется с отступом 2–3 мм книзу от комиссуры между левой и правой коронарными створками по направлению к верхушке. Глубина и длина разрезов зависят от толщины гипертрофированной МЖП, которая определялась по эхокардиографии. Затем два разреза соединяются между собой с иссечением участка МЖП трапециевидной формы. При необходимости миоэктомии в апикальной части МЖП для ее визуализации осуществляется нажатие тупфером на ПЖ.
Что касается МК, любые аномальные папиллярные мышцы и вторичные хорды, которые не несут никакой функциональной нагрузки, должны быть иссечены. Они могут дополнительно вызывать обструкцию ВОЛЖ.
Ключевым принципом адекватного устранения градиента на ВОЛЖ является то, что глубина иссечения перегородки менее важна, чем длина резецируемого участка [26]. Остаточный SAM-синдром и обструкция чаще всего являются результатом неадекватно выполненной трансаортальной расширенной СМЭ [46]. (рис. 5).
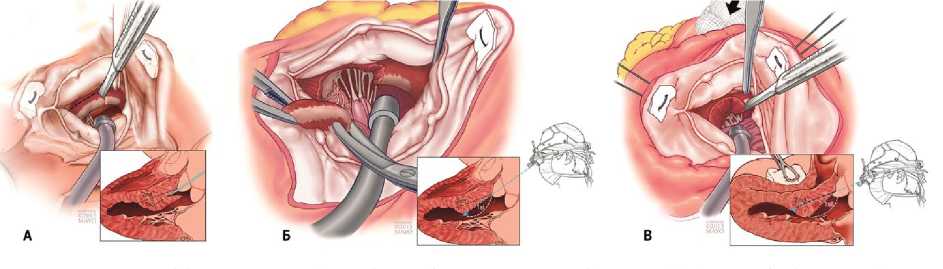
Рис. 5. А, Б – Операционные этапы трансаортальня расширенная септальной миоэктомии с исходным иссечением гипертрофированной перегородки. В – Показывает расширение разреза по направлению к верхушке левого желудочка Fig. 5. A, Б – Operative stages of transaortal extended septal myectomy with initial excision of the hypertrophied septum. В – Shows extension of the incision toward the apex of the left ventricule
Данный способ устраняет диффузную гипертрофию МЖП, распространяющуюся на папиллярные мышцы, выраженное утолщение средней и апикальной части перегородки и аномальные папиллярные мышцы с прикреплением к МК [27]. Правильно выполненная трансаортальная расширенная СМЭ с достаточной глубиной и длиной иссечения МЖП позволяет избежать не только обструкции, но и протезирования МК и его отдаленных осложнений [12, 27, 46].
Накопленный опыт оперативного вмешательства у детей
Хирургическое лечение обструктивной ГКМП у детей описывалось еще в 1959 г. F. Goodwin и соавт. [7]. Опыт вмешательств в те годы был связан с более высокой частотой осложнений и ранней послеоперационной летальностью. Все это требовало дальнейшего усовершенствования методов хирургического лечения обструкции ВОЛЖ в педиатрической популяции.
В настоящее время «золотым стандартом» лечения обструктивной ГКМП у детей является трансаортальная расширенная СМЭ. Однако до сих пор существует много нерешенных вопросов относительно оптимального возраста для хирургического лечения детей с ГКМП, основных показаний для операции и необходимости вмешательств на МК.
В ряде современных публикаций средний возраст на момент оперативного вмешательства составляет 11,75 лет. Это связано с недостаточным размером фиброзного кольца АК и затруднительным доступом к гипертрофированной МЖП. Зачастую именно ограничение визуализации через фиброзное кольцо приводит к осложнениям. При достижении подходящего размера клапана возможно избежать ятрогенный дефект МЖП, повреждения МК и АК и добиться адекватного устранения обструкции на ВОЛЖ [12, 17, 26].
Необходимость сопутствующей хирургической коррекции недостаточности МК при ГКМП вызывает вопросы.
Согласно данным клиники Mayo, которая имеет наибольший опыт лечения ГКМП, вмешательство на МК является скорее исключением и необходимо лишь при врожденной аномалии его структур, пролапсе и отрыве хорд [26]. В остальных же случаях регургитация на клапане и SAM-синдром устраняется после успешно выполненной миоэктомии. Однако встречаются клинические случаи ГКМП, когда единственным способом устранить градиент на ВОЛЖ является протезирование МК. Чаще всего у детей это связано с генетическими синдромами и генными мутациями.
Очень важно, чтобы ранняя послеоперационная летальность составляла менее 1%. Этого возможно добиться только в специализированных центрах с накопленным опытом [17, 47, 48].
Заключение
Таким образом, несмотря на более чем полувековую историю хирургического лечения ГКМП у детей, в современных клинических рекомендациях по ведению и лечению пациентов с данной патологией нет четких указаний по выбору тактики и техники оперативного вмешательства.
Применение методики трансаортальной расширенной СМЭ в детской популяции сопровождается рисками – ятрогенным дефектом МЖП, повреждением АК и МК, нарушениями ритма сердца и имеет ограничение – это размер ФК АК.
В России на сегодняшний день отсутствуют общепринятые утвержденные показания к оперативному вмешательству и оптимальный возраст для детей с ГКМП. Все это требует дальнейшего изучения данной проблемы.
Список литературы Исторические и современные аспекты хирургического лечения гипертрофической кардиомиопатии у детей (обзор литературы)
- Дземешкевич С.Л., Мотрева А.П., Калачанова Е.П., Никитюк Т.Г., Мартьянова Ю.Б., Калмыкова О.В. и др. Манифестация гипертрофической кардиомиопатии у детей: фенотип, генотип и особенности хирургического лечения. Клиническая и экспериментальная хирургия. Журнал имени Б.В. Петровского. 2021;3(9):16-24. https://doi.org/10.33029/2308-1198-2021-9-3-16-24.
- Semsarian C., Ingles J., Maron M.S., Maron B.J. New perspectives on the prevalence of hypertrophic cardiomyopathy. J. Am. Coll. Cardiol. 2015;65(12):1249-1254. https://doi.org/10.1016/j.jacc.2015.01.019.
- Maron B.J., Gardin J.M., Flack J.M., Gidding S.S., Kurosaki T.T., Bild D.E. Prevalence of hypertrophic cardiomyopathy in a general population of young adults. Echocardiographic analysis of 4111 subjects in the CARDIA Study. Coronary artery risk development in (young) adults. Circulation. 1995;92:785- 789. https://doi.org/10.1161/01.cir.92.4.785.
- Teare D. Asymmetrical hypertrophy of the heart in young adults. Br. Heart J. 1958; 20(1):1-8. https://doi.org/10.1136/hrt.20.1.1.
- Maron M.S., Olivitto I., Betocchi S., Casey S.A., Lesser J.R., Maria A.L. et al. Effect of left ventricular outflow tract obstruction on clinical outcome in hypertrophic cardiomyopathy. N. Engl. J. Med. 2003;348(4):295-303. https://doi.org/10.1056/NEJMoa021332.
- Brock R. Functional obstruction of the left ventricle; acquired aortic subvalvar stenosis. Guy's Hospital reports. 1957;106(4):221-238.
- Cleland W.P. The surgical management of obstructive cardiomyopathy. J. Cardiovasc. Surg. (Torino). 1963;4:489-491.
- Iwata Y., Imai Y., Shin’oka T., Kurosawa H. Subaortic stenosis associated with systolic anterior motion. Heart and vessels. 2008;23(6):436-439. https://doi.org/10.1007/s00380-008-1078-1.
- Menon S.C., Eidem B.W., Dearani J.A., Ommen S.R., Ackerman M.J., Miller D. Diastolic dysfunction and its histopathological correlation in obstructive hypertrophic cardiomyopathy in children and adolescents. J. Am. Soc. Echocardiogr. 2009;22(12):1327-1334. https://doi.org/10.1016/j.echo.2009.08.014.
- Maron M.S., Olivotto I., Zenovich A.G., Link M.S., Pandian N.G., Kuvin J.T. et al. Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction. Circulation. 2006;114(21):2232-2239. https://doi.org/10.1161/CIRCULATIONAHA.106.644682.
- Gersh B.J., Maron B.J., Bonow R.O., Dearani J.A., Fifer M.A., Mark S. et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2011;124(24):2761-2796. https://doi.org/10.1161/CIR.0b013e318223e230.
- Xu H., Yan J., Wang Q., Li D., Guo H., Li S. et al. Extended septal myectomy for hypertrophic obstructive cardiomyopathy in children and adolescents. Pediatric Cardiology. 2016;37(6):1091-1097. https://doi.org/10.1007/s00246-016-1396-5.
- Maron B.J., Desai M.Y., Nishimura R.A., Spirito P., Rakowski H., Towbin J.A. et al. Management of hypertrophic cardiomyopathy JACC State-of-the-Art Review. J. Am. Coll. Cardiol. 2022;79(4):390-414. https://doi.org/10.1016/j.jacc.2021.11.021.
- Габрусенко С.А., Гудкова А.Я., Козиолова Н.А., Александрова С.А., Берсенева М.И., Гордеева М.Л. и др. Гипертрофическая кардиомиопатия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):269-333. https://doi.org/10.15829/1560-4071-2021-4541.
- Hang D., Nguyen A., Schaff H.V. Surgical treatment for hypertrophic cardiomyopathy: a historical perspective. Ann. Cardiothorac. Surg. 2017;6(4):318-328. https://doi.org/10.21037/acs.2017.04.03.
- Wang S., Luo M., Sun H., Song Y., Yin C., Wang L. et al. A retrospective clinical study of transaortic extended septal myectomy for obstructive hypertrophic cardiomyopathy in China. Eur. J. Cardiothoracic Surg. 2013;43(3):534-540. https://doi.org/10.1093/ejcts/ezs332.
- Arghami A., Dearani J.A., Said S.M., O’Leary P.W., Schaff H.V. Hypertrophic cardiomyopathy in children. Ann. Cardiothorac. Surg. 2017;6(4):376-385. https://doi.org/10.21037/acs.2017.07.04.
- Леонтьева И.В., Макарова В.А. Гипертрофическая кардиомиопатия у детей. Российский вестник перинатологии в педиатрии. 2013;5:23-33.
- Maron B.J., Maron M.S., Semsarian C. Genetics of hypertrophic cardiomyopathy after 20 years: clinical perspectives. J. Am. Coll. Cardiol. 2012;60(8):705-715. https://doi.org/10.1016/j.jacc.2012.02.068.
- Marian A.J., Braunwald E. Hypertrophic cardiomyopathy: genetics, pathogenesis, clinical manifestations, diagnosis, and therapy. Circulation research. 2017;121(7):749-770. https://doi.org/10.1161/CIRCRESAHA.117.311059.
- Wu J.J., Seco M., Medi C., Semsarian C., Richmond D.R., Dearani J.A. et al. Surgery for hypertrophic cardiomyopathy. Biophys. Rev. 2015;7(1):117-125. https://doi.org/10.1007/s12551-014-0153-3.
- Binder J, Ommen S.R., Gersh B.J., Van Driest S.L., Tajik A.J., Nishimura R.A. et al. Echocardiography-guided genetic testing in hypertrophic cardiomyopathy: septal morphological features predict the presence of myofilament mutations. Mayo Clin. Proc. 2006; 81(4):459-467. https://doi.org/10.4065/81.4.459.
- Maron B.J., Ommen S.R., Semsarian C., Spirito P., Olivotto I., Maron M.S. Hypertrophic cardiomyopathy. Present and Future, with translation into contemporary cardiovascular medicine. J. Am. Coll. Cardiol. 2014;64(1):83-99. https://doi.org/10.1016/j.jacc.2014.05.003.
- Gersh B.J., Maron B.J., Bonow R.O., Dearani J.A., Fifer M.A., Link M.S. et al. ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: Executive summary: A report of the American College of cardiology foundation/ American heart association task force on practice guidelines. Circulation. 2011;124(24):2761-2796. https://doi.org/10.1161/CIR.0b013e318223e230.
- Harris K.M., Spirito P., Maron M.S., Zenovich A.G., Formisano F., Lesser R.J. et al. Prevalence, clinical profile and significance of left ventricular remodeling in the end-stage phase of hypertrophic cardiomyopathy. Circulation. 2016;114(3):216-225. https://doi.org/10.1161/CIRCULATIONAHA.105.583500.
- Altarabsheh S.E., Dearani J.A., Burkhart H.M., Schaff H.V., Deo S.V., Eidem B.W. et al. Outcome of septal myectomy for obstructive hypertrophic cardiomyopathy in children and young adults. Ann. Thorac. Surg. 2013;95(2):663- 669. https://doi.org/10.1016/j.athoracsur.2012.08.011.
- Sun D., Schaff H.V., Nishimura R.A., Geske B.J., Dearani J.A., Ommen S.R. Surgical management of diastolic heart failure after septal myectomy for obstructive hypertrophic cardiomyopathy. JTCVS Tech. 2021;11:21-26. https://doi.org/10.1016/j.xjtc.2021.10.050.
- Minakata K., Dearani J.A., O’Leary P.W., Danielson G.K. Septal myectomy for obstructive hypertrophic cardiomyopathy in pediatric patients: early and late results. Ann. Thorac. Surg. 2005;80(4):1424-1430. https://doi.org/10.1016/j.athoracsur.2005.03.109.
- Goodwin J.F., Hollman A., Cleland W.P., Teare D. Obstructive cardiomyopathy simulating aortic stenosis. Br. Heart J. 1960;22(3):403-414. https://doi.org/10.1136/hrt.22.3.403.
- Kirklin J.W., Ellis F.H. Surgical relief of diffuse subvalvular aortic stenosis. Circulation. 1961;24:739-742. https://doi.org/10.1161/01.cir.24.4.739.
- Frye R.L., Kincaid O.W., Swan H.J., Kirklin J.W. Results of surgical treatment of patients with diffuse subvalvular aortic stenosis. Circulation. 1965;32:52-57. https://doi.org/10.1161/01.cir.32.1.52.
- Morrow A.G., Lambrew C.T., Braunwald E. Idiopathic hypertrophic subaortic stenosis. II. Operative treatment and the results of pre- and postoperative hemodynamic evaluations. Circulation. 1964;30(4):120-151.
- Lillehei C.W., Levy J. Transatrial exposure for correction of subaortic. JAMA. 1963;186(1):8-13. https://doi.org/10.1001/jama.1963.03710010042005.
- Julian O.C., Dye W.S., Javid H., Hunter J.A., Muenster J.J., Najafi H. Apical left ventriculotomy in subaortic stenosis due to a fibromuscular hypertrophy. Circulation. 1965;31(1):44-56. https://doi.org/10.1161/01.CIR.31.4S1.I-44.
- Morrow A.G., Brockenbrough E.C. Surgical treatment of idiopathic hypertrophic subaortic stenosis: technic and hemodynamic results of subaortic ventriculomyotomy. Ann. Surg. 1961;154(2):181-189. https://doi.org/10.1097/00000658196108000-00003.
- Morrow A.G., Fogarty T.J., Hannah H., Braunwald E. Operative treatment in idiopathic hypertrophic subaortic stenosis. Techniques, and the results of preoperative and postoperative clinical and hemodynamic assessments. Circulation. 1968;37(4):589-596. https://doi.org/10.1161/01.cir.37.4.589.
- Morrow A.G. Hypertrophic subaortic stenosis. Operative methods utilized to relieve left ventricular outflow obstruction. J. Thorac. Cardiovasc. Surg. 1978;76(4):423-430.
- Cooley D.A., Bloodwell R.D., Hallman G.L., Lasorte A.F., Leachman R.D., Chapman D.W. Surgical treatment of muscular subaortic stenosis results from septectomy in twenty-six patients. Circulation. 1967;35(4):124-132. https://doi.org/10.1161/01.CIR.35.4S1.I-124.
- Бокерия Л.А., Борисов К.В., Синёв А.Ф., Злочевская Е.В. Хирургическое лечение гипертрофической обструктивной кардиомиопатии у детей. Детские болезни сердца и сосудов. 2005;1:23-29.
- Messmer B.J. Extended myectomy for hypertrophic obstructive cardiomyopathy. Ann. Surg. 1994;58(2):575-577. https://doi.org/10.1016/0003-4975(94)92268-3.
- Schoendube F.A., Klues H.G., Reith S., Messmer B.J. Surgical correction of hypertrophic obstructive cardiomyopathy with combined myectomy, mobilisation and partial excision of the papillary muscles. Eur. J. Cardiothorac. Surg. 1994;8(11):603-608. https://doi.org/10.1016/1010-7940(94)90044-2.
- Bjork V.O., Hultquist G., Lodin H. Subaortic stenosis produced by an abnormally placed anterior mitral leaflet. J. Thorac. Cardiovasc. Surg. 1961;41(5):659-669. https://doi.org/10.1016/S0022-5223(20)31663-9.
- Pollick C., Morgan C.D., Gilbert B.W., Rakowski H., Wigle E.D. Muscular subaortic stenosis: the temporal relationship between systolic anterior motion of the anterior mitral leaflet and the pressure gradient. Circulation. 1982;66(5):1087- 1094. https://doi.org/10.1161/01.cir.66.5.1087.
- Валиева Л.М., Джорджикия Р.К., Вагизов И.И., Хайруллин Р.Н., Мухарямов М.Н. Хирургическое лечение митральной недостаточности при обструктивной гипертрофической кардиомиопатии. Кардиология и сердечно-сосудистая хирургия. 2020;13(5):396-402. https://doi.org/10.17116/kardio202013051396.
- Krajcer Z., Leachman R.D., Cooley D.A., Coronado R. Septal myotomymyomectomy versus mitral valve replacement in hypertrophic cardiomyopathy. Ten-year follow-up in 185 patients. Circulation. 1989;80(1):157-164.
- Dearani J.A., Danielson G.K. Septal myectomy for obstructive hypertrophic cardiomyopathy. Semin. Thorac. Cardiovasc. Surg. Pediatr. Card. Surg. Annu. 2005;8(1):86-91. https://doi.org/10.1053/j.pcsu.2005.01.003.
- Zhu C., Wang S., Ma Y., Wang S., Zhou Z., Yan J. et al. Childhood hypertrophic obstructive cardiomyopathy and its relevant surgical outcome. Ann. Thorac. Surg. 2020;110(1):207-213. https://doi.org/10.1016/j.athoracsur.2019.10.016.
- Dearani J.A., Ommen S.R., Gersh B.J., Schaff H.V., Danielson G.K. Surgery Insight: septal myectomy for obstructive hypertrophic cardiomyopathy - the Mayo Clinic experience. Nat. Clin. Pract. Cardiovasc. Med. 2007;4(9):503-512. https://doi.org/10.1038/ncpcardio0965.


