История развития и сравнительная оценка современных стентов для коронарных артерий
Автор: Смирнов Кирилл Алексеевич, Бирюков А.В., Иванченко Р.Д., Овчаренко Д.В., Воронков А.А., Трусов И.С., Нифонтов Е.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Обзоры
Статья в выпуске: 1S т.23, 2019 года.
Бесплатный доступ
К операциям прямой реваскуляризации миокарда относятся стентирование коронарных артерий, аортокоронарное и маммарокоронарное шунтирования. Коронарное стентирование является наиболее распространенным методом реваскуляризации, однако с высокой частотой поздних осложнений, таких как рестенозы и поздние коронарные тромбозы. Причины осложнений зависят от ряда факторов, в том числе от типа стента. В то время как повреждение стенки сосуда коррелировало с рестенозом в эпоху голометаллических стентов, его влияние было минимизировано с помощью стентов с лекарственным покрытием, что, вероятно, связано с использованием мощных антипролиферативных препаратов с кинетикой пролонгированного высвобождения, которые глубоко подавляют репаративную реакцию на повреждение артерии. Однако после имплантации стентов с лекарственным покрытием наблюдается повреждение сосуда, вторичное к токсичности лекарства или воспалению, вызванному полимером. В клинической практике существует огромное разнообразие видов и моделей стентов, которые имеют разные показания и противопоказания к применению. Важным фактором, влияющим на риск поздних осложнений, является неоинтимальное сосудистое заживление, которое можно оценить с помощью различных методов внутрисосудистой визуализации, в частности оптической когерентной томографии. Целью данного обзора литературы, описывающего эволюцию коронарных стентов, является систематизация основных результатов исследований по использованию различных платформ стентов. Кроме того, в статье представлены современные методы оценки пролиферации неоинтимы, а также вводится понятие показателя заживления (Healing Score), отражающего процесс сосудистого заживления и влияющего на характер и длительность двойной антиагрегантной терапии.
Голометаллический стент, индекс сосудистого заживления, оптическая когерентная томография, стент с лекарственным покрытием, стентирование, сосудистое заживление, сосудистый каркас
Короткий адрес: https://sciup.org/142230691
IDR: 142230691 | DOI: 10.21688/1681-3472-2019-1S-S9-S17
Текст обзорной статьи История развития и сравнительная оценка современных стентов для коронарных артерий
В 1960-х гг. для лечения коронарных стенозов, ассоциированных с ишемической болезнью сердца, разработано аортокоронарное шунтирование, которое помогло спасти сотни жизней, но не могло быть применено в рутинной практике. В дальнейшем появились минимально инвазивные методы лечения, в частности баллонная ангиопластика, однако, как оказалось, они имели недостаток, заключающийся в более позднем сужении или стенозе коронарного сосуда. С целью предотвращения рестеноза коронарных артерий после баллонной ангиопластики были разработаны поддерживающие имплантаты или стенты. Концепция транс- люминальной установки стента из нержавеющей стали в качестве протезного устройства для механической поддержки артериальных сосудов была описана еще C.T. Dotter в доклинических экспериментах в 1969 г. [1], на основе которых они были введены в клиническую практику в 1990-х гг. Целью данного обзора литературы, описывающего эволюцию коронарных стентов, является систематизация основных результатов исследований по использованию различных платформ стентов. Кроме того, в статье представлены современные методы оценки пролиферации неоинтимы, а также вводится понятие показателя заживления (Healing Score), отражающего процесс сосудистого заживления.
Статья доступна по лицензии Creative Commons Attribution 4.0.
Типы стентов. Проблемы и пути решения
Стенты представляют собой трубчатые имплантаты для механической поддержки стенотически измененных сосудов. Стенты бывают саморасширя-ющиеся (изготовленные из металла «с памятью») или расширяемые баллоном. Типичные конструкционные материалы для производства постоянных голометаллических стентов изготовлены из никель-титановых сплавов (нитинола) для самораскрывающихся стентов и нержавеющей стали или кобальт-хромового сплава для баллонно-расширяемых стентов [ 2 ].
Клиническая эпоха сосудистого вмешательства в качестве альтернативы «открытому» оперативному вмешательству началась в 1977 г. с введения баллонной ангиопластики Gruntzig и др. [ 3 ], с последующей первой имплантацией человеку саморасширяющего-ся стента в 1986 г. Sigwart и др. [ 4 ], а в дальнейшем и первой имплантацией баллонно-расширяемого стента в 1987 г. Palmaz и соавт. [ 5 ].
Результаты рандомизированных клинических испытаний BENESTENT и STRESS в конечном итоге привели к массовому применению стентирования в середине 1990-х гг. [ 6, 7 ]. Уже в 1998 г. более 500 тыс. пациентов в США подверглись сосудистому вмешательству с использованием стентирования коронарных артерий, что составило более 50% всех случаев лечения коронарных стенозов [ 8 ].
Однако в ходе эксплуатации данного метода на первый план вышла опасность возникновения рестеноза и даже тромбоза в имплантированном стенте. Рестеноз индуцируется повреждением сосудов во время имплантации стента, что приводит к гиперплазии неоинтимы, вызванной пролиферацией и миграцией гладкомышечных клеток. Как показала практика, примерно 15–20% всех случаев стентирования требуют повторного вмешательства в течение 6–12 мес. после имплантации голометаллического стента (англ. Bare Metal Stent, BMS) [ 7 ].
Предпринимались попытки уменьшения частоты рестенозов в стентах путем модификации голометаллических стентов, однако значимое снижение данного показателя достигнуто только с появлением стентов с лекарственным покрытием, которые с того времени претерпели изменения. Первое поколение стентов с лекарственным покрытием состояло из голометаллической основы, перманентного неабсорбируемого полимерного покрытия и активного лекарственного агента, включенного в полимер. Снижение частоты рестеноза стента обусловлено тем, что в месте сосудистого повреждения после имплантации стента появляется высокая концентрация антипролиферативного или иммунносупрессивного агента [9]. Так, результаты исследования RAVEL подтвердили, что необходимость повторного вмешательства у пациентов после имплантации стентов с лекарственным покрытием (англ. Drug Eluting Stent, DES) ниже на 70% по сравнению с больными после имплантации голометаллических стентов [10, 11].
После одобрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (англ. Food and Drug Administration, FDA) для клинического применения в 2003 г. частота использования стентов с лекарственным покрытием в США составила 35% всех имплантированных стентов [ 12 ], в 2005 г. увеличилась до 75% [13], а в 2006 г. — до 90% [ 14, 15 ] .
Однако, несмотря на эффективное уменьшение частоты рестенозов, описаны первые случаи смерти или инфаркта миокарда у пациентов после имплантации стентов с лекарственным покрытием [ 16–18 ] . При дальнейшем изучении проблемы выявлено, что стенты с лекарственным покрытием увеличивают риск позднего тромбоза, ассоциированного с замедленным сосудистым заживлением. Кроме этого, описаны случаи гиперчувствительности к компонентам стента, в связи с чем возник вопрос о долгосрочной биосовместимости нанесенного полимерного покрытия [ 13 , 19, 20 ] .
Стоит отметить, что с покрытием, которое использовалось в первом поколении стентов, были связаны механические осложнения — отслаивание и возникновение «трещин» полимера, что в сочетании с неровным покрытием стента приводило к непредсказуемому высвобождению и распространению лекарственного агента.
Ряд проблем был решен при разработке второго поколения стентов с лекарственным покрытием. Улучшенные полимерные покрытия, как постоянные, так и биодеградируемые, а также неполимерные альтернативы вместе с лекарственными агентами призваны улучшить сосудистое заживление и эндо-телизацию после имплантации стентов с лекарственным покрытием. Второе поколение стентов с лекарственным покрытием включает Endeavor (Medtronic, США), Resolute (Medtronic, США), Xience V (Abbot Vascular, США), Promus (Boston Scientific, США), M-Sure S (Multimedics, Индия).
Для повышения безопасности стентов с лекарственным покрытием второго поколения применяют
% ,атнетс азобморт ьтсонжомзо
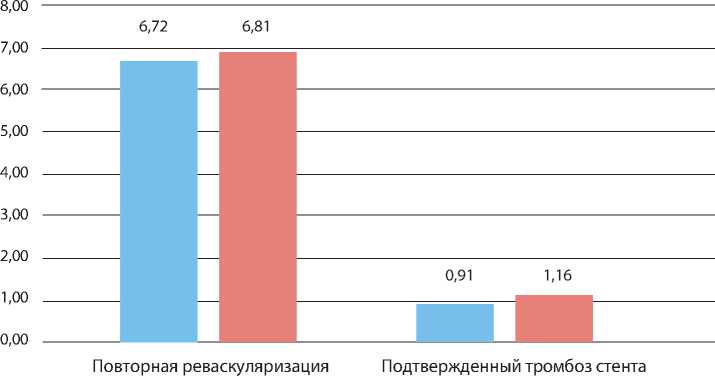

Биодеградируемый полимер Постоянный полимер
Рис. 1. Сравнение биодеградируемого и постоянного полимеров при оценке возможного тромбоза стента более биосовместимые или биорассасываемые полимеры, которые в конечном счете резорбируются с поверхности стента и аналогично голометаллическому стенту не вызывают хронического воспаления. Некоторые исследования показали, что биорассасы-вающийся полимер является более эффективным, чем голометаллический стент, и, возможно, более безопасным, чем первое поколение стентов с лекарственным покрытием за счет снижения риска очень позднего тромбоза стента [21]. Более того, стенты с лекарственным покрытием второго поколения, имеющие фторированный полимер на кобальт-хромовой основе (Xience V, Abbott Vascular, Promus, Boston Scientific), а также платиново-хромовые стенты (Promus Element, Boston Scientific), покрытые эвероли-мусом, имеют более низкие показатели раннего, позднего и очень позднего тромбоза стента по сравнению с первым поколением стентов с лекарственным покрытием и голометаллическими стентами [22]. Это бросает вызов распространенному мнению о том, что только биодеградируемые полимеры способны свести к минимуму риск тромбоза стента.
Так, в метаанализе T.A. Ahmed и соавт. [ 23 ] проведено сравнение близких (1 мес.) и отдаленных (1 год) результатов имплантации сиролимус-, биолимус А9- и паклитаксел-покрытых стентов на основе биодеградируемого полимера. Частота повторной реваскуляризации в бассейне ранее стентированной артерии (англ. Target Lesion Revascularization, TLR) через 30 дней составила 0,4% у сиролимус-, 0,7% у паклитаксел- и
1,4% у биолимус-покрытых стентов. При сравнении частоты повторной реваскуляризации и возникновения тромбоза стента не выявлено статистически значимой разницы между постоянным и биоразлагаемым полимерами. Данные результаты подтверждают, что биодеградируемый полимер не эффективнее постоянного при оценке возможности тромбоза стента ( рис. 1 ) .
Оба типа стента как с биодеградируемым, так и постоянным полимером требуют приема двойной антиагрегантной терапии для исключения позднего и очень позднего тромбоза. Однако не всегда возможен такой длительный срок двойной антиагрегантной терапии в связи с риском кровотечений, финансовой стороной вопроса, а также приверженностью пациента к терапии [ 24 ]. Выходом из данной ситуации может являться использование стента с лекарственным покрытием на основе полимера, который полностью и быстро (в течение 1 мес.) исчезнет с поверхности стента и не будет увеличивать время сосудистого заживления и эндотелизации. Это позволит уменьшить время необходимого приема двойной антиагрегантной терапии и снизит риск позднего тромбоза стента [ 25 ].
С этой целью разработана концепция стентов третьего поколения. Такой стент представляет собой металлический каркас, который покрыт биодеградируемым полимером с лекарственным покрытием только со стороны, прилежащей к сосудистой стенке, при этом со стороны просвета сосуда лекарственный полимер отсутствует. Таким образом, данное поколение сочетает в себе преимущества стентов с лекарст- венным покрытием в плане рестеноза и голометаллических стентов в отношении позднего коронарного тромбоза.
В исследованиях EVOLVE и EVOLVE II эта модель стента показала эффективность и безопасность в лечении пациентов [ 26 ], а, согласно метаанализу [ 27 ], риск рестеноза и позднего коронарного тромбоза у данного типа стента ниже, чем у большинства стентов с лекарственным покрытием второго поколения. Такой тип стента наиболее близок к «идеальному» с наименьшим риском рестеноза и позднего коронарного тромбоза и возможностью более ранней отмены двойной антиагрегантной терапии. Однако последнее утверждение требует продолжения исследований.
Дальнейшим развитием концепции уменьшения времени контакта сосудистой стенки и полимера стало создание стента, в котором полимер отсутствует вовсе, а антипролиферативный лекарственный агент нанесен непосредственно на стент либо содержится в полости страт стента и высвобождается через микропоры на поверхности, контактирующей с сосудистой стенкой. Существует несколько исследований, целью которых было сравнить эффективность и безопасность беспо-лимерных стентов со стентами с постоянным полимерным покрытием.
Так, в исследовании ISAR-TEST ангиографическая и клиническая эффективность бесполимерного стента с лекарственным покрытием с сиролимусом (англ. Polymer-Free Sirolimus-Eluting Stent, PF-SES) была не ниже в сравнении со стентом с перманентным полимером и паклитакселом (англ. Polymer-Based Paclitaxel-Eluting Stent, PB-PES) по результатам 9-месячного [ 3 ], а также 5-летнего наблюдения [ 4 ]. Однако данные 2-летнего наблюдения, полученные из исследований ISAR-TEST 2 [ 5 ] и ISAR-TEST 3 [ 6 ], показали стойкое прогрессирующее перерождение сосудов после имплантации стента на основе полимера. Рестеноз при использовании бесполимерных платформ не прогрессировал от 6 мес. до 2 лет. Такие противоречивые данные ставят под сомнение эффективность бес-полимерных платформ. Кроме того, эффективность бесполимерного сиролимус-выделяющего стента с лекарственным покрытием у пациентов с сахарным диабетом уступает таковой у стента с перманентным полимером и паклитакселом по данным ангиографии [ 7 ]. Однако недавнее исследование показало, что риск рестеноза при этих двух типах стента не отличается [ 8 ], в том числе у пациентов с сахарным диабетом.
Биорезорбируемые сосудистые каркасы
Наличие металлических страт стента зачастую усложняет повторные диагностику и лечение. Установка стентов с металлической основой исключает возможность хирургического вмешательства на сосудах коронарного русла, металлические страты стента перекрывают боковые ветви, а также теряется информативность и возможность компьютерной и магнитно-резонансной томографии [ 28–32 ] . Идея того, что независимо от типа установленного стента в области имплантации возникает иммунный ответ, а в месте имплантации возможна неадекватная эндо-телизация, легла в основу создания стента, который через некоторое время полностью резорбируется, не оставив металлических структур. Такими стентами стали биоабсорбируемые сосудистые каркасы (англ. Bioabsorbable Vascular Scaffold, BVS), которые обладают уникальной способностью к физиологической и анатомической интеграции в случаях анатомической извитости благодаря временному нахождению в сосуде до окончания эндотелизации и ремоделирования.
Однако результаты исследования PROGRESS AMS продемонстрировали высокую частоту повторных реваскуляризаций (45%) через 1 год и уменьшение просвета сосуда (1,08 ± 0,49 мм) после 4 мес. Внутрисосудистое ультразвуковое исследование показало полную резорбцию биоабсорбируемого сосудистого каркаса, а также негативное ремоделирование и увеличение размеров атеросклеротической бляшки по краям имплантируемого каркаса.
Негативное ремоделирование объяснялось ранней резорбцией биоабсорбируемого сосудистого каркаса и вследствие этого потерей радиальной устойчивости. Все это послужило поводом к модификации каркаса. Следующим вариантом стал биоабсор-бируемый сосудистый каркас DREAMS (BVS DREAMS). В конструкции использованы другие соединения магния и нанесение лекарственного антипролифера-тивного агента. Результаты использования данного биоабсорбируемого сосудистого каркаса опубликованы в исследовании BIOSOLVE-1 и показали меньшие частоту повторных реваскуляризаций (4,3%) и степень просвета сосуда (0,64 ± 0,50 мм) после 6 мес. [ 33 ]. В биоабсорбируемом сосудистом каркасе DREAMS 2 вместо паклитаксела используется сиролимус [ 34 ]. Исследование еще не окончено, но предварительные данные обнадеживают.
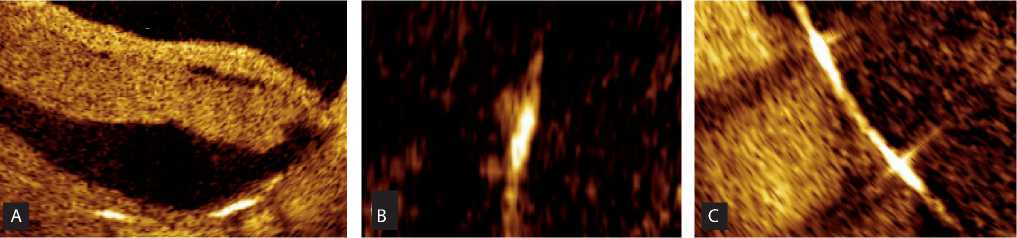
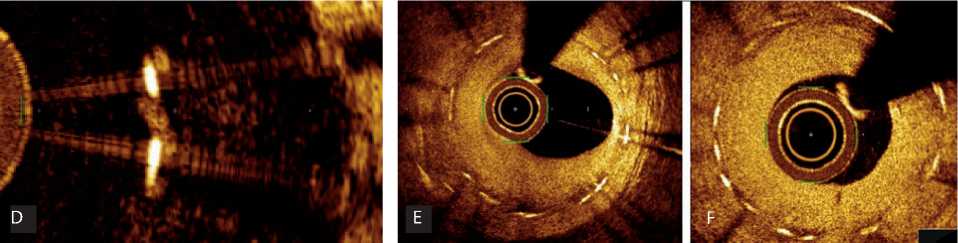
Рис. 2. Оценка показателя заживления сосуда под данным оптической когерентной томографии: внутрипросветные массы, 4 пункта ( A ); непокрытые мальпозированные страты, 3 пункта ( B ); непокрытые страты, 2 пункта ( C ); мальпозированные покрытые страты, 1 пункт ( D ); гиперплазия неоинтимы, 1 пункт ( E )
Помимо DREAM наиболее часто используемым био-абсорбируемым сосудистым каркасом в клинической практике является ABSORB. Недавние метаанализы четырех рандомизированных исследований (ABSORB 2, 3, Япония, Китай) [ 9–11 , 35 ] , сравнивающие эверолимус-со-держащие полилактидные биоабсорбируемые каркасы и кобальт-хромовые покрытые эверолимусом металлические стенты, продемонстрировали не меньшую эффективность биоабсорбируемых каркасов по сравнению с кобальт-хромовыми стентами в течение первого года [ 11 ]. Стоит отметить, согласно данным наших исследований, срок биодеградации сосудистого каркаса в организме человека крайне индивидуален и во многом зависит от особенностей биохимического каскада конкретного пациента. В частности, при повторной коронарографии сосуда, выполненной через 21–28 мес. после имплантации каркаса, отмечаются лишь начальные стадии биодеградации [ 36 ]. Таким образом, данные об использовании биоабсорбируемого сосудистого каркаса крайне ограниченны, и изучение продолжается, а, согласно последним Европейским рекомендациям по реваскуляризации миокарда, рутинная имплантация биоабсорбируемо-го сосудистого каркаса не рекомендована и возможна только в целях клинических исследований [ 37 ].
Оптическая когерентная томографияи заживление сосуда
На данный момент существует большой выбор различных типов стентов для реваскуляризации миокарда. Но можем ли мы быть уверены, что спустя определенный период времени эндотелизация стента завершится?
Ответ на этот вопрос дает оптическая когерентная томография (ОКТ). ОКТ — метод исследования тканей организма с использованием инфракрасного излучения, позволяющий оценить структуру сосудистой стенки. ОКТ обеспечивает высокое разрешение изображения имплантированных устройств и коронарных артерий. При наблюдении OКT проливает свет на процесс заживления сосудов для различных платформ коронарных стентов [ 12–14 ] . Известно, что данные, полученные после секции, демонстрировали связь между непокрытой стратой стента и тромбозом стента [ 15 ]. Следовательно, интенсивные клинические исследования были сфокусированы на потенциальной взаимосвязи результатов ОКТ (непокрытая стойка и неправильная позиция стента) и клинических исходов [ 38 ].
Чтобы систематически оценивать состояние сосудов, в клинических исследованиях введен показатель заживления сосуда (англ. Healing Score, HS) [39, 40]. Преимущество показателя заживления сосуда заключается в том, что он позволяет узнать относительную оценку скорости и степени сосудистого «заживления» у пациентов, получающих различные типы стентов в разное время.
Показатель заживления сосуда состоит из пяти параметров:
-
а) процент внутрипросветного дефекта (% ILD);
-
б) процент мальаппозированных и непокрытых страт (% MU);
-
в) процент непокрытых страт отдельно (% U);
-
г) процентное мальаппозированных страт отдельно (% M);
-
д) неоинтимальная объемная непроходимость более 30% (% NVO).
Параметры суммируются в соответствии со следующей формулой:
HS = [% ILD × 4] + [% MU × 3] + [% U × 2] + [% M] + [% NVO – 30%]. Если % NVO меньше 30, значение данного параметра равно 0 [ 38 ].
Проценты каждого показателя считаются от общего количества страт стента ( рис. 2 ) .
Таким образом, ОКТ и показатель заживления сосуда помогут определить дату, когда прием двойной антиагрегантной терапии можно прекратить. По данным нескольких исследований, сокращение двойной антиагрегантной терапии до 3 [16] или 6 мес. [17–20] после имплантации стента с полимерным покрытием для пациентов с низким и умеренным риском является безопасным. Недавно продемонстрировано, что продолжительность двойной антиагрегантной терапии может быть даже сокращена до одного месяца после имплантации стента без использования полимера. В исследовании LEADERS FREE [41] умиролимус-покрытый стент без постоянного полимера сравнивали с голометаллическим стентом у пациентов с высоким риском кровотечений после чрескожного коронарного вмешательства. Результаты показали, что покрытый умироли-мусом стент, не содержащий полимер, превосходил голометаллический стент при сравнении риска инфаркта миокарда или тромбоза стента на фоне одномесячного курса двойной антиагрегантной терапии. Частота тромбоза стента существенно не различалась между двумя группами, и более половины тромбозов стента в обеих группах наблюдалось в течение первых 30 дней, когда пациентам назначали антиагреганты. Следовательно, инвазивная визуализация не является прагматическим требованием для определения того, следует ли продолжать двойную терапию после 3 или 6 мес. при использовании бесполимерного стента с лекарственным покрытием [38]. Тем не менее рассмотрение сокращения продолжительности двойной антиагрегантной терапии должно быть применено в конкретных платформах и в отношении аналогичных характеристик поражения к тем, которые оцениваются в клинических испытаниях.
Заключение
Внедрение в клиническую практику современных эндоваскулярных методов лечения коронарных артерий позволило сделать реваскуляризацию миокар-
Сравнительная оценка современных стентов
|
Исследование |
Журнал, год публикации |
Количество больных |
Тип стентов |
Повторная реваскуляризация |
p |
|
RAVEL |
JACC, 2007 |
238 |
Стент с лекарственным покрытием (сироли-мус) против голометаллического стента Стенты с биодеградируемым полимером с ле- |
10,3% против 26% |
<0,001 |
|
8,4% против 10,4 против 13,4% |
|||||
|
ISAR-TEST 3 |
Heart, 2009 |
605 |
карственным покрытием (сиролимус) против постоянного полимера против без полимера |
0,19 |
|
|
Circulation: |
Стенты с биодеградируемым полиме- |
||||
|
EVOLVE II |
Interventions, |
1 684 |
ром с лекарственным покрытием (эверо- |
6,7% против 6,5% |
0,83 |
|
2015 |
лимус) против постоянного полимера |
||||
|
BIOSCIENCE |
Lancet, 2014 |
2 119 |
Стенты с лекарственным покрытием: сиролимус против эверолимус |
6,5% против 6,6% |
0,14 |
|
ABSORB II |
Lancet, 2016 |
501 |
Биоабсорбируемый сосудистый каркас против стента с лекарственным покрытием (эверолимус) |
10% против 5% |
0,0425 |
|
ABSORB III |
JACC, 2017 |
2 262 |
Биоабсорбируемый сосудистый каркас против |
13,4% про- |
0,06 |
|
стента с лекарственным покрытием (эверолимус) |
тив 10,4% |
да доступной, что резко уменьшило смертность от сердечно-сосудистых заболеваний, однако привело к новым проблемам и вызовам. Рестенозы и поздние коронарные тромбозы имплантированных стентов относятся к главным отдаленным осложнениям стентирования. Несмотря на успех в разработке новых более безопасных платформ стентов, не до конца очевидны причины данных осложнений, что требует дальнейших научных исследований.
Список литературы История развития и сравнительная оценка современных стентов для коронарных артерий
- Dotter CT. Transluminally-placed coilspring endarterial tube grafts. Long-term patency in canine popliteal artery. Invest Radiol. 1969;4:329-32. PMID: 5346893.
- Hanawa T. Materials formetallic stents. J Artif Organs. 2009;12:73-9. PMID: 19536623. DOI: 10.1007/s10047-008-0456-x
- Mehilli J., Kastrati A., Wessely R., Dibra A., Hausleiter J., Jaschke B., Dirschinger J., Schomig A., Intracoronary Stenting and Angiographic Restenosis-Test Equivalence Between 2 Drug-Eluting Stents (ISAR-TEST) Trial Investigators. Randomized trial of a nonpolymer-based rapamycin-eluting stent versus a polymer-based paclitaxel-eluting stent for the reduction of late lumen loss. Circulation. 2006;113:273-9. PMID: 16391155. 10.1161/ CirculationAHA.105.575977 DOI: 10.1161/CIRCULATIONAHA.105.575977
- King L., Byrne R.A., Mehilli J., Schomig A., Kastrati A., Pache J. Five-year clinical outcomes of a polymer-free sirolimus-eluting stent versus a permanent polymer paclitaxel-eluting stent: final results of the intracoronary stenting and angiographic restenosis-test equivalence between two drug-eluting stents (ISAR-TEST) trial. Catheter Cardiovasc Interv. 2013;81(1):E23-8. PMID: 22431239. http:// DOI: 10.1002/ccd.24375
- Byrne R.A., Kastrati A., Tiroch K., Schulz S., Pache J., Pinieck S., Massberg S., Seyfarth M., Laugwitz K.L., Birkmeier K.A., Schomig A., Mehilli J.; ISAR-TEST-2 Investigators. 2-year clinical and angiographic outcomes from a randomized trial of polymer-free dual drug-eluting stents versus polymer-based cypher and endeavor [corrected] drug-eluting stents. J Am Coll Cardiol. 2010;55:2536-43. PMID: 20417052. DOI: 10.1016/uacc.2010.03.020


