Избирательное вовлечение рецепторов серотонина в механизмы синаптического облегчения у нейронов сенситизируемой улитки
Автор: Никитин В.П.
Журнал: Академический журнал Западной Сибири @ajws
Рубрика: Медицина
Статья в выпуске: 2 (73) т.14, 2018 года.
Бесплатный доступ
В ранее выполненных нами исследованиях обнаружено, что выработка ноцицептивной сенситизации у виноградных улиток или аппликации серотонина на ЦНС сопровождалась долговременным облегчением ответов интернейронов оборонительного поведения ЛПл1 и ППл1 на сенсорные раздражения, которое зависело от процессов трансляции и транскрипции. В настоящей работе изучена возможность избирательного вовлечения 5-HT1A субтипов рецепторов серотонина в механизмы индукции синаптического облегчения. Обнаружено, что выработка сенситизации во время подведения к нейронам антагониста этих рецепторов NAN-190 (1-(2-methoxiphenil)-4-[4-(2phthalimido)butyl]piperasine hydrobromide) вызывала подавление синаптического облегчения в ответах нейрона ЛПл1 на тактильные раздражения головы улитки. При этом синаптическое облегчение в ответах на химические раздражения головы и тактильные раздражения ноги развивалось так же, как у нейронов контрольных сенситизированных животных. Предположено, что у сенситизированных виноградных улиток б-HT1A-подобные рецепторы избирательно вовлечены в механизмы индукции пластичности синаптических "входов" интернейронов оборонительного поведения, опосредующих возбуждения от механорецепторов головы.
Сенситизация, рецепторы серотонина, сенсорные раздражения, идентифицированные нейроны, виноградная улитка
Короткий адрес: https://sciup.org/140225947
IDR: 140225947
Текст научной статьи Избирательное вовлечение рецепторов серотонина в механизмы синаптического облегчения у нейронов сенситизируемой улитки
В исследованиях, выполненных как на нервных клетках моллюсков, так и на нейронах млекопитающих показано, что серотонин вовлечен в пластические перестройки клеток, лежащие в основе механизмов обучения [1, 2, 10, 11]. Так, например, обнаружено, что у морского моллюска аплизии выработка простой формы не ассоциативного обучения – ноцицептивной сенситизации оборонительного рефлекса - приводит к изменению эффективности синаптических связей между нейронами [5, 9]. Ключевым механизмом данного процесса является так называемое гетеросинаптическое облегчение -серотонин-индуцированная функционально - морфологическая модуляция синаптических связей.
Исследование молекулярных механизмов долговременной синаптической пластичности в нейронах аплизии показало, что в ее индукцию серотони- ном вовлечены ряд протеинкиназ, в том числе цАМФ-зависимая протеинкиназа А, протеинкиназа С и митогенактивируемая протеинкиназа (MAPK) [5, 9]. Протеинкиназы регулируют активность ряда транскрипционных факторов, которые активируют экспрессию немедленных «ранних» и «поздних» генов. Синтезируемые мРНК транспортируются в нейриты и индуцируют долговременное облегчение синаптической связи, на которую многократно апп-лицировали серотонин. Важно отметить, что выявленные эффекты серотонина были синапс - специфичными, что достигалось за счет индукции вторичными посредниками механизмов маркирования и кооптирования в стимулируемых серотонином синапсах транскрипционных продуктов и локального синтеза белков [5, 9].
В опытах на виноградных улитках, обнаружено, что серотонин имитирует эффекты ноцицептивной сенситизации на уровне интернейронов оборонительного поведения животных [2, 7]. В частности, ранее нами выявлено, что инъекции серотонина к нейронам ЛПл1 и ППл1 несенситизированных улиток вызывали избирательное облегчение синаптических связей в ответах на раздражения головы тактильными стимулами или аппликациями слабого раствора хинина [3]. Серотонин не вызывал изменения ответов нейронов на тактильные раздражения ноги улитки. В последующих опытах, используя модель выработки ноцицептивной сенситизации, мы обнаружили, что химические и тактильные сенсорные входы нейронов ЛПл1 и ППл1 регулируются разными системами вторичных посредников, разными транскрипционными факторами и генами [3]. Эти факты позволяют нам предположить, что синапс-специфические эффекты серотонина реализуются за счет активации разных типов серотониновых рецепторов, связанных с разными системами вторичных посредников.
В настоящей работе исследовано влияние антагониста 5-HT1A рецептора NAN-190 на ответы интернейронов оборонительного поведения виноградной улитки, вызванные различными сенсорными раздражениями при выработке сенситизации.
Методика.
Опыты проводили на интернейроне оборонительного поведения ЛПл1 полуинтактного препарата виноградных улиток Helix lucorum [2]. Перед операцией животное анестезировали охлаждением в смеси воды со льдом в течение 30-40 мин и введением в полость тела непосредственно перед операцией 100-150 мг MgCl2, разведенного в 2 мл физиологического раствора. У улиток удаляли раковину и рассекали по средней линии переднюю часть ноги, за исключением ее головного конца. Затем улитку помещали в ванночку, заполненную парафином, и фиксировали вокруг окологлоточного комплекса ганглиев (ЦНС) силиконовое кольцо объемом 200 мкл, в которое постоянно поступал физиологический рас- твор со скоростью 500 мкл/мин. Отведение биоэлектрической активности нейронов осуществляли стандартными электрофизиологическими методами с помощью стеклянных микроэлектродов, заполненных смесью 2 М раствора цитрата калия и 2М KCl в соотношении 1:1. Электроды имели диаметр кончика менее 1 мкм и сопротивление около 30 МОм.
Сенситизацию вырабатывали трехкратным с интервалом 15 мин нанесением 100 мкл концентрированного (10%-ного) раствора хинина гидрохлорида на кожу передней части головы. Через 2 мин после каждого сенситизирующего стимула голову улитки отмывали физиологическим раствором.
Для тестирования реакций нейронов на сенсорные раздражители применяли слабый раствор хинина (0,25%) и тактильные стимулы. Хинин в объеме 600 мкл апплицировали в течение 30 с на переднюю часть головы улитки. Через 2 мин после окончания аппликации голову животного отмывали физиологическим раствором. Тактильные раздражения наносили на голову или на среднюю часть ноги с помощью электромеханического устройства (давление 1500 г/см2) [3]. В ответах, вызванных сенсорными раздражениями, оценивали площадь (в мВ·с) характерных для интернейронов улитки медленных ВПСП (возбуждающих постсинаптических потенциалов, мВПСП). Измерение площади производили с помощью прибора Digitizer KD 4030B (фирма Graphtec, Япония) и специальной компьютерной программы. В каждом эксперименте в течение 1,5 ч перед подведением веществ, а также через 2-3 ч после начала выработки сенситизации животным наносили тестирующие сенсорные раздражения с интервалом 15-20 мин. Последовательность нанесения стимулов – химического раздражения головы, тактильного раздражения ноги и тактильного раздражения головы - меняли в каждом опыте. В работах, выполненных нами ранее [3] показано, что стабильность синаптических ответов у нейронов сохраняется на протяжении 5-6 ч эксперимента. В каждом опыте данные, полученные на 120-150=й минуте после нанесения первого сенситизирующего раздражения, выражали в процентах по отношению к исходным значениям. Ранее нами было обнаружено, что на 120-150=й минуте после начала выработки сенситизации синаптическое облегчение у нейрона ЛПл1 достигало стабильного уровня, поддерживаемого более 24 ч [3]. Так как у некоторых нейронов генерация потенциалов действия препятствовала измерению площади мВПСП, ответы на раздражители регистрировали при гиперполяризации мембраны до – 80 мВ.
В качестве антагониста 5-HT1A рецепторов серотонина использовали NAN-190 (1-(2- methoxiphenil)-4-[4-(2phthalimido)butyl]piperasine hydrobromide) («Sigma»). Антагонист предварительно растворяли в этаноле, а затем в физиологическом растворе для моллюсков.
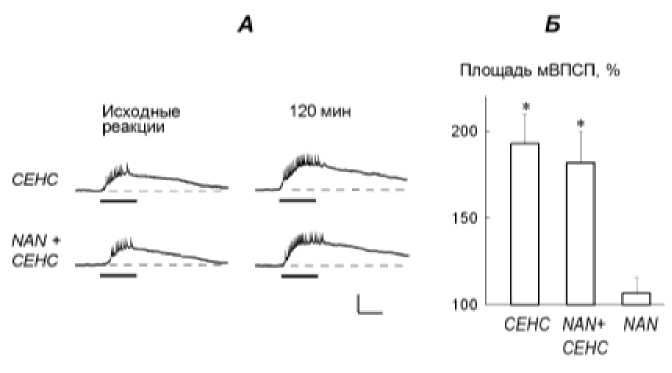
Рис. 1. Антагонист рецепторов серотонина 5-HT1A NAN-190 не влиял на индукцию синаптического облегчения ответов нейронов ЛПл1, вызванных химическими раздражениями головы виноградных улиток, при выработке ноцицептивной сенситизации. А: слева – нейронограмма исходных ответов на химические раздражения головы; справа – ответы нейронов через 120 мин после нанесения первого сенситизирующего стимула (10% раствор хинина). СЕНС - ответы нейрона контрольной сенситизируемой улитки; NAN+СЕНС – ответы нейрона животного, у которого вырабатывали сенситизацию в условиях подведения NAN-190. Утолщенная линия – время подведения слабого раствора хинина (0,25%). Калибровка – 5 мВ, 20 с. Б – Суммарный график ответов нейронов через 120-150 мин после выработки сенситизации. NAN - реакции нейронов у несенситизируемых улиток, к нейронам которых подводили NAN-190. По оси ординат – выраженные в % изменения площади мВПСП в ответах на сенсорные раздражения относительно площадей мВПСП перед выработкой сенситизации (100%). * - p<0,01, по отношению к значениям исходных реакций и ответов нейронов у несенситизируемых улиток, к которым подводили NAN-190.
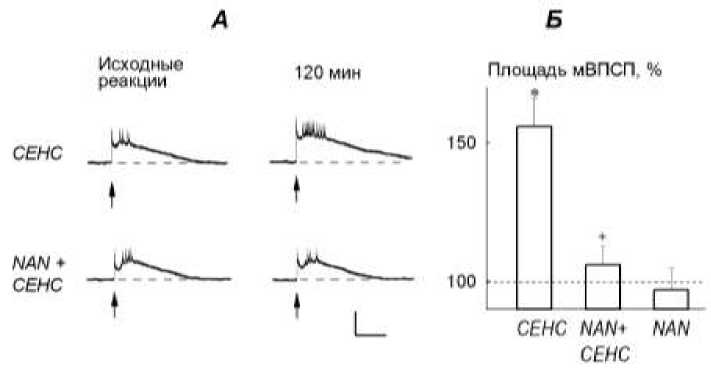
Рис. 2. NAN-190 подавлял индукцию синаптического облегчения ответов нейронов ЛПл1, вызванных тактильными раздражениями головы виноградных улиток, при выработке ноцицептивной сенситизации. * - p<0,01, по отношению к значениям исходных реакций нейронов сенситизируемых улиток, а также ответов нейронов у несенситизируемых улиток, к которым подводили NAN-190. + - p<0,01, по отношению к значениям ответов контрольных сенситизируемых улиток. Остальные обозначения как на рис. 1.
Конечная концентрация антагониста составляла 10-5 моль/л, а содержание этанола в физиологическом растворе – 0,1%. NAN-190 подводили к интернейрону под давлением сжатого воздуха через микропипетку, имевшую диаметр кончика – 20-30 мкм. Сжатый воздух (0,2 кг/см2) подавали к пипетке с помощью прибора "Neuro Phore ВН-2" (Med. Syst. Corp., США). Микроэлектрод, содержавший NAN-190, располагали на расстоянии 30-50 мкм от сомы клетки непосредственно перед началом инъекции веществ, которую начинали за 20 мин до выработки сенситизации. Сразу после выработки сенситизации инъекцию прекращали и электрод, содержавший NAN-190, удаляли из раствора. В качестве контроля использовали нейроны ЛПл1, к которым подводили 0,1% этанол в физиологическом растворе и у улиток вырабатывали сенситизацию или нейроны улиток, к которым подводили NAN-190, но сенситизирую-щих стимулов не наносили. Полученные данные усредняли, вычисляли стандартную ошибку средней. Для оценки уровня достоверности различий использовали t-критерий Стьюдента.
Результаты и обсуждение.
Аппликации 0,25%-ного раствора хинина на голову моллюска вызывали в нейроне ЛПл1 генерацию мВПСП, площадь которого составляла 346±53 мВ·с (количество нейронов, n=35). Площади мВПСП в ответах нейрона на тактильные раздражения, наносимые на голову и среднюю часть ноги, составляли соответственно 183±39 (n=35) и 118±30 мВ·с (n=35).
На 120-150-й минуте после начала выработки сенситизации во время инъекций раствора NAN-190 к нейронам ЛПл1 (n=11) площади мВПСП в ответах на химические раздражения головы были больше, чем их значения перед выработкой сенситиза-ции (рис. I, p<0,01), а также площадей мВПСП у нейронов (n=8) животных, к которым подводили NAN-190, но не вырабатывали сенситизацию (p<0,01). Вместе с тем, они не отличались от значений площадей мВПСП в ответах нейронов (n=12), сенситизируемых улиток, к которым подводили 0,1% раствор этанола (p>0,05).
На 120-150-й минуте после начала выработки сенситизации во время аппликации NAN-190 к нейронам ЛПл1 (n=13) (рис. I) площади мВПСП в ответах на тактильные раздражения головы не отличались от таковых перед выработкой сенситиза-ции (рис. 2; p>0,05) и площадей мВПСП нейронов (n=8), к которым подводили NAN-190 у несенсити-зированных животных (p>0,05). Кроме того, они были меньше площадей мВПСП в ответах нейронов (n=12) сенситизируемых улиток, которым подводили 0,1% раствор этанола (p<0,01).
В ответах на тактильные раздражения середины ноги на 120-150 мин после начала выработки сенситизации во время аппликации NAN-190 площади мВПСП у нейронов ЛПл1 (n=11) увеличились по сравнению с исходными значениями до 168±18% и они не отличались от площадей мВПСП в ответах нейронов (n=12) сенситизируемых улиток в условиях подведения 0,1% раствор этанола (p>0,05) и были больше площадей мВПСП у нейронов (n=8) животных, к которым подводили NAN-190, но не вырабатывали сенситизацию (p<0,01).
Обсуждение результатов.
Проведенные опыты показали, что во время выработки сенситизации подведение к интернейрону оборонительного поведения ЛПл1 антагониста 5-HT1A рецепторов NAN-190 приводило к избирательному подавлению облегчения ответов нейронов на раздражения механорецепторов головы улитки. Вместе с тем антагонист не оказывал влияния на синаптическое облегчение во входах нейрона ЛПл1 от хеморецепторов головы и механорецепторов ноги.
Ранее нами обнаружено [3], что в процессах индукции долговременного облегчения в сенсорных входах нейронов ЛПл1 и ППл1 от хеморецепторов головы участвуют цАМФ и зависимые от него транскрипционные факторы немедленного раннего гена С/ЕВР (CAAT/enhancer binding protein), тогда как в механизмы регуляции сенсорного входа от механорецепторов головы вовлечена протеинкиназа С и зависимый от нее транскрипционный фактор SRF (serum response factor). Исходя из этих результатов, можно предположить, что 5-HT1A-подобные рецепторы избирательно вовлечены в механизмы регуляции синаптических входов нейрона ЛПл1 от механорецепторов головы виноградной улитки за счет регуляции ими каскада молекулярных событий, включающих протеинкиназу С и SRF. Кроме того выявлено, что введение в нейрон ЛПл1 антисмысловых олигонуклеотидов к мРНК другого раннего гена zif268 (egr-1) при выработке сенсити-зации у улитки приводило к избирательному подавлению облегчения ответов в сенсорных входах как от хемо-, так и механорецепторов головы, но не механорецепторов ноги [3]. Промотер гена zif268 содержит последовательность SRE и CRE и, следовательно, его активность может регулироваться транскрипционными факторами SRF и CREB. Альтернативный вариант механизма регуляции транскрипции гена zif268 включает МАРК-семейство киназ (mitogen activated proteinkinase) [8]. В свою очередь активность МАРК может регулироваться как про-теинкиназой С и протеинкиназой А, так и независимыми от них механизмами, например, тирозинкиназными рецепторами, рецепторами глутамата, ионами кальция и др. Возможно также, что сигнальные пути от сенсорных рецепторов могут опосредоваться в нейроне ЛПл1 через другие системы вторичных посредников.
Эффекты сенситизации не ограничиваются участием в механизмах синаптической пластичности различных субтипов рецепторов серотонина и указанными системами вторичных посредников [5]. В механизмы сенситизации могут вовлекаться такие биологически активные вещества, как глутамат, ацетилхолин, опиаты, нейропептид FMRFamide, гастрин, холецистокинин и др. [2].
Полученные результаты свидетельствуют, что при выработке сенситизации 5-HT1A –подобные рецепторы избирательно вовлечены в механизмы индукции синаптического облегчения входов нейрона ЛПл1 от механорецепторов головы. Вопрос об идентификации субтипов рецепторов серотонина, вовлеченных в индукцию синаптического облечения от хеморецепторов головы, остается открытым. Как отмечено выше, синаптическое облегчение в этих входах связано с активацией аденилатциклазы. В исследованиях на нервной системе моллюска ап-лизии обнаружено, что NAN-190 незначительно влияет на активность аденилатциклазы [6]. Вместе с тем, в работе на моллюске Anodonta показано, что аденилатциклаза может активироваться через 5-НТ2А рецепторы [4]. Таким образом, одним из возможных субтипов рецепторов серотонина, опосредующих индукцию облегчения в синаптических входах нейрона ЛПл1 от хеморецепторов головы могут быть 5-НТ2А-подобные рецепторы.
Представленные результаты свидетельствуют о существовании в нейронах механизма специфической синаптической пластичности, основанного на специфичности участвующих в нем молекулярных процессов – сенситизирующие возбуждения, конвергирующие к определенным постсинаптическим рецепторам, опосредуются различными вторичными посредниками, которые активируют разные транскрипционные факторы и гены, что приводит к синтезу синапс-специфических РНК и белков избирательно регулирующих определенные синаптические связи нейронов.
Список литературы Избирательное вовлечение рецепторов серотонина в механизмы синаптического облегчения у нейронов сенситизируемой улитки
- Абрамова М.С., Нистратова В.Л., Москвитин А.А., Пивоваров А.С. Метиотепин чувствительные серотониновые рецепторы вовлечены в постсинаптический механизм сенситизации оборонительной реакции виноградной улитки//Журн. высш. нерв. деят. 2005. Т. 55, № 3. С. 385-392.
- Балабан П.М., Захаров И.С. Обучение и развитие: общая основа двух явлений. М.: Наука, 1992. 152 с.
- Никитин В.П. Новый механизм синапс-специфической нейрональной пластичности//Российский физиол. журн. им. И.М. Сеченова. 2006. Т. 92, № 4. С. 402-419.
- Шпаков А.О., Шипилов В.Н., Кузнецова Л.А., Бондарева В.М., Плеснева С.А., Перцева М.Н. Реактивность аденилатциклазной сигнальной системы нервных ганглиев моллюска Anodonta cygnea к серотонину и адренергическим агонистам//Нейрохимия. 2004. Т. 21, № 3. С. 190-197.
- Byrne J.H., Hawkins R.D. Nonassociative learning in invertebrates//Cold. Spring. Harb. Perspect. Biol. 2015. V. 7, № 5. pii: a021675.
- Cohen J.E., Onyike C.U., McElroy V.L., Lin A.H., Abrams T.W. Pharmacological characterization of an adenylyl cyclase-coupled 5-HT receptor in aplysia: comparison with mammalian 5-HT receptors//J. Neurophysiol. 2003. V. 89, № 3. P. 1440-1455.
- Golovchenko A.N., Bogodvid T.K., Muranova L.N., Gainutdinov K.L., Andrianov V.V. Serotonin modulation of premotor interneuron excitability in the snail during associative learning//BioNanoScience. 2016. V. 6, № 4. P. 450-452.
- Kharchenko O.A., Grinkevich V.V., Vorobiova O.V., Grinkevich L.N. Learning-induced lateralized activation of the MAPK/ERK cascade in identified neurons of the food-aversion network in the mollusk Helix lucorum//Neurobiol. Learn. Mem. 2010. V. 94, № 2. P. 158-166.
- Kandel E.R., Dudai Y., Mayford M.R. The molecular and systems biology of memory//Cell. 2014. V. 157, № 1. P. 163-816.
- Ogren S.O., Eriksson T.M., Elvander-Tottie E., D'Addario C., Ekström J.C., Svenningsson P., Stiedl O. The role of 5-HT(1A) receptors in learning and memory//Brain Res. 2008. V. 195. P. 54-77.
- Seyedabadi M., Fakhfouri. G., Ramezani V., Mehr S.E., Rahimian R. The role of serotonin in memory: interactions with neurotransmitters and downstream signaling//Exp. Brain Res. 2014. V. 232. P. 723-738.


