Изменчивость морфологических и биохимических признаков кресс-салата (Lepidium sativum L.) из коллекции ВИР в условиях интенсивной светокультуры
Автор: Курина А.Б., Железнова К.О., Соловьева А.Е., Синявина Н.Г., Панова Г.Г., Артемьева А.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Продуктивность, качество и технологии
Статья в выпуске: 5 т.58, 2023 года.
Бесплатный доступ
Производство свежей овощной продукции высокого качества для населения России остается важной задачей. Получать урожай в течение всего года позволяет технология интенсивной светокультуры (сити-фермы, вертикальные фермы, фабрики растений). Очевидно, что для такого выращивания требуются сорта и линии, максимально реализующие продукционный потенциал в этих специфических условиях. В последние годы проводятся исследования, направленные на поиск и подбор образцов различных культур для светокультуры, цель которых - повышение эффективности и рентабельности производства, а также расширение ассортимента растительной продукции. Кресс-салат Lepidium sativum L. как скороспелая культура с большим разнообразием форм, различающихся по хозяйственно ценным признакам, прежде всего по урожайности и биохимическому составу, представляет значительный интерес для адаптации к подобным технологиям. Однако, влияние условий выращивания, характерных для светокультуры, на проявление признаков продуктивности и качества у образцов кресс-салата, различающихся по эколого-географическому происхождению и ботанической принадлежности, практически не изучено. В настоящей работе мы впервые провели комплексную оценку изменчивости хозяйственно ценных признаков кресс-салата в условиях интенсивной светокультуры. Целью нашей работы было фенологическое, морфологическое, биохимическое изучение 72 образцов L. sativum трех разновидностей - кресс-салата цельнолистного (var. latifolium ), посевого (var. sativum ) и кудрявого (var. crispum ) из мировой коллекции ВИР в условиях интенсивной светокультуры и выявление источников ценных признаков. Морфометрическое описание (высота и диаметр розетки, форма и размеры листа), определение весовых (масса) показателей роста растений, товарной продуктивности, содержания сухого вещества, аскорбиновой кислоты, пигментного комплекса (хлорофиллов, каротиноидов и антоцианов) (биохимический анализ) проводили в фазу технической спелости в 3-кратной повторности. В изученной выборке наибольшую изменчивость выявили по содержанию антоцианов ( Cv = 42,5 %), средней массе растения ( Cv = 40,3 %), урожайности товарной части продукции ( Cv = 38,3 %). Остальные признаки характеризовались средней степенью изменчивости. Отмечены особенности позднеспелых образцов: позднее стеблевание, бóльшая масса растения (в среднем 3,6 г) и высокое содержание сухого вещества (в среднем 9,0 %), тогда как скороспелые и ультраскороспелые формы накапливают большее количество аскорбиновой кислоты (в среднем 32,8±5,7 мг/100 г) и позволяют получать большее число урожаев за год. В среднем наиболее урожайными оказались позднеспелые образцы var. latifolium из Ирана (к-91) и Азербайджана (к-112, к-125, к-131), образец var. sativum из Ирана (к-92) и образец var. crispum из Дании (к-185). Выявлены статистически значимые различия между ботаническими разновидностями по содержанию пигментов. Образцы var. latifolium в целом характеризовались бóльшим содержанием суммы хлорофиллов (124,2±14,0 мг/100 г), каротиноидов (37,3±4,4 мг/100 г), каротинов (6,1±0,6 мг/100 г) и β-каротина (5,0±0,6 мг/100 г). Изменчивость по содержанию каротинов была наибольшая в группе образцов var. sativum ( Cv = 24,7 %), по содержанию антоцианов - в группе var. crispum ( Cv = 44,7 %). В результате исследований нами выявлены образцы кресс-салата, которые выделяются по скорости развития, устойчивости к стеблеванию и по формируемой урожайности при выращивании в условиях интенсивной светокультуры, а также потенциальные источники хозяйственно ценных признаков для дальнейшей селекции форм кресс-салата, наиболее адаптированным к этой технологии.
Кресс-салат, интенсивная светокультура, урожайность, аскорбиновая кислота, хлорофиллы, каротиноиды, изменчивость
Короткий адрес: https://sciup.org/142239858
IDR: 142239858 | УДК: 635.563:581.1:631.588.5 | DOI: 10.15389/agrobiology.2023.5.889rus
Текст научной статьи Изменчивость морфологических и биохимических признаков кресс-салата (Lepidium sativum L.) из коллекции ВИР в условиях интенсивной светокультуры
Листовые овощные культуры — наиболее доступный источник биологически активных веществ, в том числе витаминов и антиоксидантов, необходимых для сохранения здоровья человека. Однако в Российской Федерации обеспеченность населения такой продукцией составляет всего 30-34 % от рекомендованной нормы (20,4 кг в год на человека) (1, 2). Эти растения
∗ Исследования выполнены в рамках ГЗ ВИР: номер темы FGEM-2022-0003 «Мировые ресурсы овощных и бахчевых культур коллекции ВИР: эффективные пути раскрытия эколого-генетических закономерностей формирования разнообразия и использования селекционного потенциала».
благодаря короткому периоду вегетации и компактному габитусу, позволяющему размещать их на многоярусных светоустановках, представляются одними из самых перспективных для выращивания в контролируемых условиях интенсивной светокультуры — в фитотехкомплексах (3, 4), на сити-фермах (5), вертикальных фермах (6-8).
В интенсивной светокультуре в световой, корнеобитаемой и воздушной средах можно создать и поддерживать оптимальные условия для роста, развития растений и реализации их максимальной продуктивности (9, 10). В Агрофизическом НИИ (АФИ, г. Санкт-Петербург) предложена методология многомерной оптимизации параметров интенсивной светокультуры для выращивания образцов из коллекций генетических ресурсов. Кроме того, в АФИ создаются высокопродуктивные формы с комплексом хозяйственно ценных признаков, максимально реализуемых в полностью регулируемой интенсивной светокультуре. Разработаны масштабируемые фитотех-комплексы для круглогодичного получения высоких урожаев качественной растительной продукции в непосредственной близости от потребителя (1115). В контролируемых условиях точность идентификации ценных генотипов и скорость получения линий и сортов для сити-ферм и фабрик растений существенно повышается (16-19).
В последнее время во всем мире растет интерес к функциональному питанию (20). Растения семейства Brassicaceae Burnett. служат ценным источником биологически активных веществ — фенольных соединений, растительных пигментов, глюкозинолатов, терпенов, фитоалексинов, алкалоидов (21). При этом многие капустные культуры характеризуются коротким вегетационным периодом, интенсивным ростом и высокой урожайностью при компактных размерах, что позволяет с успехом выращивать их в ярусной светокультуре.
Кресс-салат ( Lepidium sativum L.) — однолетнее травянистое растение семейства Brassicaceae , известное в основном как листовая и пряная культура (22). В пищу используют свежие розеточные листья и молодые побеги, обладающие приятным горчичным вкусом. Точное место происхождения кресс-салата не известно, предполагается, что он произошел из Северо-Восточной Африки (Эфиопия, Эритрея, Египет), где выращивался более 2000 лет назад как масличное растение, и Юго-Западной Азии (Иран) (23). Постепенно культура распространилась в страны Средней и Передней Азии, Закавказья и Средиземноморья, где сформировался вторичный очаг происхождения овощных форм (24, 25).
Род Lepidium L. насчитывает более 175 видов (26). L. sativum — полиморфный вид, и попытки его внутривидовой ботанической классификации предпринимались неоднократно. N. Sabaghnia с соавт. (27) разделяют вид L. sativum на три ботанические разновидности: обыкновенный — var. vulgare Alef., кудрявый — var. crispum (Medik.) DC. и широколистный — var. latifolium DC. в зависимости от морфологии листа, стебля и корня. В России принята классификация, согласно которой вид L. sativum имеет пять основных разновидностей: цельнолистный — var. latifolium DC., посевной — var. sativum Alef., тонкорассеченый — var. nanum Schtschenk., кудрявый — var. crispum (Medik.) DC. и прижатый — var. adpressum Schtschenk. (28). Генетическое разнообразие кресс-салата мало связано с эколого-географическим происхождением — по количественным признакам имеется значительная изменчивость, степень которой не зависит от места происхождения образца (27, 29). Свежие листья кресс-салата богаты витамином С (47-74 мг/100 г сырой массы) (30-32). Также они содержат витамины группы В, PP, A, E, D, K, макро- и микроэлементы P, K, Ca, Mg, Na, Fe, I (24, 33-35), каротин
(36). Некоторые сорта кресс-салата характеризуются повышенным содержанием макроэлементов P, K, Ca, Na и Mg в надземной части по сравнению с образцами салата-латука, шпината, петрушки и капусты (31). Благодаря ценному биохимическому составу кресс-салат — не только листовая овощная культура, широко употребляемая в пищу, но и лекарственное растение (37-39). Кресс-салат используют в медицине для лечения астмы, головной боли, опухолей матки, рака молочной железы (40), желтухи, проблем с печенью, селезенкой и желудочно-кишечных расстройств (41, 42). Показано, что растение обладает жаропонижающими, обезболивающими, коагулянтными (43), гипотензивными (44), мочегонными (45), противоастматическими (46), гипогликемическими, антиоксидантными и противовоспалительными (47) свойствами.
Перспективность интенсивной светокультуры кресс-салата также связана с его скороспелостью, что позволяет получать регулярные урожаи — по данным оригинальных исследований в Агрофизическом институте (г. Санкт-Петербург), до 24 вегетаций в год (персональные сообщения). Селекция кресс-салата ориентирована на создание высокоурожайных сортов с крупными, дважды перисто-рассеченными кудрявыми листьями с высоким содержанием биологически активных веществ (БАВ) и хорошими вкусовыми качествами.
В настоящее время мировая коллекция Российской Федерации, хранящаяся в ВИР (Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова, г. Санкт-Петербург) включает 323 образца кресс-салата. Географическое разнообразие коллекции охватывает Европу, Азию, Кавказ и Закавказье, Африку, Австралию и Северную Америку — всего 46 стран. В коллекции представлены все ботанические разновидности кресс-салата.
В последние годы проводятся исследования по поиску и подбору образцов различных сельскохозяйственных растений для светокультуры, цель которых — повышение эффективности и рентабельности производства, а также расширение ассортимента растительной продукции. Кресс-салат Lepidium sativum L. как скороспелая культура с большим разнообразием форм, различающихся по хозяйственно ценным признакам, прежде всего по урожайности и биохимическому составу, представляет значительный интерес для адаптации к подобным технологиям. Однако влияние условий выращивания, характерных для светокультуры, на проявление признаков продуктивности и качества у образцов кресс-салата, различающихся по эколого-географическому происхождению и ботанической принадлежности, практически не изучено.
В настоящей работе мы провели комплексную оценку хозяйственно ценных признаков кресс-салата из мировой коллекции ВИР и впервые определили биохимический состав и пределы изменчивости пигментного состава у растений кресс-салата в интенсивной светокультуре.
Цель настоящего исследования — оценить изменчивость фенотипических признаков в репрезентативной выборке образцов кресс-салата, включая морфометрические характеристики, урожайность и биохимический состав, в условиях интенсивной светокультуры и выделить перспективные формы для использования в овощеводстве и селекции.
Методика . Выборка включала 72 образца, которые различаются по эколого-географическому происхождению и ботанической принадлежности (получены из коллекции ВИР), в том числе 27 образцов цельнолистного (var. latifolium ), 35 образцов посевного (рассеченнолистного) (var. sativum ) и 10 образцов кудрявого (var. crispum ) кресс-салата.
Исследования проводили в оригинальной вегетационной светоуста-новке АФИ (48), оборудованной лампами ДНаЗ-400 (ООО «Рефлакс», Россия). Облученность в области ФАР — 75-80 Вт/м2, продолжительность светового периода — 12 ч, температура день/ночь — 22±2/20±2 °С. В качестве корнеобитаемой среды использовали торфяной питательный субстрат Агро-балт-С (ООО «Пиндструп», Россия), толщина слоя 3 см. Полив осуществляли водой, подкормку — 0,5 н. раствором Кнопа 3 раза в неделю. Влажность почвы поддерживали на уровне 60-70 % ПВ, воздуха — 60-65 %. Повторность опыта 3-кратная, по 15 учетных растений в образце, схема посева 5½5 см.
Фенологические наблюдения (учет дат появления единичных и массовых всходов и начала стеблевания) и морфологическое описание образцов кресс-салата проводили по методике ВИР (49). У растений измеряли высоту и диаметр розетки, длину и ширину листа, длину черешка, определяли массу одного растения, число листьев (количественные признаки) и тип листа (качественные признаки) у образцов кресс-салата, рассчитывали урожайность. Описание растений и биохимический анализ проводили в стадии технической спелости (на 15-е, 17-е и 22-е сут от появления всходов).
Подготовку и биохимический анализ образцов проводили по методике А.И. Ермакова (50): содержание сухого вещества определяли гравиметрически, аскорбиновой кислоты — прямым извлечением из растений 1 % соляной кислотой с последующим титрованием с помощью 2,6-дихлорин-дофинола (реактив Тильманса). Каротиноиды и хлорофиллы экстрагировали 100 % ацетоном, их концентрацию измеряли по поглощению (OD) при X = 645 нм (хлорофилл a), X = 662 нм (хлорофилл b), X = 440 нм (каротиноиды) X = 454 (в-каротин). Антоцианы экстрагировали 1 % соляной кислотой с последующим измерением OD при X = 510 нм с пересчетом на цианидин-3,5-дигликозид (X = 453 нм). Для внесения поправки на содержание зеленых пигментов одновременно определяли оптическую плотность полученных экстрактов при X = 657 нм. Все измерения OD проводили на спектрофотометре Ultrospec II («LKB Vertriebs GmbH», Австрия). Все значения приведены в пересчете на сырое вещество.
Статистический анализ данных выполняли с использованием программного обеспечения STATISTICA v.12.0 («StatSoft, Inc.», США). Для всех значений рассчитывали параметры описательной статистики (среднее M , медиана Me , стандартное отклонение SD, диапазон изменчивости minmax). Тестирование данных на нормальность распределения выполняли с помощью критерия Шапиро-Уилка. Средние значения сравнивали с помощью дисперсионного анализа (ANOVA). Для выявления выделившихся образцов использовали НСР 05 и критерий достоверной значимой разницы Тьюки (HSD, honestly significant difference Tukey) (51, 52).
Результаты . Морфологические и фенологические наблюдения, хозяйственная ценность. Изменчивость признаков характеризует норму реакции вида на воздействия факторов среды, его способности к адаптации (53). Оценка фенотипической изменчивости хозяйственно ценных признаков в тех или иных внешних условиях (54), информация о которой позволяет вести эффективный отбор по комплексу признаков (55), необходима для понимания способности культурного вида наиболее полно реализовать адаптивный потенциал и формировать высокий урожай. Мы определили пределы изменчивости фенотипических признаков у растений кресс-салата в условиях светокультуры. Наибольшей изменчивостью характеризовались средняя масса растения и урожайность ( Cv соответственно
40,3 и 38,3 %) (табл. 1), изменчивость остальных параметров была средней по величине.
1. Внутривидовая изменчивость кресс-салата Lepidium sativum L. из коллекции ВИР по фенотипическим признакам ( N = 3, n = 72, биополигон ФГБНУ АФИ, г. Санкт-Петербург, 2022 год)
|
Показатель 1 |
М |
Me |
min |
1 max |
±SD |
1 Cv , % |
|
Вегетационный период, сут |
25,0 |
27,0 |
15,0 |
27,0 |
3,9 |
15,5 |
|
Высота розетки, см |
8,0 |
7,8 |
5,5 |
11,8 |
1,3 |
15,7 |
|
Диаметр розетки, см |
15,2 |
15,3 |
8,8 |
21,2 |
2,4 |
15,7 |
|
Длина листа, см |
5,8 |
5,6 |
3,4 |
8,9 |
1,1 |
19,2 |
|
Ширина листа, см |
3,3 |
3,3 |
2,1 |
5,2 |
0,6 |
17,9 |
|
Масса растения, г |
2,8 |
2,4 |
1,1 |
6,6 |
1,1 |
40,3 |
|
Урожайность, кг/м2 |
1,1 |
1,0 |
0,5 |
2,5 |
0,4 |
38,3 |
Для светокультуры наиболее важные хозяйственные признаки — продолжительность вегетационного периода, масса растения и устойчивость к раннему стеблеванию, чем во многом определяются урожайность и товарные качества растительной продукции. В условиях светокультуры 76 % изученных образцов были устойчивы к раннему стеблеванию, 24 % перешли к стеблеванию на 15-19-е сут.
Скороспелые и ультраскороспелые формы относились преимущественно к var. crispum и var. sativum , позднеспелые — к var. latifolium . Позднеспелые образцы характеризуются поздним или замедленным стеблеванием и ценны высокой урожайностью, но при этом дают 13-14 урожаев в год. Скороспелые формы позволяют чаще получать свежий урожай, а уль-траскороспелые формы с периодом вегетации 15 сут — до 24 урожаев в год в условиях светокультуры. Суммарная урожайность за год в расчете на 1 м2 у скороспелых и позднеспелых форм кресс-салата мало различалась и в среднем составляла соответственно 16,3±4,5 и 16,1±6,2 кг/м2, у образца Местный (к-112, Азербайджан) урожайность составила 33,3 кг/м2. О сходных результатах, подтверждающих широкую внутривидовую изменчивость кресс-салата, сообщали другие исследователи (27, 29, 56).
Для выявления доли изменчивости фенологических и морфологических признаков, обусловленной различными факторами, мы провели однофакторный дисперсионный анализ (табл. 2). Установлено, что основной вклад в вариабельность вносил генотип (от 70,0 до 89,4 %), в значительно меньшей степени — ботаническая принадлежность образцов (от 19 до 39 %) (см. табл. 2).
2. Вклад генотипа (Г) и разновидности (Р) в общую дисперсию фенотипических признаков кресс-салата Lepidium sativum L. из коллекции ВИР (p ≤ 0,05, однофакторный дисперсионный анализ) ( N = 3, n = 72, биополигон ФГБНУ АФИ, г. Санкт-Петербург, 2022 год)
|
Показатель |
SS |
df |
MS |
F |
Вклад фактора, % |
|||||
|
Г 1 |
Р |
Г I |
Р |
Г |
1 Р |
Г 1 |
Р |
Г 1 |
Р |
|
|
Вегетационный |
||||||||||
|
период, сут |
3239,83 |
681,48 |
71 |
2 |
45,63 |
340,74 |
- |
28,37 |
- |
21,0 |
|
Высота розетки, см |
237,84 |
94,11 |
71 |
2 |
3,35 |
47,05 |
4,75 |
40,86 |
70,1 |
27,7 |
|
Диаметр, см |
1007,80 |
367,56 |
71 |
2 |
14,19 |
183,78 |
9,19 |
45,38 |
81,9 |
29,9 |
|
Длина листа, см |
210,97 |
51,07 |
71 |
2 |
2,97 |
25,54 |
8,06 |
25,55 |
79,9 |
19,3 |
|
Ширина листа, см |
59,97 |
22,24 |
71 |
2 |
0,84 |
11,12 |
7,70 |
44,27 |
79,2 |
29,4 |
|
Масса растения, г |
237,54 |
103,78 |
71 |
2 |
3,34 |
51,89 |
17,02 |
68,20 |
89,4 |
39,0 |
|
Урожайность, кг/м2 |
38,00 |
16,60 |
71 |
2 |
0,53 |
8,30 |
17,02 |
68,20 |
89,4 |
39,0 |
|
Пр и меч ани е. Прочерки означают, что дисперсия достоверно не различается |
||||||||||
Биохимический анализ. Содержание сухого вещества и аскорбиновой кислоты. Питательная ценность и полезный выход овощной про- дукции определяются содержанием сухих веществ. В нашем исследовании диапазон изменчивости между изученными коллекционными образцами по этому показателю составил от 6,3 до 12,7 % (Cv = 14,4 %).

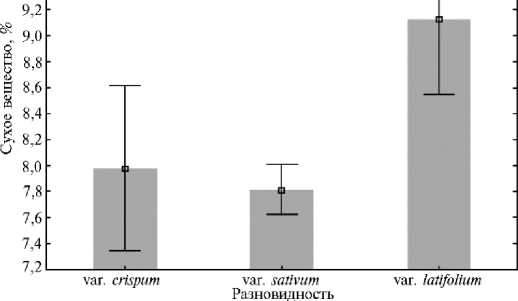
Рис. 1. Изменчивость содержания сухого вещества у кресс-салата Lepidium sativum L. из коллекции ВИР в зависимости от разновидности ( n = 72, биополигон ФГБНУ АФИ, г. Санкт-Петербург, 2022 год). На рисунке представлены средние значения и доверительные интервалы,
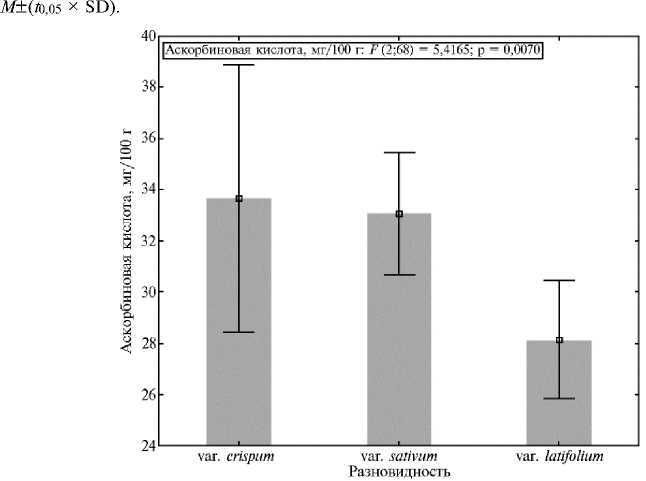
Рис. 2. Изменчивость содержания аскорбиновой кислоты у кресс-салата Lepidium sativum L. из коллекции ВИР в зависимости от разновидности ( n = 72, биополигон ФГБНУ АФИ, г. Санкт-Петербург, 2022 год). На рисунке представлены средние значения и доверительные интервалы, M ±( t 0,05 ½ SD).
Скороспелые образцы var. crispum характеризовались содержанием сухого вещества в пределах 7,2-9,7 %; образцы var. sativum — 6,3-8,8 %, при этом у ультраскороспелых образцов этой разновидности содержание сухого вещества было меньше (в среднем 7,6 %) по сравнению со скороспелыми и позднеспелыми формами (в среднем 7,9 %). Образцы var. latifolium накапливали сухое вещество в пределах 6,7-12,7 %, у скороспелых форм этой разновидности показатель в среднем оставил 8,7 %, у позднеспелых — 9,4 %
(рис. 1). Высоким содержанием сухого вещества (более 10 %) характеризовались позднеспелые образцы var. latifolium из Азербайджана (к-12, к-15, к-132, к-153) и Грузии (к-100, к-106, к-248). Эти данные согласуются с результатами, полученными другими исследователями для различных образцов кресс-салата в фазу хозяйственной спелости — 8,3-13,6 % (24), 11,517,0 % (33), 4,1-13,6 % (28).
Содержание в растениях аскорбиновой кислоты — одного из важнейших биологически активных веществ находилось в пределах от 20,0 до 44,0 мг/100 г ( Cv = 20,6 %). Образцы var. crispum и var. sativum накапливали в среднем соответственно 33,7±5,0 и 33,1±6,2 мг/100 г аскорбиновой кислоты, при этом скороспелые и ультраскороспелые формы указанных разновидностей характеризовались большим содержанием витамина С. Образцы var. latifolium накапливали в среднем 28,1±5,8 мг/100 г аскорбиновой кислоты, значимых различий между скороспелыми и позднеспелыми формами этой разновидности мы не выявили (рис. 2). Высоким содержанием (более 40 мг/100 г) характеризовались ультраскороспелые образцы var. sativum (к-42, Россия; к-124, Непал; к-224, Германия) и var. crispum (к-245, Зимбабве) и позднеспелый местный образец из Грузии (к-44).
Следует отметить, что биохимический состав кресс-салата в интенсивной светокультуре ранее не изучали. В работах ряда авторов оценены биохимические показатели одного-двух сортов при летнем выращивании в открытом грунте и в условиях гидропоники (30, 31). В открытом грунте содержание аскорбиновой кислоты у двух сортов составляло 54 и 74 мг/100 г.
Содержание пигментов . Количество пигментов и их соотношение существенно влияют на метаболизм растений и могут различаться в зависимости от вида или сорта растения, а также от фазы его онтогенеза (57).
3. Внутривидовая изменчивость пигментного состава (мг/100 г) у образцов кресс-салата Lepidium sativum L. из коллекции ВИР ( N = 3, n = 72, биополигон ФГБНУ АФИ, г. Санкт-Петербург, 2022 год)
|
Показатель |
М |
Me |
min |
max |
±SD |
Cv , % |
|
Антоцианы |
13,6 |
11,8 |
3,9 |
27,3 |
5,8 |
42,5 |
|
Хлорофилл a |
85,2 |
83,4 |
63,7 |
118,7 |
13,4 |
15,8 |
|
Хлорофилл b |
24,2 |
23,9 |
16,0 |
34,8 |
4,3 |
17,8 |
|
Сумма хлорофиллов |
109,4 |
106,4 |
79,7 |
153,4 |
17,6 |
16,1 |
|
Каротиноиды |
33,2 |
32,8 |
24,9 |
45,7 |
5,2 |
15,7 |
|
Каротины |
5,7 |
5,8 |
2,0 |
8,1 |
1,1 |
19,1 |
|
β-Каротин |
4,4 |
4,4 |
3,3 |
6,1 |
0,7 |
15,5 |
В нашем исследовании впервые определены пределы изменчивости пигментного состава у образцов кресс-салата в условиях светокультуры (табл. 3). Наибольшую вариабельность отмечали по содержанию антоцианов ( Cv = 42,5 %). Большинство образцов кресс-салата не имели антоциановой окраски, но встречались формы с такой окраской на стебле — Мере-живо (вр.334, Украина), Cressonа le'noir (к-85, Франция), местные образцы из Пакистана (к118), Армении (к-11, к-51) и Белоруссии (к-99), которые считаются перспективным материалом для селекции. По накоплению остальных пигментов изменчивость была средней (см. табл. 3).
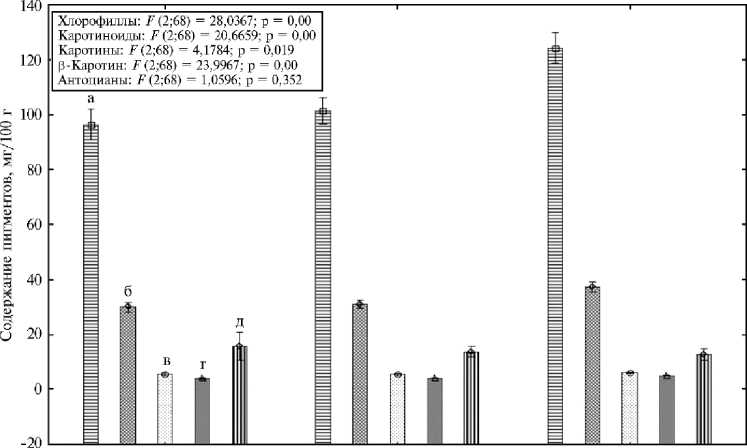
Мы выявили статистически значимые различия между образцами и разновидностями по содержанию хлорофиллов и каротиноидов, включая каротин и β-каротин (рис. 3). По накоплению каротинов наибольшую вариабельность внутри разновидности ( Cv = 24,7 %) демонстрировали формы var. sativum , по содержанию антоцианов ( Cv = 44,7 %) — var. crispum . Образцы var. latifolium в целом характеризовались большим содержанием суммы хлорофиллов, каротиноидов, каротинов и β-каротина.
var. erispum var. sativum var. latifolium
Разновидность
Рис. 3. Изменчивость пигментного состава у кресс-салата Lepidium sativum L. из коллекции ВИР в зависимости от разновидности: а — хлорофиллы, б — каротиноиды, в — каротины, г — в -каротин, д — антоцианы ( n = 72, биополигон ФГБНУ АФИ, г. Санкт-Петербург, 2022 год). На рисунке представлены средние значения и доверительные интервалы, M ±( t o,o5 х SD).
Ранее мы провели сравнительный анализ накопления пигментов в растениях 35 образцов кресс-салата в зависимости от разновидности и условий выращивания — в открытом и защищенном грунте и в светокультуре (58). Наибольшее содержание хлорофиллов, антоцианов и каротинов отмечали в условиях светокультуры, тогда как накопление β-каротина снижалось. Общее содержание каротиноидов увеличивалось при выращивании в открытом грунте (58). В том же исследовании выявлено, что образцы кресс-салата var. crispum характеризовались большим накоплением антоцианов, образцы var. sativum — большим накоплением суммы хлорофиллов и каротиноидов, образцы var. latifolium — каротинов и β-каротина в среднем по всем условиям выращивания (58). В представленной работе по изучению 72 образцов кресс-салата в условиях светокультуры подтвердились результаты по высокому накоплению каротинов (6,1±0,6 мг/100 г) и β-каротина (5,0±0,6 мг/100 г) у образцов var. latifolium .
Источники ценных признаков у кресс-салата. На основе фенотипического, морфологического и биохимического анализа 72 образцов кресс-салата из коллекции ВИР в условиях интенсивной светокультуры нами выделен перспективный материал, который может быть использован в селекции. Высокопродуктивными и устойчивыми к раннему стеблеванию были местные образцы var. latifolium из Ирана (к-91) и Азербайджана (к112, к-125, к-131), образец var. sativum из Ирана (к-92) и скороспелый образец var. crispum Almindelig (к-185, Дания). По содержанию аскорбиновой кислоты выделились два образца — местный образец var. latifolium из Грузии (к-44) и образец var. sativum из Германии (к-224). Генетическими источниками высокого содержания антоцианов могут считаться образцы var. crispum Cressonа le noir (к-85, Франция), Мереживо (вр. к-334, Украина) и Curled (к-245, Зимбабве), хлорофиллов и β-каротина — образцы var. lati-folium из Азербайджана (к-15 и к-125) и образец var. sativum из Армении (к-167) (табл. 4). Выделившиеся по признакам скороспелости, продуктивности и содержанию аскорбиновой кислоты и пигментов образцы кресс- салата представляют наибольший интерес для выращивания в условиях интенсивной светокультуры, а также для использования в качестве источников хозяйственно ценных признаков в селекционной работе.
-
4. Образцы кресс-салата Lepidium sativum L. из коллекции ВИР, выделившиеся по комплексу хозяйственно ценных признаков в изученной выборке (n = 72, М±SD, биополигон ФГБНУ АФИ, г. Санкт-Петербург, 2022 год)
Образец
Устойчивость к раннему стеблеванию
Годовой урожай с 1 м2, кг
Содержание, мг/100 г
аскорбиновая кислота
антоцианы
хлорофиллы
β-каротин
Раз н о в ид н о с ть var. latifolium
к-91, Иран
+
28,77±3,86b
22,0±2,6a
6,9±0,8a
110,4±12,7a
4,4±0,5a
к-131, Азербайджан
+
27,88±1,50b
22,0±3,1a
10,0±1,4b
122,3±16,7b
4,8±0,6a
к-112, Азербайджан
+
33,22±3,14c
35,0±3,9b
11,0±1,4b
105,4±14,6a
4,2±0,6a
к-125, Азербайджан
+
23,61±3,27a
32,0±4,1b
9,4±1,2b
153,4±19,7d
6,1±0,6b
к-15, Азербайджан
+
20,73±1,65a
22,0±2,1a
20,8±2,5c
144,3±19,1c
5,8±0,9b
к-44, Грузия
+
20,17±3,20a
44,0±5,7c
10,1±1,3b
133,6±15,9b
5,5±0,6b
Среднее по
разновидности
17,34±5,04
28,2±5,9
12,7±5,2
124,2±14,0
5,0±0,6
Р аз н о в идно сть var. sativum
к-92, Иран
+
24,82±3,06d
28,0±3,4b
9,1±1,2a
112,2±12,2c
4,5±0,6b
к-167, Армения
+
20,03±2,76c
22,0±3,7a
10,6±1,3a
143,9±18,6d
5,8±0,7c
к-224, Германия
–
20,80±2,66c
44,0±4,6c
9,0±0,1a
79,7±10,8a
3,3±0,5a
к-42, Узколистный
3, Россия
+
8,96±0,73a
42,0±4,8c
14,3±1,8b
96,0±11,5b
3,9±0,5a
к-124, Непал
+
12,27±1,83b
42,0±5,9c
19,9±2,6c
83,5±10,6a
3,4±0,4a
Среднее по
разновидности
15,23±4,39
33,1±6,2
13,7±8,8
101,3±13,8
4,1±0,6
Р азн о видн о сть var. crispum
к-185, Almindelig,
Дания
–
22,90±3,04c
36,0±4,0b
12,8±1,5a
87,6±11,4a
3,6±0,4a
вр. 334, Мереживо,
Украина
+
9,41±1,09a
28,0±3,6a
27,3±3,4c
90,3±11,8a
3,8±0,5a
к-85, Cressonа
le'noir, Франция
+
11,09±1,20a
30,0±3,8a
26,8±3,8c
111,8±15,9c
4,5±0,6b
к-245, Curled,
Зимбабве
–
16,80±2,43b
42,0±5,0c
22,2±2,8b
103,4±12,4b
4,3±0,5b
Среднее по
разновидности
15,11±3,89
33,7±5,0
15,8±7,0
96,4±7,7
4,0±0,3a
Среднее по
коллекции
16,14±5,44
31,0±6,4
13,6±5,8
109,4±17,6
4,4±0,7
НСР 05
3,16
2,3
2,0
6,0
0,2
а-d Значения с разным надстрочным индексом в столбце различались статистически значимо при p < 0,05
(Tukey's HSD test).
Таким образом, в репрезентативной выборке из мировой коллекции кресс-салата трех разновидностей — var. sativum , var. crispum и var. latifolium разного эколого-географического происхождения мы оценили изменчивость морфологических, фенологических и биохимических признаков в условиях интенсивной светокультуры. Показано, что наиболее вариабельны средняя масса растения ( Cv = 40,3 %), урожайность ( Cv = 38,3 %) и содержание антоцианов ( Cv = 42,5 %), остальные признаки характеризуются средней степенью изменчивости ( Cv не более 20 %). Скороспелые и уль-траскороспелые формы представлены var. crispum и var. sativum , позднеспелые — преимущественно образцами var. latifolium . Для позднеспелых образцов характерен поздний или замедленный переход к стеблеванию, большая масса растения (в среднем 3,6 г) и высокое содержание сухого вещества (в среднем 9,0 %). Скороспелые и ультраскороспелые формы накапливают большее количество аскорбиновой кислоты (в среднем 32,8±5,7 мг/100 г), при этом более короткий вегетационный период позволяет снимать большее число урожаев за год. В результате суммарная продуктивность с 1 м2 за год у позднеспелых и скороспелых форм кресс-салата мало различается и составляет соответственно 16,1±6,2 и 16,3±4,5 кг/м2. В изученной выборке наиболее урожайными оказались позднеспелые образцы var. latifolium из
Ирана (к-91) и Азербайджана (к-112, к-125, к-131), образец var. sativum из Ирана (к-92) и образец var. crispum из Дании (к-185). Найдены статистически достоверные различия между образцами и разновидностями по содержанию хлорофиллов и каротиноидов. Наиболее изменчивыми по содержанию каротинов были образцы var. sativum ( Cv = 24,7 %), по содержанию антоцианов — представители var. crispum ( Cv = 44,7 %). Образцы var.
latifolium в целом характеризовались большим суммарным содержанием хлорофиллов (124,2±14,0 мг/100 г), каротиноидов (37,3±4,4 мг/100 г), каротинов (6,1±0,6 мг/100 г) и β-каротина (5,0±0,6 мг/100 г). Выделены образцы кресс-салата разных разновидностей, представляющие наибольший интерес по скорости роста, устойчивости к стеблеванию и урожайности, формируемой в условиях интенсивной светокультуры, а также потенциальные источники хозяйственно ценных признаков для селекции форм кресс-салата, наиболее адаптированных к условиям интенсивной светокультуры.
Список литературы Изменчивость морфологических и биохимических признаков кресс-салата (Lepidium sativum L.) из коллекции ВИР в условиях интенсивной светокультуры
- Солдатенко А.В., Пивоваров В.Ф., Харченко В.А., Иванова М.И. Селекция листовых и пряно-ароматических культур: состояние и направления. Овощи России, 2019, 3: 7-14 (doi: 10.18619/2072-9146-2019-3-7-14).
- Лудилов В.А. Иванова М.И. Азбука овощевода. М.:, 2004.
- Benke K., Tomkins B. Future food-production systems: vertical farming and controlled-environ-ment agriculture. Sustainability: Science, Practice and Policy, 2017, 13(1): 13-26 (doi: 10.1080/15487733.2017.1394054).
- Al-Kodmany, K. The vertical farm: A review of developments and implications for the vertical city. Buildings, 2018, 8(2): 24 (doi: 10.3390/buildings8020024).
- Payen F. T., Evans D. L., Falagán N., Hardman C. A., Kourmpetli S., Liu L., et al. How much food can we grow in urban areas? Food production and crop yields of urban agriculture: A meta-analysis. Earth's Future, 2022, 10: e2022EF002748 (doi: 10.1029/2022EF002748).
- Plant factory: an indoor vertical farming system for efficient quality food production /Kozai T., G. Niu, M. Takagaki (eds.). Academic Press, 2019.
- Reddy R.V.S.K., Omprasad J., Janakiram T. Technological innovations in commercial high tech horticulture, vertical farming and landscaping. Int. J. Innov. Hortic., 2022, 11(1): 78-91 (doi: 10.5958/2582-2527.2022.00008.2).
- Lubna F.A., Lewus D.C., Shelford T.J., Both A.-J. What you may not realize about vertical farming. Horticulturae, 2022, 8: 322 (doi: 10.3390/horticulturae8040322).
- Wong C. E., Teo Z. W. N., Shen L., Yu H. Seeing the lights for leafy greens in indoor vertical farming. Trends Food Sci. Technol., 2020, 106: 48-63 (doi: 10.1016/j.tifs.2020.09.031).
- Kozai T. Towards sustainable plant factories with artificial lighting (PFALs) for achieving SDGs. Int. J. Agric. & Biol. Eng. (IJABE), 2019, 12(5): 28-37 (doi: 10.25165/j.ijabe.20191205.5177).
- Панова Г.Г., Удалова О.Р., Канаш Е.В., Галушко А.С., Кочетов А.А., Прияткин Н.С., Архи-пов М.В., Черноусов И.Н. Основы физического моделирования «идеальных» агроэкосистем. Журнал технической физики, 2020, 90(10): 1633-1639 (doi: 10.21883/JTF.2020.10.49792.429-19).
- Egorova K. V., Sinyavina N. G., Artemyeva A. M., Kocherina N. V., Chesnokov Y. V. QTL Analysis of the Content of Some Bioactive Compounds in Brassica rapa L. Grown under Light Culture Conditions. Horticulturae, 2021, 7(12): 583 (doi: 10.3390/horticulturae7120583).
- Артемьева А. М., Синявина Н. Г., Панова Г. Г., Чесноков Ю. В. Биологические особенности капустных овощных культур вида Brassica rapa L. при выращивании в интенсивной светокультуре. Сельскохозяйственная биология, 2021, 56(1): 103-120 (doi: 10.15389/agrobiology.2021.1.103rus).
- Кочетов А.А., Мирская Г.В., Синявина Н.Г., Егорова К.В. Трансгрессивная селекция: методология ускоренного получения новых форм растений с прогнозируемым комплексом хозяйственно ценных признаков. Российская сельскохозяйственная наука, 2021, 6: 29-37 (doi: 10.31857/S2500262721060065).
- Курина А.Б., Артемьева А.М., Синявина Н.Г., Кочетов А.А., Панова Г.Г. Биологические особенности редиса (Raphanus sativus L.) при выращивании в условиях интенсивной светокультуры. Картофель и овощи, 2019, 4: 26-29 (doi: 10.25630/PAV.2019.68.78.004).
- Hayashi E., Kozai T. Phenotyping- and AI-Based Environmental Control and Breeding for PFAL. Smart Plant Factory, 2018, 405-411 (doi: 10.1007/978-981-13-1065-2_25).
- Watson A., Ghosh S., Williams M. J., Cuddy W. S., Simmonds J., Rey M. D., Hickey L. T. Speed breeding is a powerful tool to accelerate crop research and breeding. Nat. Plants, 2018, 4: 23-29 (doi: 10.1038/s41477-017-0083-8).
- Ghosh S., Watson A., Gonzalez-Navarro O. E., Ramirez-Gonzalez R. H., Yanes L., Hickey L.T. Speed breeding in growth chambers and glasshouses for crop breeding and model plant research. Nat. Protoc., 2018, 13 (12): 2944-2963 (doi: 10.1038/s41596-018-0072-z).
- Синявина Н.Г., Кочетов А.А., Егорова К.В., Кочерина Н.В., Чесноков Ю.В. Генетико-биохимические исследования и морфобиологическая оценка редиса (Raphanus sativus L.) в условиях интенсивной светокультуры. Генетика, 2022, 58(6): 668-677 (doi: 10.31857/S0016675822060108).
- Фотев Ю.В., Артемьева А.М., Зверева О.А. Генетические ресурсы овощных растений: от селекции нетрадиционных культур к функциональным продуктам питания. Вавиловский журнал генетики и селекции, 2021, 25(4): 442-447 (doi: 10.18699/VJ21.049).
- Ramirez D., Abellán-Victorio A., Beretta V., Camargo A., Moreno D.A. Functional ingredients from Brassicaceae species: overview and perspectives. Int. J. Mol. Sci., 2020, 21(6): 1998 (doi: 10.3390/ijms21061998).
- Aqafarini A., Lotfi M., Norouzi M., Karimzadeh G. Induction of tetraploidy in garden cress: morphological and cytological changes. Plant Cell, Tissue and Organ Culture (PCTOC), 2019, 137(3): 627-635 (doi: 10.1007/s11240-019-01596-5).
- Bedassa T., Eshete M. Genetic divergence analysis of garden cress (Lepidium sativum L.). Int. J. Biodivers. Conserv., 2013, 5(11): 770-774 (doi: 10.5897/IJBC2013.0626).
- Циунель М. М. Кресс-салат. Гавриш, 2006, 6: 8-9.
- Sharma A. A comprehensive review on pharmacological properties of garden cress (Lepidium sativum) seeds. Res. in Pharm. Sci., 2020, 10: 13-18 (doi: 10.24092/CRPS.2020.100201).
- Bansal D., Bhasin P., Yadav O., Punia A. Assessment of genetic diversity in Lepidium sativum (Chandrasur) a medicinal herb used in folklore remedies in India using RAPD. Journal, Genetic Engineering & Biotechnology, 2012, 10(1): 39-45 (doi: 10.1016/j.jgeb.2012.04.002).
- Sabaghnia N., Ahadnezhad A., Janmohammdi M. Genetic variation in garden cress (Lepidium sativum L.) germplasm as assessed by some morphological traits. Genet. Resour. Crop Evol., 2015, 62(5): 733-745 (doi: 10.1007/s10722-014-0192-4).
- Гиренко М.М., Коровина О.Н., Дорофеев В.Ф. Культурная флора СССР. Т. 12. Листовые овощные растения (спаржа, ревень, щавель, шпинат, портулак, кресс-салат, укроп, цикорий, салат). Л., 1988.
- Bedassa T., Andargie M., Eshete M. Genetic variability and association among yield, yield related traits and oil content in Ethiopian garden cress (Lepidium sativum L.) genotypes. J. Plant Breed. Crop Sci., 2013, 7(5): 141-149 (doi: 10.5897/JPBCS2013.0396).
- Беспалько Л.В., Молчанова А.В., Пинчук Е.В., Сирота С.М., Козарь Е.Г. Биохимический состав пряноароматических культур при выращивании на установке многоярусной узко-стеллажной гидропоники в защищенном грунте. Сельскохозяйственные науки, 2017, 7-1(33): 240-244.
- Sat I.G., Yildirim E., Turan M., Demirbas M. Antioxidant and nutritional characteristics of garden cress (Lepidium sativum). Acta Sci. Polonorum-Hort. Cultus, 2013, 12: 173-179.
- Malar J., Chairman K., Singh A. R. J., Vanmathi J. S., Balasubramanian A., Vasanthi K. Anti-oxidative activity of different parts of the plant Lepidium sativum Linn. Biotechnology Reports, 2014, 3: 95-98 (doi: 10.1016/j.btre.2014.05.006).
- Чижикова О.Г. Кресс-салат и мята как перспективное сырье для хлебобулочных изделий. Известия ДВФУ. Экономика и управление, 2017, 1: 113-118.
- Ajdanian L., Mehdi Babaei, Hossein Aroiee. Investigation of photosynthetic effects, carbohydrate and starch content in cress (Lepidium sativum) under the influence of blue and red spectrum. Heliyon, 2020, 6: e05628 (doi: 10.1016/j.heliyon.2020.e05628).
- Hassan L.G., Hassan S.W., Hashim T., Umar K.J., Sani N.A. Determination of nutritive values of garden cress (Lepidium Sativum L.) leaves. Bayero Journal of Pure and Applied Sciences, 2012, 4: 18-23 (doi: 10.4314/bajopas.v4i2.4).
- Пинчук Е.В., Беспалько Л.В., Козарь Е.Г., Балашова И.Т., Сирота С.М., Шевченко Т.Е. Ценная овощная зелень на гидропонике для круглогодичного потребления. Овощи России, 2019, 3: 45-53 (doi: 10.18619/2072-9146-2019-3-45-53).
- Ajdanian L., Babaei M., Aroiee H. The growth and development of cress (Lepidium sativum) affected by blue and red light. Heliyon, 2019, 5(7): e02109 (doi: 10.1016/j.heliyon.2019.e02109).
- Sharma S., Agarwal N. Nourishing and healing prowess of garden cress (Lepidium sativum Linn.) — a review. Indian Journal of Natural Products and Resources, 2011, 2: 292-297.
- Buso P., Manfredini S., Reza Ahmadi-Ashtiani H., Sciabica S., Buzzi R., Vertuani S., Baldis-serotto A. Iranian medicinal plants: from ethnomedicine to actual studies. Medicina, 2020, 56(3): 97 (doi: 10.3390/medicina56030097).
- Jahani S., Heidari Z., Azami M., Moudi B. Comparison of anticancer effects of hydroalcoholic extracts of Camellia sinensis and Lepidium sativum L on hela cell line. International Journal of Cancer Management, 2020, 13(11): e98913 (doi: 10.5812/ijcm.98913).
- Rajab W.J., Ali L.H. Efficacy of Lepidium sativum seeds against carbon tetra chloride induced hepa-totoxicity in rats. Biochemical and Cellular Archives, 2020, 20(1): 1141-1146.
- Painuli S., Quispe C., Herrera-Bravo J., Semwal P., Martorell M., Almarhoon Z.M., Seilkhan A., Ydyrys A., Rad J.S., Alshehri M.M., Daştan S.D., Taheri Y., Calina D., Cho W.C. Nutraceutical profiling, bioactive composition, and biological applications of Lepidium sativum L. Oxid. Med. Cell Longev., 2022, 2022: 2910411 (doi: 10.1155/2022/2910411.а).
- Al-Yahya M., Mossa J., Ageel A., Rafatullah S. Pharmacological and safety evaluation studies on Lepidium sativum L., Seeds. Phytomedicine, 1994, 1(2): 155-159 (doi: 10.1016/S0944-7113(11)80035-8).
- Yadav Y.C., Srivastav D., Seth A., Saini V., Balaraman R., Ghelani T.K. In vivo antioxidant po-tential of Lepidium sativum L. seeds in albino rats using cisplatin induced nephrotoxicity. Interna-tional Journal of Phytomedicine, 2010, 2(3): 292-298.
- Patel U., Kulkarni M., Undale V., Bhosale A. Evaluation of diuretic activity of aqueous and meth-anol extracts of Lepidium sativum garden cress (Cruciferae) in rats. Tropical Journal of Pharmaceutical Research, 2009, 8(3): 215-219 (doi: 10.4314/tjpr.v8i3.44536).
- Paranjape A.N., Mehta A.A. A study on clinical efficacy of Lepidium sativum seeds in treatment of bronchial asthma. Iranian Journal of Pharmacology & Therapeutic, 2006, 5(1): 55-59.
- Raval N.D., Ravishankar B., Ashok B. Anti-inflammatory effect of Chandrashura (Lepidium sativum Linn.) an experimental study. AYU (An International Quarterly Journal of Research in Ayurveda), 2013, 34(3): 302 (doi: 10.4103/0974-8520.123132).
- Панова Г.Г., Черноусов И.Н., Удалова О.Р., Александров А.В., Карманов И.В., Аникина Л.М., Судаков В.Л., Якушев В.П. Научно-технические основы круглогодичного получения высоких урожаев качественной растительной продукции при искусственном освещении. Доклады Российской академии сельскохозяйственных наук, 2015, 4: 17-21.
- Иванова К.В., Гиренко М.М. Методические указания по изучению малораспространенных овощных культур. Л., 1968.
- Ермаков А.И., Арасимович В.В., Ярош Н.П. Методы биохимического исследования растений. Л., 1987.
- StatSoft Inc., Electronic Statistics Textbook (Electronic Version), StatSoft, Inc., Tulsa, 2013. Режим доступа: http://www.statsoft.com/textbook. Без даты.
- Наследов А.Д. Математические методы психологического исследования. Анализ и интерпретация данных. СПб, 2012.
- Пивоваров В.Ф., Добруцкая Е.Г. Экологические основы селекции и семеноводства овощных культур. М., 2000.
- Жученко А.А. Адаптивный потенциал культурных растений. Кишинев, 1988.
- Лудилов В.А., Иванова М.И. Редкие и малораспространенные овощные культуры (биология, выращивание, семеноводство). М., 2009.
- Kumar V., Kumar Yadav H. Assessment of genetic diversity in Lepidium sativum L. using inter simple sequence repeat (ISSR) marker. Physiol. Mol. Biol. Plants, 2019, 25(2): 399-406 (doi: 10.1007/s12298-018-0622-4).
- Белова А.Ю., Мурашев С.В., Вержук В.Г. Влияние пигментов в листьях растений на формирование и свойства плодов. Научный журнал НИУ ИТМО. Сер. Процессы и аппараты пищевых производств, 2012, 1(13): 13.
- Железнова К.О., Соловьева А.Е., Курина А.Б. Разнообразие кресс-салата (Lepidium sativum L.) и руколы (Eruca sativa L.) коллекции ВИР по пигментному составу. Тезисы Международной научно-практической конференции «Ароматические и лекарственные растения: интродукция, селекция, агротехника, биологически активные вещества, влияние на человека» (Ялта, 2021 год). Симферополь, 2021: 43.


