Изменение биологических параметров семени сельскохозяйственной птицы при криоконсервации
Автор: Иолчиев Б.С., Багиров В.А., Жилинский М.А., Волкова Н.А., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Репродуктивные технологии
Статья в выпуске: 6 т.53, 2018 года.
Бесплатный доступ
Формирование криобанков - важнейшее условие применения вспомогательных репродуктивных технологий, которые позволяют эффективнее использовать генетический материал, обеспечивать максимальную численность потомства, восстанавливать и сохранять редкие и исчезающие виды. Наиболее распространенным биоматериалом в программах по сохранению и восстановлению генетических ресурсов сельскохозяйственной птицы служат сперматозоиды. При замораживании и оттаивании они подвергаются сильному технологическому воздействию. Некоторые этапы этой процедуры приводят к гибели значительной части клеток, повреждению их органелл или сегментов. В настоящей работе впервые получены данные, подтверждающие, что в процессе эквилибрации содержание мертвых сперматозоидов в генеративной плазме значительно увеличивается, независимо от вида птиц. Целью нашей работы было изучение влияния цикла замораживания и оттаивания на биологические характеристики сперматозоидов у разных видов сельскохозяйственной птицы...
Петухи, перепела, цесари, индюки, гусаки, криоконсервация, сперматозоиды, аномалии, замораживание-оттаивание, эквилибрация, качество спермы
Короткий адрес: https://sciup.org/142220071
IDR: 142220071 | УДК: 636.5:636.082:591.463.1 | DOI: 10.15389/agrobiology.2018.6.1230rus
Текст научной статьи Изменение биологических параметров семени сельскохозяйственной птицы при криоконсервации
Птицепродукты — один из основных источников белков, жиров, минеральных веществ и витаминов среди продуктов питания (1). Быстрые мировые темпы развития птицеводства (с 2012 по 2016 год численность кур в России увеличилась на 14,6 %, в мире — на 10,8 %) (2) обусловлены его экономической эффективностью (известно, что птица превосходит других сельскохозяйственных животных по скороспелости и конверсии корма). Объем производства мяса птицы составляет более 300 млн т/год, но потребность в продукции птицеводства удовлетворяется лишь на 34 %. Это в соче-
∗ Работа выполнена при финансовой поддержке гранта РНФ ¹ 16-16-04104 (оценка биологических параметров семени перепелов, гусаков, индюков) и в рамках задания Федерального агентства научных организаций (ФАНО России) ¹ АААА-А18-118021590132-9 (оценка биологических параметров семени петухов).
тании с технологичностью отрасли стимулирует ее развитие (3, 4).
К сдерживающим факторам относится недостаточное применение вспомогательных репродуктивных технологий, в том числе криоконсервации и искусственного осеменения — методов, позволяющих компенсировать репродуктивные потери, которые связывают с ростом продуктивности животных (5). Криоконсервация биологического материала служит важнейшим звеном интеграции репродуктивных технологий в практику (6-8). Однако в птицеводстве использование криоконсервированной спермы ограничено, что во многом обусловлено неудовлетворительным качеством оттаянного семени. При замораживании и оттаивании генеративной плазмы птиц снижается фертильность сперматозоидов (9, 10). Сперматозоиды птиц имею минимальный размер цитоплазмы при относительно большой поверхности плазматической мембраны, единственные цитоплазматические органоиды — митохондрии (11, 12), ядро содержит очень конденсированный хроматин. В цикле замораживания-оттаивания в основном повреждаются плазматические и митохондральные мембраны, в результате нарушается целостность ядерной и митохондриальной ДНК, теряется активность сперматозоидов (13-15). У птиц строение сперматозоидов значительно отличается от такового у млекопитающих: длина жгутика составляет 90-100 мкм, что примерно в 8 раз больше длины головки (16-18).
Химические и физические воздействия в процессе замораживания-оттаивания неизбежно приводят к изменениям в ультраструктуре сперматозоидов и отражаются на их биологической полноценности. Криоконсервация вызывает повреждение органелл и сегментов клеток. Имеющиеся в клетках незначительные повреждения при замораживании и оттаивании усиливаются, и клетки теряют биологическую полноценность. Криорезистентность сперматозоидов и способность противостоять повреждающему эффекту ультранизкой температуры зависят от состояний мембран, их проницаемости, липидного состава, текучести (19, 20). Вследствие таких изменений коэффициент эффективности осеменения оттаянной спермой значительно ниже, чем свежеполученной и охлажденной (21-24).
Криорезистентность сперматозоидов птиц зависит от видовой особенности, несмотря на сходство морфологии (25). Отмечают внутривидовую вариабельность по криоустойчивости в зависимости от линейной принадлежности самцов петухов (26). У мускусного селезня сперматозоиды более криоустойчивы, чем у пекинской утки, сперма цесарей, если сравнивать со спермой петуха и индюка, очень чувствительны к криоконсервации (27). На биологическую полноценность сперматозоидов влияют абиотические факторы при технологической обработке. Основной из них — состав разбавителей и криопротекторов, режим замораживания и оттаивания (28, 29). Реакция сперматозоидов на эти факторы зависит от видовой особенности птиц. С увлечением срока хранения доля мертвых и анормальных сперматозоидов увеличивается. Это также зависит от породной и видовой особенности птицы: например, в сперме цесарей процесс происходит интенсивнее, чем у петухов (30).
В настоящей работе мы впервые сравнили биологические параметры спермиев у основных видов сельскохозяйственной птицы (петухи, перепела, цесари, индюки, гусаки) на разных технологических этапах в цикле замораживания-оттаивания и получили данные, подтверждающие, что в процессе эквилибрации содержание мертвых сперматозоидов в генеративной плазме значительно увеличивается независимо от вида птицы.
Нашей целью было изучение влияния цикла замораживания и оттаивания на биологические параметры сперматозоидов у разных видов сельскохозяйственной птицы.
Методика. Полновозрастных петухов Gallus gallus L. ( n = 6), перепелов Coturnix coturnix L. ( n = 10), цесарей Numida meleagris L. ( n = 6), индюков Meleagris gallopavo L. ( n = 3) и гусаков Anser anser L. ( n = 4), отобранных для опыта, содержали в индивидуальных клетках (фиизиологиеч-ский двор, ФНЦ ВИЖ им. Л.К. Эрнста, 2017-2018 годы). Рацион птицы соответствовал нормативам, предусмотренным для каждого вида.
Семя получали 3 раза в неделю с помощью спинно-брюшинного массажа. Для разбавления, хранения и криоконсервации готовили синтетическую среду (бидистилированная вода — 100 мл; фруктоза — 1,0 г; глюкоза — 1,0 г; Трис-HCl — 0,195 г; натрий фосфорнокислый двузамещенный — 1,1 г; глутамат натрия — 3,0 г). Эякуляты разбавляли синтетической средой в соотношении 1:1, после чего проводили эквилибрацию образцов при температуре 5 ° С в течение 180 мин. Перед криоконсервацией в образцы добавляли диметилацетамид в качестве криопротектора, поэтапно доводя его концентрацию до 8 %. Образцы замораживали в соломинках объемом 0,25 мл. Использовали автоматический замораживатель Biofreeze BV-65 («Consarctic Entwicklung Und Handels GmbH», Германия).
Качество спермы оценивали при микроскопировании (Nikon Eclipse Ni, «Nikon Corporation», Япония; микроскоп оборудован системой ввода изображений) с помощью программного обеспечения Зоосперм 1.0 (ООО «ВидеоТесТ», Россия). Учитывали долю и сравнивали морфологию сперми-ев, перемещающихся прогрессивно-поступательно, непрямолинейно, а также неподвижных клеток. Для определения доли жизнеспособных сперматозоидов применяли суправитальную окраску мазка 5 % раствором эозина.
Обработку данных осуществляли в пакете программ Microsoft Excel. В таблицах представлены средние ( M ) и стандартные ошибки средних (±SEM). Достоверность различий оценивали по t -критерию Стьюдента. Различия считали статистически значимыми при p < 0,05.
Результаты. Показатели качества свежеполученного семени соответствовали установленным требованиям (табл. 1). Содержание подвижных сперматозоидов в эякулятах варьировало в зависимости от вида птицы. Наибольший показатель отмечали у перепелов — 87,5 %, минимальный — у гусаков (64,5 %). Средняя активность сперматозоидов в свежепо-лученной сперме у гусаков была ниже, чем у петухов, перепелов, цесарей и индюков соответственно на 21,4; 23,0; 17,0 и 17,0 %. Различия между средней подвижностью спермиев у гусаков и других исследуемых видов были статистически значимы (p < 0,001). Доля сперматозоидов с аномальной морфологией также была выше у гусаков (от 10,9 до 18,6 %, в среднем 14,6±1,2 %). У перепелов, цесарей, петухов и индюков она была ниже соответственно на 1,8; 1,1; 5,4 и 5,0 % (p < 0,001). У цесарей сперматозоиды с морфологическими отклонениями от нормы встречались чаще, чем у петухов и перепелов, — соответственно на 4,3 и 3,9 % (p < 0,01).
1. Качественные показатели свежего семени, полученного от самцов разных видов сельскохозяйственной птицы
|
Вид |
Размер выборки, n |
Подвижные сперматозоиды, % |
Сперматозоиды с аномальной морфологией, % |
Живые сперматозоиды, % |
|
Петухи |
6 |
86,1±6,4 |
9,2±2,7 |
89,2±8,1 |
|
Перепела |
10 |
87,5±3,8 |
9,6±1,2 |
92,5±6,1 |
|
Цесари |
6 |
82,1±3,5 |
13,5±2,7* |
91,6±5,4 |
|
Гусаки |
4 |
64,5±8,2** |
14,6±1,2** |
76,5±8,1 |
|
Индюки |
3 |
81,5±3,6 |
12,8±1,6 |
87,2±4,2 |
|
* Различия между цесарями, петухами и перепелами статистически значимы при p < 0,01. |
||||
** Различия между гусаками и остальными видами статистически значимы при p < 0,001.
100-
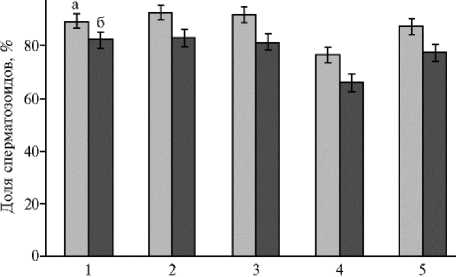
Рис. 1. Доля живых сперматозоидов в свежеполученном (а) и эквилиброванном (б) семени петухов (1) , перепелов (2) , цесарей (3) , гусаков (4) и индюков (5).
Доля живых сперматозоидов варьировала в зависимости от вида птицы от 76,5 до 92,5 %. В процессе эквилибрации она снижалась. Число мертвых сперматозоидов в образцах семени петухов после эквилибира-ции увеличивалось на 7,0 %, у перепелов — на 9,5 %, цесарей — на 10,2 %, гусаков — на 10,6 % и у индюков — на 9,8 % (рис. 1). Различия в содержания живых сперматозоидов во всех исследуемых образцах были стати- стически значимы при p ≤ 0,01.
После эквилибрации отмечалось некоторое снижение количества сперматозоидов с прямолинейно-поступательным движением. В процессе
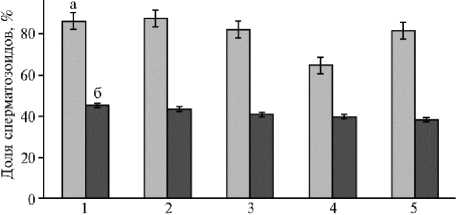
Рис. 2. Доля сперматозоидов с прямолинейно-поступательным движением в свежеполученном (а) и замороже-но-оттаянном (б) семени петухов (1) , перепелов (2) , цесарей (3) , гусаков (4) и индюков (5).
дальнейшей криоконсервации и последующего оттаивания этот показатель значительно снижался. После оттаивания доля сперматозоидов с прямолинейно-поступательным движением у петухов уменьшилась на 40 %, перепелов — на 43 %, цесарей — на 41 %, гусаков — на 30 % и у индюков — на 44 % (рис. 2).
Цикл замораживания и оттаивания отрицательно влиял не только на актив- ность, но и на долю живых сперматозоидов. У петухов этот показатель снизился с 89,2 до 47,6 %, у перепелов — с 92,5 до 48,7 %, у цесарей — с 91,6 до 45,2 %, у гусаков — с 76,5 до 38,2 %, у индюков — с 87,2 до 48,5 %.
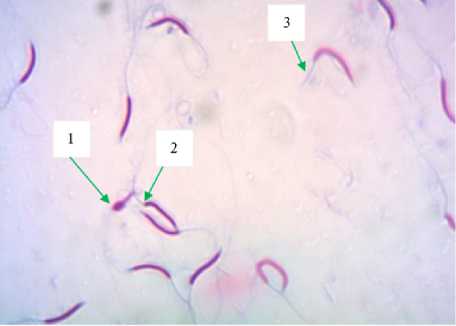
Рис. 3. Патология головки (1) , шейки (2) и жгутика (3) у сперматозоидов цесаря (окрашивание эозином).
дов с патологией головки, среднего отдела
В результате замораживания-оттаивания увеличилась доля сперматозоидов с аномальной морфологией (рис. 3). Наблюдалось изменение в частоте встречаемости аномалий в отдельных сегментах, увеличилось количество сперматозоидов с патологией жгутика (табл. 2). Так, у петухов в заморо-жено-оттаянных образцах по сравнению с показателями, установленными для свеже-полученного эякулята, увеличилась доля сперматозои-и жгутика соответственно на
0,4, 0,4 и 1,3 % (р ≤ 0,001). Аналогичная тенденция отмечалась и у других видов сельскохозяйственной птицы.
2. Доля (%) сперматозоидов с аномальной морфологией в свежеполученном (СПС) и семени и в образцах после замороживания-оттаивания (ЗО) у разных видов сельскохозяйственной птицы
|
Вид |
Область аномалии |
|||||
|
головка |
средняя часть |
жгутик |
||||
|
СПС 1 |
ЗО |
СПС |
1 ЗО |
СПС 1 |
ЗО |
|
|
Петухи |
2,4±0,02 |
2,8±0,03* |
2,6±0,02 |
3,0±0,03* |
4,2±0,03 |
5,5±0,03* |
|
Перепела |
2,5±0,01 |
2,8±0,05* |
2,3±0,03 |
3,1±0,02* |
4,8±0,03 |
5,8±0,03* |
|
Цесари |
3,6±0,01 |
3,9±0,01* |
3,7±0,02 |
4,6±0,03* |
6,2±0,08 |
8,9±0,03* |
|
Гусаки |
4,8±0,02 |
5,2±0,06* |
3,9±0,03 |
4,2±0,01* |
5,9±0,02 |
7,4±0,02* |
|
Индюки |
4,3±0,02 |
4,9±0,02* |
3,3±0,05 |
3,9±0,02* |
4,6±0,03 |
5,8±0,04* |
|
* Различия между средними значениями для СПС и ЗО статистически значимы при р ≤ 0,001. |
||||||
Цикл замораживания-оттаивания существенно изменяет биологические параметры спермиев, на которые влияют многие факторы. В ряде исследований подтверждена зависимость криоустойчивости сперматозоидов сельскохозяйственных птиц от видовых особенностей (например, по криоустойчивости сперматозоидов цесари и гуси уступают другим видам) (30, 31). При общности строения сперматозоидов ряд свойства, от которых зависит биологическая полноценность спермиев, видоспецифичны. Так, видоспецифичны различия в клеточных субфракциях сперматозоидов, длине, количестве митохондрий, в жгутиковых фиброзных оболочках и метаболических возможностях. Поэтому технологии криоконсервации, успешно используемые для одного вида, неприемлемы для других. Сперматозоиды цесаря и петуха по морфологическим и морфометрическим показателям имеют много сходств, но различаются по биохимическому составу (по соотношению холестерина и фосфолипидов), это отражается на биофизических свойствах мембраны. Мембраны сперматозоида цесаря по сравнению со сперматозоидом петуха жесткие, следовательно, по криоустойчивости уступают последним. При криоконсервации спермы цесаря по технологии, используемой для спермы петуха, коэффициент фертильности составляет всего 15 %. На биологическую полноценность сперматозоидов влияние методы расфасовки (в гранулах или паетах), скорость замораживания, оттаивания.
Доля сперматозоидов с анормальной морфологией зависит от видовых особенностей, используемых разбавителей и срока хранения. Уль-траструктурные исследования подтверждают высокую корреляцию активности сперматозоидов с ультраструктурными повреждениями в жгутике и средней части спермия, от которых зависит кинематика сперматозоидов (32). Полученные нами данные световой микроскопии о нарушениях морфологии средней части и жгутика, а также о снижении активности после замораживания-оттаивания косвенно указывают на накопление в средней части и жгутике сперматозоидов ультраструктурных повреждений.
Таким образом, в процессе криоконсервации семени, полученного от самцов сельскохозяйственной птицы разных видов, ухудшается биологическая полноценность сперматозоидов вследствие снижения их активности. Эквилибрация семени перед криоконсервацией приводила к снижению доли живых сперматозоидов у всех видов сельскохозяйственной птицы. При этом доля половых клеток с аномальной морфологией возрастала. В процессе замораживания-оттаивания эти показатели значительно увеличивались. По сравнению со свежеполученной спермы содержание живых сперматозоидов после замораживания-оттаивания в эякулятах петухов снизилось на 41,6 % при увеличении содержания сперматозоидов с аномальной морфологией на 22,0 %. У перепелов и цесарей значения этих показателей составили соответственно 43,8 и 21,8 %; 49,1 и 28,8 %. Наиболее выраженные нарушения в морфологии сперматозоидов отмечались в области жгутика.
Список литературы Изменение биологических параметров семени сельскохозяйственной птицы при криоконсервации
- Тарасова Н.В., Чернякевич Л.М. Тенденции развития птицеводства в трансформацион-ной экономике. Современные проблемы науки и образования, 2013, 4. Режим доступа: https://www.science-education.ru/ru/article/view?id=9934. Дата обращения 10.09.2018.
- FAOSTAT. Livestock Primary. Режим доступа: http://www.fao.org/faostat/ru/#data/QL. Дата обращения 10.09.2018.
- Mottet A., Tempio G. Global poultry production: current state and future outlook and challenges. World Poultry Sci. J., 2017, 73(2): 245-256 ( ) DOI: 10.1017/S0043933917000071
- Vetrivel S.C., Chandrakumarmangalam S. The role of poultry industry in Indian economy. Braz. J. Poult. Sci., 2013, 4(15): 287-293 ( ) DOI: 10.1590/S1516-635X2013000400001
- Lucy M.C. Reproductive loss in high-producing dairy cattle: where will it end? J. Dairy Sci., 2001, 84(6): 1277-1293 ( ) DOI: 10.3168/jds.S0022-0302(01)70158-0
- Багиров В.А., Иолчиев Б.С., Волкова Н.А., Зиновьева Н.А. Влияние криоконсервации на биологические параметры семени у гибридов романовской породы и архара. Сельскохозяйственная биология, 2017, 52(2): 268-273 ( )
- DOI: 10.15389/agrobiology.2017.2.268rus
- Andrabi S.M.H., Maxwell W.M.C. A review on reproductive biotechnologies for conservation of endangered mammalian species. Anim. Reprod. Sci., 2007, 99(3-4): 223-243 ( )
- DOI: 10.1016/j.anireprosci.2006.07.002
- Boettcher P.J., Akin O. Current arrangements for national and regional conservation of animal genetic resources. Animal Genetic Resources, 2010, 47: 73-83 ( )
- DOI: 10.1017/S2078633610000949
- Мальцев А.Б., Дымков А.Б. Использование криоконсервированной спермы петухов в селекции. Доклады Российской академии сельскохозяйственных наук, 2008, 2: 50-52.
- Курбатов А.Д., Царенко Р.Г., Мавродина Т.Г. Влияние сверхнизких температур на сохранение качества спермы отдельных гусаков. Бюл. науч. работ ВНИИРГЖ, 1979, вып. 9: 35-39.
- Blesbois E., Grasseau I., Seigneurin F. Membrane fluidity and the ability to survive cryopreservation in domestic bird spermatozoa. Reproduction, 2005, 129(3): 371-378 ( )
- DOI: 10.1530/rep.1.00454
- Varadi E., Vegi B., Liptoi K., Barna J. Methods for cryopreservation of guinea fowl sperm. PLoS ONE, 2013, 8(4): e62759 ( )
- DOI: 10.1371/journal.pone.0062759
- Blanco J.M., Gee G., Wildt D.E., Donoghue A.M. Species variation in osmotic, cryprotectant, and cooling rate tolerance in poultry, eagle, and falcon spermatozoa. Biol. Reprod., 2000, 63(4): 1164-1171.
- Blesbois E., Brillard J.P. Specific features of in vivo and in vitro sperm storage in birds. Animal, 2007, 1(10): 1472-1481 ( )
- DOI: 10.1017/S175173110700081X
- Целютин К.В. Влияние методов криоконсервации спермы петухов на ее оплодотворяю-щую способность. В сб. науч. тр.: Теория и практика селекции яичных и мясных кур. СПб-Пушкин, 2002: 48-55.
- Тур Б.К., Мавродина Т.Г., Клющинская Г.И. Прогнозирование оплодотворяющей способности криоконсервированной спермы петухов. В сб. науч. тр.: Теория и практика селекции яичных и мясных кур. СПб-Пушкин, 2002: 76-83.
- Новгородова И.П., Жилинский М.А., Волкова Н.А., Багиров В.А., Зиновьева Н.А. Криоконсервация семени петухов: основные принципы и методические подходы. Птицеводство, 2016, 8: 2-7.
- Santiago-Moreno J., Esteso M.C., Villaverde-Morcillo S., Toledano-Déaz A., Castaño C., Velázquez R., López-Sebastián A., Goya López A.L., Gimeno Martínez J. Recent advances in bird sperm morphometric analysis and its role in male gamete characterization and reproduction technologies. Asian J. Androl., 2016, 18(6): 882-888 ( )
- DOI: 10.4103/1008-682X.188660
- Amann R., Pickett B. Principles of cryopreservation and a review of stallion spermatozoa. J. Equine Vet. Sci., 1987, 7(3): 145-173 ( )
- DOI: 10.1016/S0737-0806(87)80025-4
- Purdy P.H. A review on goat sperm cryopreservation. Small Ruminant Res., 2006, 63(3): 215-225 ( )
- DOI: 10.1016/j.smallrumres.2005.02.015
- Hammadeh M.E., Askari A.S., Georg T., Rosenbaum P., Schmidt W. Effect of freeze-thawing procedure on chromatin stability, morphological and membrane integrity of human spermatozoa in fertile and subfertile men. Int. J. Androl., 1999, 22(3): 155-162 ( )
- DOI: 10.1046/j.1365-2605.1999.00162.x
- Buhr M.M., Fiser P., Bailey J.L., Curtis E.F. Cryopreservation in different concentrations of glycerol alters boar sperm and their membranes. J. Androl., 2001, 22(6): 961-969 ( )
- DOI: 10.1002/j.1939-4640.2001.tb03436.x
- Chenoweth P.J. Genetic sperm defects. Theriogenology, 2005, 64(3): 457-468 ( )
- DOI: 10.1016/J.theriogenology.2005.05.005
- Seigneurin F., Grasseau I., Chapuis H., Blesbois E. An efficient method of guinea fowl sperm cryopreservation. Poultry Sci., 2013, 92(11): 2988-2996 ( )
- DOI: 10.3382/ps.2013-03166
- Hudson G.H., Omprakash A.V., Premavalli K. Effect of semen diluents, dilution rates and storage periods on live and abnormal spermatozoa of pearl guinea fowls. Asian Journal of Animal and Veterinary Advances, 2016, 11(7): 411-416 ( )
- DOI: 10.3923/ajava.2016.411.416
- Lukasewicz E., Chrzanowska M., Jerysz A., Chelmonska B. Attempts on freezing the Greylag (Anser anser L.) gander semen. Anim. Reprod. Sci., 2004, 80(1-2): 163-173 ( )
- DOI: 10.1016/S0378-4320(03)00119-2
- Seigneurin F., Grasseau I., Chapuis H., Blesbois E. An efficient method of guinea fowl sperm cryopreservation. J. Poultry Sci., 2013, 92(11): 2988-2996 ( )
- DOI: 10.3382/ps.2013-03166
- Alvarenga M.A., Landim-Alvarenga F.C., Moreira R.M., Cesarino M.M. Acrosomal ultrastructure of stallion spermatozoa cryopreserved with ethylene glycol using two packaging systems. Equine Veterinary Journal, 2000, 32: 541-545 ( )
- DOI: 10.2746/042516400777584749
- Barbas J.P., Mascarenhas R.D. Cryopreservation of domestic animal sperm cells. Cell Tissue Bank, 2009, 10(1): 49-62 ( )
- DOI: 10.1007/s10561-008-9081-4
- Dumpala P.R., Parker H.M., McDaniel C.D. The effect of semen storage temperature and diluent type on the sperm quality index of broiler breeder semen. International Journal of Poultry Science, 2006, 5(9): 838-845 ( )
- DOI: 10.3923/ijps.2006.838.845
- Siudzinska A., Lukaszewicz E. Effect of semen extenders and storage time on sperm morphology of four chicken breeds. Journal of Applied Poultry Research, 2008.17(1): 101-108 ( )
- DOI: 10.3382/japr.2007-00048
- Visco V., Raffa S., Elia J., Delfino M., Imbrogno N., Torrisi M.R., Mazzilli F. Morphological sperm defects analyzed by light microscopy and transmission electron microscopy and their correlation with sperm motility. International Journal of Urology, 2010, 17(3): 259-266 ( )
- DOI: 10.1111/j.1442-2042.2010.02451.x


