Изменение биологических свойств бактерий Staphylococcus epidermidis 33 при формировании устойчивости к ванкомицину
Автор: Кононова Людмила Ивановна, Коробов Владимир Павлович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 5-3 т.13, 2011 года.
Бесплатный доступ
Рассмотрены некоторые биологические особенности коагулазонегативных стафилококков при формировании их устойчивости к гликопептидному антибиотику ванкомицину. Обнаружено, что селекционированный штамм Staphylococcus epidermidis 33 Vanr характеризуется снижением накопления биомассы при культивировании на богатой питательной среде, появлением множественной устойчивости к антибиотикам, значительным снижением гидрофобности клеточной поверхности, накоплением фосфолипидов в клеточных мембранах и снижением чувствительности к катионному пептиду варнерину.
Коагулазонегативные стафилококки, ванкомицин, резистентность, варнерин
Короткий адрес: https://sciup.org/148200431
IDR: 148200431 | УДК: 579.22
Текст научной статьи Изменение биологических свойств бактерий Staphylococcus epidermidis 33 при формировании устойчивости к ванкомицину
Использование гликопептидного антибиотика ванкомицина (Van) для лечения заболеваний, вызванных грамположительными микроорганизмами, введено в практику в 1958 г. и, несмотря на появление резистентных к этому антибиотику штаммов Staphylococcus epidermidis [21], а затем устойчивых к Van энтерококков [17] и золотистых стафилококков [12], он продолжает оставаться препаратом выбора для лечения инфекций, обусловленных мети-циллинрезистентными S. aureus [13], метициллин-резистентными коагулазонегативными стафилококками (КНС) [22], а также энтерококками, устойчивыми к бета-лактамным антибиотикам и аминогликозидам [1, 14].
Устойчивые к Van бактерии обладают выраженными биологическими особенностями. В частности, для штаммов S. aureus со сниженной чувствительностью к этому гликопептиду характерно существенное утолщение клеточной стенки и формирование новых мишеней действия, локализованных вдали от истинных мишеней антибиотика на плазматической мембране [9, 11]. Обнаружена также реципиентность этими штаммами детерминант резистентности к гликопептидам от энтерококков, обуславливающая возрастание уровня устойчивости стафилококков к Van до характерного для энтерококков [6, 7]. Вместе с тем, механизмы формирования устойчивости КНС к гликопептидам практически не изучены [8]. Показано лишь, что резистентные к Van КНС отличаются по некоторым свойствам от чувствительных бактерий, в частности, изменению клеточной стенки, появлению множественной устойчивости к антибактериальным препаратам, характеру сорбции антибиотика из среды культивирования. Обнаружено также, что природа устойчивости КНС к Van является гетерогенной [8], что характерно и для другого вида стафилококков – S. aureus . Для некоторых изолятов КНС, как и для S. aureus , выявлена способность к образованию биопленок в присутствии гликопептидов [10].
Несмотря на то, что штаммы КНС менее патогенны, чем штаммы S. aureus , они часто являются источником ассоциированной инфекции, а также заражения медицинских имплантатов [18]. Представленное отражает необходимость дополнительных исследований природы устойчивости КНС к Van и поиска путей ее преодоления.
В связи с этим в настоящей работе исследованы изменения физиологических характеристик коллекционного штамма S. epidermidis 33 при культивировании его на средах с возрастающими концентрациями Van с получением устойчивого к этому антибиотику варианта – S.epidermidis 33 Vanr, с оценкой чувствительности мутантного штамма к низкомолекулярному катионному пептиду варне-рину.
МАТЕРИАЛ И МЕТОДЫ
Выращивание бактерий проводили в питательной среде LB [4] на орбитальном шейкере Certomat (“Sartorius”, Германия) при 150 об/мин и температуре 370C. За динамикой роста следили по изменению оптической плотности бактериальных культур при 600 нм на спектрофотометре PD-303 (“APEL”, Япония).
Получение ванкомицинустойчивого штамма S. epidermidis 33 Vanr проведено последовательными пересевами исходного чувствительного к Van штамма S. pidermidis 33 на среду LB c повышающимися концентрациями Van. Селекцию начинали с концентрации Van в жидкой среде, близкой минимальной подавляющей концентрации (МПК) Van для данного штамма. Клеточные суспензии затем высевали на чашки с LB-агаром с той же концентрацией Van. После появления колоний их инокулировали в жидкую среду с повышенной концентрацией Van и культивировали до видимого роста. Таким образом, через 16 пассажей на жидкой среде бактерии были способны к росту в присутствии 32 мкг/мл Van.
МПК Van изучаемых штаммов определяли методом двукратных серийных разведений в 96-луночных иммунологических планшетах. В лунки, содержащие питательную среду LB, вносили бак- терии логарифмической фазы роста в конечной концентрации 105 колониеобразующих единиц/мл (КОЕ/мл). Определение чувствительности бактерий к низкомолекулярному пептиду варнерину проводили, как представлено ранее [3, 16]. Чувствительность к антибиотикам выявляли методом диффузии с дисков [5].
Степень сохранности устойчивости резистентного штамма к Van оценивали после 20 последовательных пассажей на питательной среде LB без антибиотика методом двукратных серийных разведений в иммунологических планшетах. Степень гидрофобности поверхности бактериальных клеток определи с помощью BATH-теста в двухфазной системе с гексадеканом [20].
Экстракцию и идентификацию липидов проводили по методу Блайя и Дайера [2]. Для тонкослойной хроматографии использовали пластинки Sorbfil (Россия) (сорбент – силикагель, толщина слоя 110 мкм). Разделение смеси липидов проводили в системе: хлороформ-метанол-вода (65:25:4, v/v). После разделения липидов пластинки окрашивали 10% фосфорномолибденовой кислотой в этаноле для определения общего состава липидов, 1% нингидрином в ацетоне – липидов, содержащих свободные аминогруппы, реактивом Цинцаде – фосфолипидов, α-нафтолом – гликолипидов [2].
Аутолиз исследуемых штаммов проводили в 10 mM трис HCl-буфере, pH 7.2 при 370C в течение 4 ч с перемешиванием при 150 об/мин на шейкере Cer-tomat (“Sartorius”, Германия). Для этого бактериальные культуры выращивали на среде LB до середины логарифмической фазы роста. Клетки осаждали центрифугированием (13200 об/мин, 10 мин) на центрифуге 3К30 (“Sigma”, Германия), дважды отмывали в том же режиме исходным указанным выше буфере и ресуспендировали в нем до плотности ~1.0 при 600 нм. Для активации аутолитических процессов к препаратам бактерий добавляли низкомолекулярный пептид варнерин в концентрации 1 мг/мл. Степень лизиса определяли по изменению оптической плотности клеточных суспензий при 600 нм и по количеству живых клеток постановкой теста на КОЕ, отбирая пробы ежечасно.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Обнаружено, что селекционированный в лаборатории Vanr-штамм обладал высоким уровнем устойчивости к ванкомицину (МПК ≥400 мкг/мл). Формирование Vanr-фенотипа производного штамма сопровождалось снижением интенсивности роста по сравнению с чувствительным штаммом. Сравнение динамики роста изученных штаммов представлено на рис. 1.
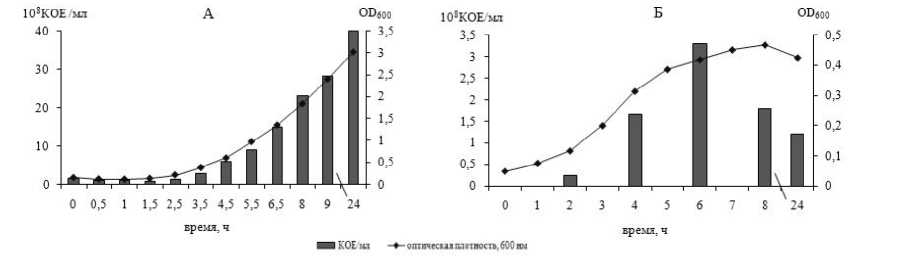
Рис. 1. Динамика роста (А) S.epidermidis 33 и (Б) S.epidermidis 33 Vanr
Важно отметить, что возрастание резистентности к Van сопровождается появлением устойчивости и к ряду других антибиотиков, обладающих различными механизмами антибактериального
Таблица. Фенотипическая резистентность исследованных штаммов
действия. Характеристика чувствительности к антибиотикам исследованных штаммов представлена в таблице.
|
Штаммы |
Антибиотики |
|||||||||||
|
Бен |
Ген |
Цеф |
Тет |
Лин |
Окс |
Риф |
Эр |
Фуз |
Лев |
Ван |
Цип |
|
|
S.epidermisis 33 |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
|
S.epidermisis 33 Vanr |
У |
Ч |
Ч |
П |
У |
У |
П |
Ч |
У |
Ч |
У |
Ч |
Прим. Обозначения устойчивости к антибиотикам: У – устойчивый, П – промежуточный, Ч – чувствительный. Антибиотики: Бен – бензилпенициллин, Ген – гентамицин, Цеф – цефалексин, Тет – тетрациклин, Лин – линкомицин, Окс – оксациллин, Риф – рифампицин, Эр – эритромицин, Фуз – фузидин, Лев – левомицетин, Ван – ванкомицин, Цип – ципрофлоксацин
Большинство известных изолятов стафилококков, гетерорезистентных к Van, являются одновременно метициллин- или оксациллинрезистентны-ми, таким образом, устойчивость к Van часто связана с устойчивостью к оксациллину. Возможно, устойчивость к Van обусловлена изменениями в метаболизме клеточных стенок, что в свою очередь влияет на активность бета-лактамных антибиотиков. Экспрессия Vanr-фенотипа стафилококков не ограничивается резистентностью только к бета- лактамам, так как все они обладают различными уровнями резистентности ко многим антибиотикам [19].
После 20 последовательных пассажей на питательной среде без антибиотика Vanr-штамм сохранял высокий уровень устойчивости к Van и оставался устойчивым и к другим антибиотикам. Важно отметить, что исследования других авторов указывают на специфические особенности работы с резистентными штаммами стафилококков из-за ревертирования ванкомицинчувствительного фенотипа многих изолятов [13].
Как показало исследование поверхности клеток методом бактериальной адгезии к углеводородам, штамм S.epidermidis 33 обладает гидрофобной поверхностью. Показатель гидрофобности его поверхности составляет 45±10 %, в то же время поверхность Vanr-штамма менее гидрофобна и составляет лишь 11±4 %.
Анализ липидов клеточных мембран изучаемых штаммов выявил значительные различия в их качественном и количественном составе. Как показано на рис. 2, развитие резистентности к Van сопровождается увеличением относительного количества кардиолипина и фосфатидилглицерина в составе липидов мутантного штамма с одновременным снижением количества гликолипидов. Следует отметить появление лизилфосфатидилглицерина и лизоформ фосфолипидов, отсутствующих в составе липидов исходного штамма S.epidermidis 33. Накопление кардиолипина в клетках резистентного штамма, возможно, являясь результатом адаптации к стрессовым условиям, компенсирует нарушение жесткости клеточной стенки и ингибирует аутолиз клеток [15], а появление лизилфосфатидилглице-рина вызывает изменение заряда клеточных поверхностей, приводя к накоплению положительных зарядов на цитоплазматической мембране, что в свою очередь снижает чувствительность производного штамма к катионному пептиду варнерину. Определение МПК низкомолекулярного пептида варнерина показало возрастание устойчивости Vanr-штамма к данному антибактериальному пре- мкг/мл, что значительно превышает МПК варнери-на родительского штамма S.epidermidis 33, равную 0,25 мкг/мл.
Рис. 2. Тонкослойная хроматография полярных липи-

дов S.epidermidis 33 и S.epidermidis 33 Vanr.
Прим.: 1 – S.epidermidis 33, 2 – S.epidermidis 33 Vanr; I – моноглюкозилдиглицерид, II – кардиолипин, III – диглюкозилдиглицерид, IV - фосфатидилглицерин, V – лизилфосфа-тидилглицерин, VI – лизоформы фосфолипидов
Лизис клеток S.epidermidis 33 и S.epidermidis 33 Vanr под действием варнерина в концентрации 1 мг/мл в трис HCl-буфере, pH 7.2 в течение 4 ч показал более медленное снижение оптической плотности и количества жизнеспособных клеток в суспензии мутантного штамма (рис. 3), но несмотря на это, суспензии обоих штаммов через 24 ч не содержали живых клеток.
Таким образом, возникновение устойчивости штамма S.epidermidis 33 к Van вызвает изменение важных физиологических свойств данного микроорганизма. При этом снижение чувствительности к низкомолекулярному катионному пептиду варне-рину, возможно, происходит вследствие изменения уровня гидрофобности бактериальной поверхности, а также вследствие адаптивного накопления полярных липидов клеток.
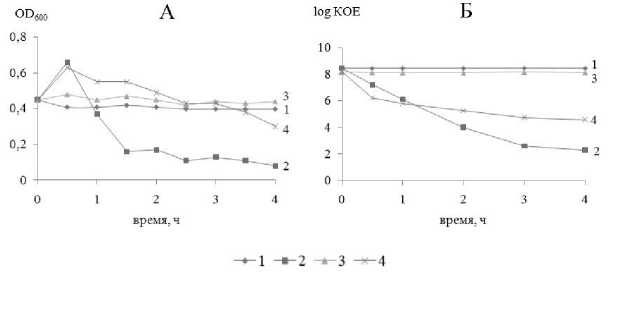
парату – МПК варнерина для него составляет ≥8
Рис. 3. Изменение оптической плотности (А) и КОЕ (Б) клеточных суспензий S.epidermidis 33 и S.epidermidis 33 Vanr под действием катионного пептида варнерина. Прим.: 1 – инкубация S.epidermidis 33 в трис-буфере, 2 – инкубация S.epidermidis
33 в присутствии варнерина в трис-буфере, 3 – инкубация S.epidermidis 33 Vanr в трис-буфере, 4 – инкубация S.epidermidis
33 Vanr в присутствии варнерина в трис-буфере
Список литературы Изменение биологических свойств бактерий Staphylococcus epidermidis 33 при формировании устойчивости к ванкомицину
- Зайцев А.А., Карпов О.И, Сидоренко С.В. Стафилококки и ванкомицин: тенденции противостояния//Антибиотики и химиотерапия. 2003. Т. 48. № 6. С. 20-26.
- Кейтс М. Техника липидологии. М.: Мир, 1975. 322с.
- Коробов В.П., Полюдова Т.В., Филатова Л.Б. и др. Активация аутолитической активности бактерий Staphylococcus epidermidis 33 низкомолекулярным катионным пептидом варнерином//Микробиология. 2010. Т. 79. № 1. С. 133-135.
- Миллер Д. Эксперименты в молекулярной генетике. М.: Мир, 1976. 394 с.
- Скала Л.З., Сидоренко С.В., Нехорошева А.Г. и др. Практические аспекты современной клинической микробиологии. М., 2004. 312 с.
- Al-Obeid S., Collatz E., Gutmann I. Mechanism of resistance to Vancomycin in Enterococcus faecium D366 and Enterococcus faecalis A256//Antimicrob. Agents Chemother. 1990. V. 34. № 2. P. 252-256.
- Arthur M., Courvalin P. Genetics and mechanisms of glycopeptide resistance in enterococci//Antimicrob. Agents Chemother. 1993. V. 37. № 8. P. 1563-1571.
- Biavasco F., Vignaroli C., Varaldo P.E. Glycopeptide resistance in coagulase-negative staphylococci//Europ. J. Clin. Microbiol. Infect. Dis. 2000. V. 19. № 6. P. 403-417.
- Cui L., Ma X., Sato K. et al. Cell wall thickening is common feature of vancomycin resistance in Staphylococcus aureus.//J. Clin. Microbiol. 2003. V. 41. № 1. P. 5-14.
- Gazolla S., Cocconcelli P.S. Vancomycin heteroresistance and biofilm formation in Staphylococcus epidermidis from food//Microbiology. 2008. V. 154. № 10. P. 3224-3231.
- Hanaki H., Kuwahara-Arai K., Boyle-Vavra S. et al. Activated cell-wall synthesis is associated with vancomycin resistance in methicillin-resistant Staphylococcus aureus clinical strains Mu3 and Mu50//J. Antimicrob. Chemother. 1998. V. 42. № 2. P. 199-209.
- Hiramatsu K., Aritaka N., Hanaki H. et al. Dissimination in Yapanese hospitals of strains Staphylococcus aureus hetero-geneously resistant to vancomycin//Lancet. 1997. V. 350. № 9092. P. 1670-1673.
- Howden B.P., Davies J.K., Johnson P.D.R. Reduced vancomycin susceptibility in Staphylococcus aureus, including vancomycin-intermediate and heterogeneous vancomycin-intermediate strains: resistance mechanisms, laboratory detection and clinical implications//Clin. Microbiol. Rev. 2010. V. 23. № 1. P. 99-138.
- Huyck M.M., Sahm D.F., Gilmore M.S. Multiple-drug resistant enterococci: The nature of the problem and an agenda for the future//Emerg. Infect. Dis. 1998. V. 4. №. 2. P. 239-249.
- Kariyama R. Increase of cardiolipin content in Staphylococcus aureus by the use of antibiotics affecting the cell wall//J. Antibiot. 1982. V. 35. № 12. P. 1700-1704.
- Korobov V.P., Lemkina L.M., Polyudova T.V. Production of a wide-spectrum antibacterial factor by Staphylococcus warneri cells//Docl. Biol. Sci. 2003. V. 390. P. 286-288.
- Leclercq R., Derlot E., Duval J., Courvalin P. Plasmidmediated resistance to vancomycin and teicoplanin in Enterococcus faecium//New Eng. J. Med. 1988. V. 319. № 3. P. 157-161.
- Livermore D.M. Antibiotic resistance in staphylococci//Intern. J. Antimicrob. Agents. 2000. V. 16. № 1. P. 3-10.
- Palazzo I.C.V., Araujo M.L.C., Darini A.L.C. First report of vancomycin-resistant staphylococci isolated from healthy carriers in Brazil//J. Clin. Microbiol. 2005. V.43. № 1. P. 179-185.
- Rosenberg M., Gutnick D., Rosenberg E. Adherence of bacteria to hydrocarbons: a simple method for measuring cell-surface hydrophobicity//FEMS Microbiol. Lett. 1980. V. 9. № 1. P. 29-33.
- Siebert W.T., Moreland N., Williams T.W.,Jr. Synergy of vancomycin plus cefazolin or cephalotin against methicillin-resistance Staphylococcus epidermidis//J. Infect. Dis. 1979. V. 139. № 4. P. 452-457.
- Sieradzki K., Roberts R.B., Serur D. et al. Heterogenously vancomycin-resistant Staphylococcus epidermidis strain causing recurrent peritonitis in a dialysis patient during vancomycin therapy//J. Clin. Microbiol. 1999. V. 37. № 1. P. 39-44.


