Изменение динамики активности аспартат и аланинаминотрансфераз при прорастании семян ячменя (Hordeum vulgare L.)
Автор: Оруджова Т.Я., Мамедзаде Н.Г.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Биологические науки
Статья в выпуске: 11 т.9, 2023 года.
Бесплатный доступ
Прорастание семян - важнейший этап в жизненном цикле растения. Во время прорастания семян активизируются различные метаболические процессы, обеспечивающие рост проростков и происходят важные физиологические и биохимические изменения. Изучена динамика изменения активности ферментов аспартат- и аланинаминотрансфераз в процессе прорастания в зерне двух генотипов ячменя (Hordeum vulgare L.). Установлено, что постепенное увеличение активности фермента наблюдается в зерне через несколько часов после начала процесса прорастания.
Ячмень, прорастание семян, аминотрансферазы
Короткий адрес: https://sciup.org/14129259
IDR: 14129259 | УДК: 577.1 | DOI: 10.33619/2414-2948/96/02
Текст научной статьи Изменение динамики активности аспартат и аланинаминотрансфераз при прорастании семян ячменя (Hordeum vulgare L.)
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 577.1
Прорастание сложный признак, на который влияет множество генетических, эндогенных и экологических факторов [1]. Прорастание обусловлено множеством клеточных процессов, включая активацию клеточного цикла. Все эти процессы поддерживаются запуском центрального метаболизма для получения энергии и производства строительных веществ [2].
Семена растений содержат высокую концентрацию запасов питательных веществ, которые служат источником сырья для роста проростка. Аминокислоты частично присутствуют в свободном виде в не проросших семенах. Они в основном образуются в результате протеолиза во время прорастания, при котором запасы белка гидролизуются для получения питательных веществ для молодого проростка. В процессе прорастания происходит значительное взаимопревращение аминокислот, обусловленное метаболическими событиями, требованиями транспортной системы и различиями между аминокислотным составом резервных белков по сравнению с новыми цитоплазматическими белками [3]. Поэтому трансаминирование, вероятно, участвует в начальном метаболизме свободных аминокислот. Показано, что существует несколько аминотрансфераз, которые используют широкий спектр амино- и кетокислот [4]. Среди них известны аспартат (АcАТ) и аланин аминотрансферазы (АлАТ).
Аланин аминотрансфераза (АлАТ, КФ 2.6.1.2) катализирует обратимую реакцию превращения аланина и 2-оксоглутарата в пируват и глутамат. Этот пиридоксальфосфат-зависимый фермент играет ключевую роль в метаболизме растений, связывая первичный углеродный обмен с синтезом аминокислот [5, 6].
Аспартат аминотрансфераза (АcАТ, КФ 2.6.1.1) катализирует обратимую реакцию трансаминирования между L-аспартатом и 2-оксоглутаратом с образованием оксалоацетата и L-глутамата [4, 7].
Ячмень ( Hordeum vulgare L.) — важная зерновая, продовольственная и кормовая культура занимающая четвертое место в мировом производстве среди зерновых культур после кукурузы, риса и пшеницы, выращивается во всем мире, в самых разных условиях [8– 10].
Аспартат- и аланин-аминотрансферазы играют важную роль в метаболизме прорастающего зерна ячменя, и их активность тесно связана с биохимическими изменениями, происходящими в процессе прорастания. В целом изучение динамики активности этих ферментов в прорастающем зерне является важным направлением исследований, позволяющим понять метаболические пути и механизмы регуляции, управляющие прорастанием зерна ячменя.
Материалы и методы исследования
Для исследования были отобраны два сорта ячменя хранящихся в генофонде НИИСХ Минсельхоза: «Даянатли» и «Бахарлы». Семена инкубировали на фильтровальной бумаге в чашках Петри при температуре 22±3 °С. Семена ячменя гомогенизировали в растворе 1:4, содержащем 100 мМ, Трис-HCl (рН 7,8), 10 мМ MgCl 2 , 1 мМ ЭДТА, 10 мМ 2-меркаптоэтанола и 1% поливинилпирролидона. Гомогенат центрифугировали при 12000 g в течение 10 мин. Надосадочную жидкость использовали для определения активности ферментов.
Активность ферментов определяли спектрофотометрически, по методике, Альфонсо и Брюггеману [11], с небольшими изменениями. Для определения активности аспартатаминотрансферазы реакционная среда состояла из 100 мМ Трис-HCl (pH 7,8), 2 мМ ЭДТА, 2,5 мМ 2-оксоглутарата, 10 мкг/мл пиридоксальфосфата, 10 мМ ДТТ, 12 U/мл малатдегидрогеназы, 0,2 мМ НАДН. Реакцию начинали добавлением в среду 2,5 мМ L-аспартата. Для активности аланинаминотрансферазы малатдегидрогеназу заменяли лактатдегидрогеназой и реакцию начинали добавлением в среду 10 мМ L-аланина [11]. Количество белка определяли по методу Брэдфорда [12].
Все эксперименты были выполнены в 3-x повторностях и погрешности определяли с использованием программы статистического анализа Student’s t-test. Различия между средними значениями считались достоверными при значениях Р <0,01, 0,005.
Результаты и обсуждение
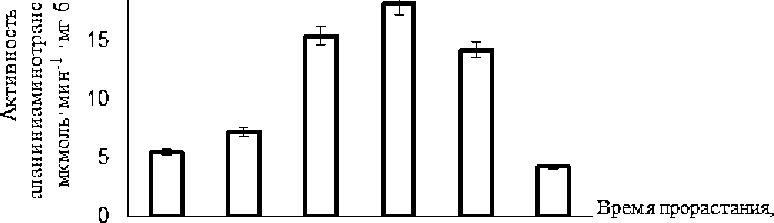
Активность аланинаминотрансферазы на 4-м часе прорастания у сорта Бахарлы составила 5,49 мкмоль×мин-1×мг белок-1. На 12-м часе активность фермента увеличилась в 1,3 раза по сравнению с 4 часом, а на 24-м часе — в 2,8 раза. Наибольшая активность фермента наблюдалась на 2 сутки (18,21 мкмоль×мин-1×мг белок-1). Постепенное снижение активности фермента наблюдалось на 4 и 6 сутки (Рисунок 1).
-Ен ID
4 12 24 48 96 144
Рисунок 1. Динамика активности аланин аминотрансферазы у сорта ячменя Бахарлы в процессе прорастания семян
У сорта Даянатли активность фермента на 4-м часе прорастания составила 3,787 мкмоль×мин-1×мг белок-1. По сравнению с этим активность фермента была в 1,64 раза выше на 12-й час, в 5,2 раза выше на 24-й час и в 4,83 раза выше на 2-й день прорастания. На 4-е и 6-е сутки активность фермента составила 14,40 и 3,52 мкмоль×мин-1×мг белок-1 соответственно. Результаты показывают, что активность фермента аланинаминотрансферазы была выше у сорта Даянатли на 24-м часу (Рисунок 2).
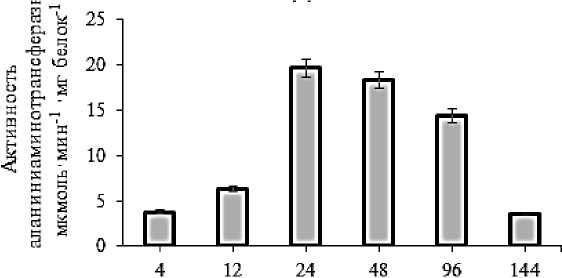
Рисунок 2.
Динамика активности аланин аминотрансферазы
Время прорастания, часы
у сорта ячменя Даянатли в процессе прорастания семян
Динамика изменения активности фермента АсАТ показала, что фермент проявлял более высокую активность у обоих сортов ячменя по сравнению с аланинаминотрансферазой.
Активность фермента у сорта Бахарлы на 4-м часе прорастания составила 15,92 мкмоль×мин-1×мг белок-1. Активность фермента была в 1,14 раза выше через 12 часов, чем через 4 часа, в 1,47 раза выше через 24 часа и в 1,39 раза выше через 48 часов. На 96-м и 144-м часу активность фермента составила 16,26 мкмоль×мин-1×мг белок-1 и 7,52 мкмоль×мин-1×мг белок-1соответственно.
Активность фермента аспартатаминотрансферазы составила 18,68 мкмоль×мин-1×мг белок-1 на 4-м часе прорастания у сорта Даянетли. На 12-м часе активность фермента была выше в 2,3, на 24-м часе — в 2,52, на 48-м часе — в 2,05, на 96-м часе — в 1,19 раза чем на 4м часе. К концу исследуемого периода активность фермента начала постепенно снижаться (13,52 мкмоль×мин-1×мг белок-1). На основании полученных результатов сравнение сортов Бахарли и Даянатли показало, что оба фермента проявили более высокую активность у сорта Даянатли. Активность фермента аспартатаминотрансферазы была выше у обоих сортов по сравнению с аланинаминотрансферазой (Рисунок 3, 4).
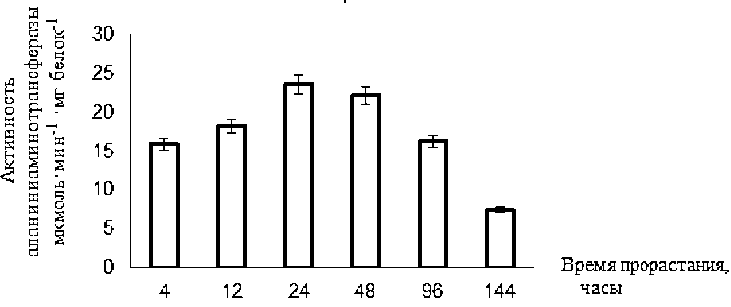
Динамика активности аспартат аминотрансферазы у
Рисунок 3.
сорта ячменя Бахарлы в
процессе прорастания семян
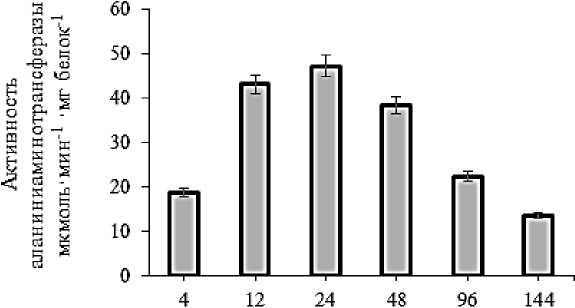
Время прорастания, часы
Рисунок 4. Динамика активности аспартат аминотрансферазы у сорта ячменя Даянатли в процессе прорастания семян
В ряде исследований было показано, что аминокислоты могут служить альтернативным субстратом для производства энергии в прорастающих семенах [13–15]. Пулы свободных аминокислот накапливаются в сухих семенах для использования в первые часы после прорастания. Во время стратификации уровень большинства аминокислот снижается [16]. Во время прорастания зерна ячменя происходят различные физиологические и биохимические изменения, способствующие росту проростков. Эти изменения сопровождаются активацией ряда ферментов, в том числе АсАТ и АлАТ, которые участвуют во взаимопревращении аминокислот. В результате изучения ферментов АсАТ и АлАТ установлено, что активность обоих ферментов в прорастающих зернах ячменя может изменяться в зависимости от различных факторов, таких как стадия прорастания, условия окружающей среды и генетические факторы. Активность обоих ферментов повышается на ранних стадиях прорастания, что указывает на их роль в метаболизме аминокислот для поддержания роста проростков.
Заключение
Согласно полученным результатам АсАТ и АлАТ являются важными ферментами, участвующими в аминокислотном обмене при прорастании зерна ячменя, играя решающую роль во взаимопревращении аминокислот и обеспечивая необходимые биохимические изменения для поддержания роста проростков.
Список литературы Изменение динамики активности аспартат и аланинаминотрансфераз при прорастании семян ячменя (Hordeum vulgare L.)
- Joosen R. V. L., Arends D., Li Y., Willems L. A., Keurentjes J. J., Ligterink W., Hilhorst H. W. Identifying genotype-by-environment interactions in the metabolism of germinating Arabidopsis seeds using generalized genetical genomics // Plant physiology. 2013. V. 162. №2. P. 553-566. https://doi.org/10.1104/pp.113.216176
- Rosental L., Nonogaki H., Fait A. Activation and regulation of primary metabolism during seed germination // Seed science research. 2014. V. 24. №1. P. 1-15. https://doi.org/10.1017/S0960258513000391
- Lea P. J., Joy K. W. Amino acid interconversion in germinating seeds // Mobilization of reserves in germination. Boston, MA: Springer US, 1983. P. 77-109. https://doi.org/10.1007/978-1-4684-1167-6_5
- Isola M. C., Franzoni L. Changes of aspartate aminotransferase activity, its isoform pattern, and free amino acids content in peanut cotyledons during seed germination // Acta Physiologiae Plantarum. 2000. V. 22. P. 125-128. https://doi.org/10.1007/s11738-000-0066-6
- Rocha M., Sodek L., Licausi F., Hameed M. W., Dornelas M. C., Van Dongen J. T. Analysis of alanine aminotransferase in various organs of soybean (Glycine max) and in dependence of different nitrogen fertilisers during hypoxic stress // Amino Acids. 2010. V. 39. P. 1043-1053. https://doi.org/10.1007/s00726-010-0596-1
- Kendziorek M., Paszkowski A., Zagdańska B. Differential regulation of alanine aminotransferase homologues by abiotic stresses in wheat (Triticum aestivum L.) seedlings // Plant cell reports. 2012. V. 31. P. 1105-1117. https://doi.org/10.1007/s00299-012-1231-2
- Schlüter U., Bräutigam A., Droz J. M., Schwender J., Weber A. P. The role of alanine and aspartate aminotransferases in C4 photosynthesis // Plant Biology. 2019. V. 21. P. 64-76. https://doi.org/10.1111/plb.12904
- Newton A. C., Flavell A. J., George T. S., Leat P., Mullholland B., Ramsay L., Bingham I. J. Crops that feed the world 4. Barley: a resilient crop? Strengths and weaknesses in the context of food security // Food security. 2011. V. 3. P. 141-178. https://doi.org/10.1007/s12571-011-0126-3
- Hein J. A., Sherrard M. E., Manfredi K. P., Abebe T. The fifth leaf and spike organs of barley (Hordeum vulgare L.) display different physiological and metabolic responses to drought stress // BMC plant biology. 2016. V. 16. P. 1-12. https://doi.org/10.1186/s12870-016-0922-1
- Dawson I. K., Russell J., Powell W., Steffenson B., Thomas W. T., Waugh R. Barley: a translational model for adaptation to climate change // New Phytologist. 2015. V. 206. №3. P. 913-931. https://doi.org/10.1111/nph.13266
- Alfonso S. U., Brüggemann W. Photosynthetic responses of a C 3 and three C 4 species of the genus Panicum (sl) with different metabolic subtypes to drought stress // Photosynthesis research. 2012. V. 112. P. 175-191. https://doi.org/10.1007/s11120-012-9763-4
- Bradford M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Analytical biochemistry. 1976. V. 72. №1-2. P. 248-254. https://doi.org/10.1016/0003-2697(76)90527-3
- Han M., Zhang C., Suglo P., Sun S., Wang M., Su T. L-Aspartate: An essential metabolite for plant growth and stress acclimation // Molecules. 2021. V. 26. №7. P. 1887. https://doi.org/10.3390/molecules26071887
- Lehmann T., Ratajczak L. The pivotal role of glutamate dehydrogenase (GDH) in the mobilization of N and C from storage material to asparagine in germinating seeds of yellow lupine // Journal of plant physiology. 2008. V. 165. №2. P. 149-158. https://doi.org/10.1016/j.jplph.2006.12.010
- Narsai R., Law S. R., Carrie C., Xu L., Whelan J. In-depth temporal transcriptome profiling reveals a crucial developmental switch with roles for RNA processing and organelle metabolism that are essential for germination in Arabidopsis // Plant physiology. 2011. V. 157. №3. P. 1342-1362. https://doi.org/10.1104/pp.111.183129
- Baud S., Dubreucq B., Miquel M., Rochat C., Lepiniec L. Storage reserve accumulation in Arabidopsis: metabolic and developmental control of seed filling // The Arabidopsis book/American Society of Plant Biologists. 2008. V. 6. https://doi.org/10.1199%2Ftab.0113


