Изменение экспрессии генов в створках нативных клапанов сердца, пораженных инфекционным эндокардитом
Автор: Синицкая А.В., Синицкий М.Ю., Хуторная М.В., Казачек Я.В., Евтушенко А.В., Понасенко А.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.37, 2022 года.
Бесплатный доступ
Цель исследования: оценить вклад генов SOD1, CAT, PXDN1, NOS3, EDN1, VCAM, ICAM, PECAM, SELE и SELP в патогенез инфекционного эндокардита (ИЭ) у пациентов, перенесших кардиохирургическое вмешательство.Материал и методы. Проведено исследование 25 створок нативных клапанов сердца, пораженных ИЭ, и 13 нативных створок, полученных от пациентов с другой клапанной патологией. Уровень экспрессии генов SOD1, CAT, PXDN1, NOS3, EDN1, VCAM, ICAM, PECAM, SELE и SELP определяли методом количественной полимеразной цепной реакции (кПЦР). Иммунофлуоресцентное окрашивание проводили с применением специфических первичных антител к нитротирозину.Результаты. Створки нативных клапанов сердца, пораженных ИЭ, характеризуются сниженной экспрессией генов, вовлеченных в процессы окислительного стресса и генов, кодирующих молекулы клеточной адгезии. Иммунофлуоресцентное окрашивание показало, что в створке клапана, пораженного ИЭ, наблюдалось более низкое окрашивание нитротирозином по сравнению с контрольными образцами клапанов, что свидетельствует о менее выраженном процессе оксидативного стресса.
Патология клапанов сердца, экспрессия, инфекционный эндокардит, иммунофлуоресцентное окрашивание
Короткий адрес: https://sciup.org/149140504
IDR: 149140504 | УДК: 616.126-002-022.7:577.218]-021.6 | DOI: 10.29001/2073-8552-2022-37-2-98-104
Текст научной статьи Изменение экспрессии генов в створках нативных клапанов сердца, пораженных инфекционным эндокардитом
ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ / EXPERIMENTAL INVESTIGATIONS
Инфекционный эндокардит (ИЭ) – заболевание, приводящее к нарушению функции клапанов сердца и занимающее одну из лидирующих позиций среди причин смертности населения. Развитие ИЭ – многофакторный процесс, компоненты которого определяют течение и исход данного заболевания. Несмотря на то, что заболеваемость ИЭ не высока, данное патологическое состояние представляет собой жизнеугрожающее заболевание с высокой степенью развития осложнений [1].
Зачастую развитие ИЭ ассоциировано с бактериальной инфекцией, которая изначально поражает эндокардиальную поверхность сердца. Течение ИЭ зависит от активности воспалительного процесса, патогена, а также от реакции организма пациента [2]. Среди патогенов, поражающих клапанные структуры сердца, в большинстве случаев превалирует золотистый стафилококк, проникающий в эндотелиальные клетки, что впоследствии может приводить к повреждению эндотелиального слоя. Повреждение эндотелия стимулирует образование фи-брин-тромбоцитарных агрегатов, без воспалительного процесса и бактерий. Кроме того, эндокард активно экс- прессирует интегрины, создавая адгезивную поверхность для циркулирующих патогенов [3]. Кроме того, стоит отметить, что эндотелиальные клетки наиболее чувствительны к различным повреждающим факторам, таким как свободные радикалы, воспалительные белки и др.
Молекулярно-генетические исследования развития ИЭ в основном сосредоточены на изучении однонуклеотидных замен. Так, ранее нашей научной группой показано, что полиморфные варианты rs1143634 гена IL1b, rs3212227 гена IL12 и rs1130864 гена CRP обладают про-тективным эффектом в отношении развития ИЭ [4]. Также отмечено, что экспрессия провоспалительных цитокинов более выражена в створках нативных клапанов сердца, пораженных ИЭ, по сравнению с другой клапанной патологией. Ю.С. Бахарева и соавт. в своем исследовании показали значимую роль генов, кодирующих матриксную металлопротеиназу 9 и эндотелиальную синтазу азота, в отношении развития эндокардитов как инфекционной, так и неинфекционной природы [5]. Отмечается, что молекулы межклеточной адгезии, представляющие собой мембранные рецепторы, играют важную роль как в нормальных, так и в патофизиологических процессах, связанных с транспортом и взаимодействием между клетками. Кроме того, C. Golias и соавт. в своем обзоре, опубликованном в 2011 г., предложили идею о том, что молекулы клеточной адгезии играют важную роль в патофизиологии ИЭ [6]. В работах отечественных исследователей установлена роль эндотелиальной дисфункции при инфекционном эндокардите [7]. В одной из наших работ, также показано, что минорный аллель Т полиморфного варианта rs5370 EDN1 ассоциирован с увеличением риска развития ИЭ [8]. Таким образом, на основании литературных данных нами была сформулирована цель исследования, которая заключалась в оценке вклада генов SOD1, CAT, PXDN1, NOS3, EDN1, VCAM, ICAM, PECAM, SELE и SELP в патогенез инфекционного эндокардита у пациентов, перенесших кардиохирургическое вмешательство.
Материал и методы
В исследование включены 25 пациентов (средний возраст – 55 лет) с уточненным диагнозом «инфекционный эндокардит» и 12 пациентов (средний возраст – 62 года) с другой клапанной патологией, проходивших лечение на базе НИИ КПССЗ (Кемерово). Исследование одобрено локальным этическим комитетом НИИ КПССЗ. Все участники подписывали добровольное информированное согласие на участие в исследовании.
Сбор материала и выделение РНК
Для избегания деконтаминации все рабочие поверхности были обработаны раствором для деконтаминации RNaseZapTM RNase Decontamination Solution (Invitrogen, США).
Полученный участок створки клапана лизировали в 900 мкл реагента TRIzol (Invitrogen, США) с последующей гомогенизацией ткани. Выделение РНК осуществляли коммерческим набором компании Qiagen в соответствии с предоставляемым протоколом производителя (Qiagen, кат. номер: 74104, Германия). При помощи спектрофотометра Qubit 4 Fluorometer (Invitrogen, США) определяли целостность выделенной РНК, а также ее количество и качество. Выделенные образцы РНК хранили при температуре –80 °C.
Проведение кПЦР
Синтез комплементарной ДНК (кДНК) проводили при помощи реакции обратной транскрипции коммерческим набором в соответствии с протоколом производителя (Applied Biosystems, кат. номер: 4374967, США). На спектрофотометре NanoDropTM 2000 (ThermoScientific, США) проводили оценку качества и количество синтезированной кДНК. До начала следующего этапа эксперимента синтезированную кДНК хранили при температуре –20 °C.
Экспрессию генов PXDN1, NOS3, EDN1, VCAM, ICAM, PECAM, SELE, SELP оценивали с помощью количественной полимеразной цепной реакции (кПЦР) с детекцией продуктов амплификации в режиме реального времени с флуоресцентным красителем SYBR Green (таблица), а генов SOD1, CAT – с помощью кПЦР с праймерами TaqManTM Gene Expression Assays (Applied Biosystems, США) на амплификаторе ViiA 7 Real-Time PCR System (Applied Biosystems, США).
Таблица. Характеристика праймеров, использованных в эксперименте Table. The characteristics of primers used in the experiment
|
Ген Gene |
Последовательность/Референсный номер Sequence/Reference number |
Белок Protein |
|
ACTB |
Прямой/Forward: 5’-CATCGAGCACGGCATCGTCA-3’ Обратный/Reverse: 5’-TAGCACAGCCTGGACAGCAAC-3’ |
Актин/Actin |
|
GAPDH |
Прямой/Forward: 5’-AGCCACATCGCTCAGACAC-3’ Обратный/Reverse: 5’-GCCCAATACGACCAAATCC-3’ |
Глицеральдегид-3-фосфатдегидрогеназа/ Glyceraldehyde 3-phosphate dehydrogenase |
|
B2M |
Прямой/Forward: 5’-TCCATCCGACATTGAAGTTG-3’ Обратный/Reverse: 5’- CGGCAGGCATACTCATCTT-3’ |
Микроглобулин бета-2/Beta-2-microglobulin |
|
VCAM1 |
Прямой/Forward: 5’- CGTCTTGGTCAGCCCTTCCT-3’ Обратный/Reverse: 5’-ACATTCATATACTCCCGCATCCTTC-3’ |
Молекула адгезии сосудистого эндотелия 1 Vascular cell adhesion protein 1 |
|
ICAM1 |
Прямой/Forward: 5’-TTGGGCATAGAGACCCCGTT-3’ Обратный/Reverse: 5’-GCACATTGCTCAGTTCATACACC-3’ |
Молекула межклеточной адгезии 1-го типа Intercellular adhesion molecule 1 |
|
PECAM1 |
Прямой/Forward: 5’-AAGGAACAGGAGGGAGAGTATTA-3’ Обратный/Reverse: 5’-GTATTTTGCTTCTGGGGACACT-3’ |
Молекула адгезии тромбоцитов к эндотелиальным клеткам/Platelet endothelial cell adhesion molecule |
|
SELE |
Прямой/Forward: 5’-ACCCTGGCTTCAGTGGACTC-3’ Обратный/Reverse: 5’-TGCTTGGCAGGTAACCCCTAT-3’ |
Е-селектин/E-selectin |
|
SELP |
Прямой/Forward: 5’-ATGGGTGGGAACCAAAAAGG-3’ Обратный/Reverse: 5’-GGCTGACGGACTCTTGATGTAT-3’ |
Р-селектин/P-selectin |
|
EDN1 |
Прямой/Forward: 5’-TGCCACCTGGACATCATTTGG-3’ Обратный/Reverse: 5’-GTCTGTTGCCTTTGTGGGAAG-3’ |
Эндотелин 1/Endothelin-1 |
|
NOS3 |
Прямой/Forward: 5’-GTGATGGCGAAGCGAGTGAAG-3’ Обратный/Reverse: 5’-CCGAGCCCGAACACACAGAAC-3’ |
Эндотелиальная синтаза азота Nitric oxide synthase, endothelial |
|
PXDN |
Прямой/Forward: 5’-AGCCAGCCATCACCTGGAAC-3’ Обратный/Reverse: 5’-TTCCGGGCCACACACTCATA-3’ |
Пероксидазин/Peroxidasin homolog |
|
CAT |
Hs00156308_m1 |
Каталаза/Catalase |
|
SOD1 |
Hs00533490_m1 |
Супероксиддисмутаза 1/Superoxide dismutase |
На каждый образец готовили 10 мкл реакционной смеси, содержащей 5 мкл мастер-микса PowerUp TM SYBR ® Green Master Mix (Applied Biosystems, США), смесь прямого и обратного праймеров в конечной концентрации
500 нМ и 10 нг кДНК. ПЦР проводили в 96-луночной оптической плашке, содержащей помимо анализируемых образцов пять стандартов с двукратным разведением и отрицательный контроль (реакционная смесь без кДНК).
Каждый исследуемый образец, стандарт и отрицательный контроль анализировали в трех технических повторах. Амплификацию осуществляли по следующей схеме: 2 мин при 50 °C, 2 мин при 95 °C, 15 с при 95 °C и 1 мин при 60 °C (40 циклов). Специфичность и эффективность реакции проверяли путем анализа кривых плавления и графиков амплификации в программе QuantStudioTM Real-Time PCR Software v.1.3 (Applied Biosystems, США). Результаты кПЦР нормировали с помощью трех референсных генов ACTB , GAPDH , B2M (см. таблицу) в соответствии с имеющимися рекомендациями. Экспрессию изучаемых генов рассчитывали по методу 2-ΔΔСt и выражали в виде кратного изменения относительно контрольных образцов.
Иммунофлуоресцентное окрашивание
Из замороженных образцов на криотоме Microm HM 525 (Thermo Scientific, США) изготавливали срезы толщиной 8 мкм, которые окрашивали с применением специфических первичных антител к нитротирозину (кат. номер: 39B6). На образцы с антителами к нитротирозину наносили смесь вторичных антител к IgG осла, конъюгированные с AlexaFluor555 (A-31570, Invitrogen, США). Все срезы докрашивали ядерным красителем DAPI (Sigma-aldrich, США). Автофлуоресценцию удаляли с помощью реагента Autouorescence Eliminator Reagent (Millipore, США) согласно инструкции производителя и заключали в ProLong (LifeTechnologies, США) под покровное стекло. Исследование препаратов осуществляли на конфокальном лазерном сканирующем микроскопе LSM 700 (Carl Zeiss, Германия).
Статистическая обработка данных
Статистическую обработку результатов исследования проводили с использованием программы GraphPad Prism 8 (Graph Pad Software,). Нормальность распределения оценивали при помощи теста Колмогорова – Смирнова, Шапиро – Уилка. В случае если распределение отклонялось от нормального, сравнение двух групп проводили при помощи критерия Манна – Уитни. Сравнение более двух групп осуществляли с помощью теста Краскела – Уоллиса. Результаты считались статистически значимыми при p < 0,05.
Результаты и обсуждение
В проведенном исследовании выделены образцы РНК (диапазон концентраций – от 168,7 до 247,1 нг/мкл) с высоким уровнем чистоты (А260/230 > 1,90; А260/280 > 2,00; RIQ индекс > 9,5). На основе полученных образцов РНК синтезировано более 1500 нг/мкл кДНК (А260/230 > 1,90 и А260/280 > 1,80).
Сравнительный анализ экспрессии генов PXDN1 , SOD1 и CAT, а также NOS3 и EDN в створках нативных клапанов пациентов с ИЭ и контролем показал, что уровень мРНК в створках, пораженных ИЭ, был статистически значимо ниже по сравнению с контролем (рис. 1).
Стоит отметить, что экспрессия генов VCAM и SELP также статистически значимо снижена в створках, пораженных ИЭ, по сравнению с контрольными образцами (рис. 2). Достоверных различий по другим генам получено не было.
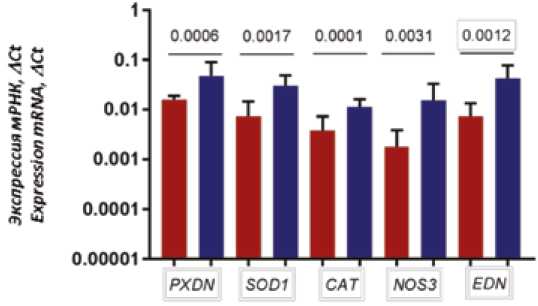
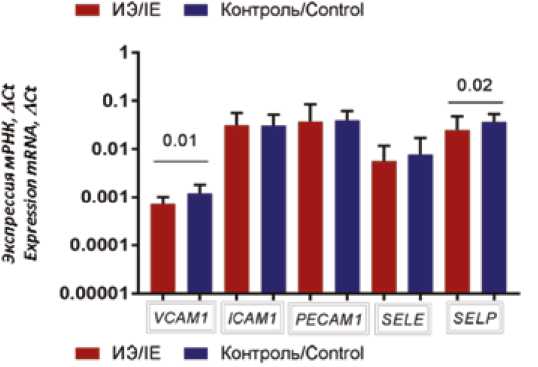
Рис. 1. Уровень экспрессии PXDN1 , SOD1 , CAT, NOS3, EDN1
Fig. 1. The expression levels of PXDN1 , SOD1 , CAT, NOS3, EDN1
Рис. 2. Экспрессия генов VCAM, ICAM, PECAM, SELE, SELP Fig. 2. The expression levels of VCAM, ICAM, PECAM, SELE, SELP
При помощи иммунофлуоресцентного окрашивания антителами к нитротирозину показано, что створки клапанов отличались по уровню экспрессии данного белка. Так, в створке клапана, пораженного ИЭ, наблюдалось более слабое окрашивание нитротирозином (1) по сравнению с контрольными образцами клапанов (2–4), рисунок 3.
Нитротирозин /DAPI Nitrotyrosine /DAPI
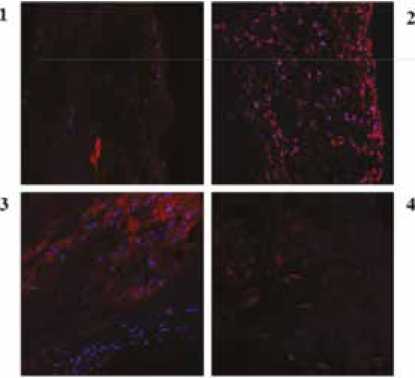
Рис. 3. Изображение конфокальной микроскопии нативных створок клапанов сердца, а – окраска на нитротирозин (красный) и DAPI (синий), цифрами обозначены образцы клапанов: 1 – клапан, пораженный ИЭ; 2, 3, 4 – клапаны без ИЭ; б – количественный анализ изображения (данные представлены в виде медианы). В качестве контроля представлены клапаны без ИЭ. Для сравнения данных использовался тест Краскела – Уоллиса с поправкой на множественные сравнения
Fig. 3. Confocal microscopy imaging of native heart valves, a – 3-nitrotyrosine (red) and DAPI (blue) staining with the heart valve specimens marked by numerals: 1 – heart valve from infective endocarditis patient; 2, 3, 4 – control; b – quantitative analysis of images presented as median. The heart valves obtained from patients without infective endocarditis were used as control. Kruskal – Wallis test with correction on multiple was applied for data comparison
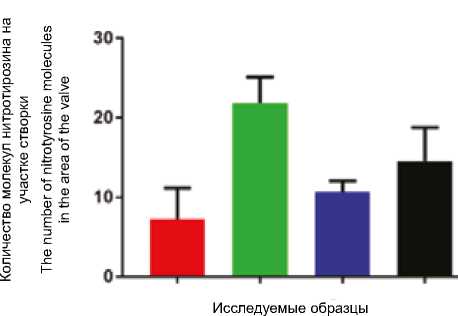
Samples under study
■ ИЭЛЕ
■ Контроль/Control
■ Контроль/Control
■ Контроль/Control
Несмотря на значительные успехи в области кардиологии и кардиохирургии, ежегодно количество дисфункций как нативных, так и биопротезов клапанов продолжает неуклонно расти. Стоит отметить, что на сегодняшний день значительное внимание уделяется изучению нарушений функций биопротезов клапанов сердца [9], в то же время механизмы дисфункции нативных клапанов не до конца изучены. Учитывая тяжесть заболевания и рост заболеваемости ИЭ особое значение приобретает изучение патофизиологических путей развития данного состояния. Одним из важнейших звеньев патогенеза ИЭ является повреждение эндотелия клапана сердца или пристеночного эндокарда, возникающее вследствие дегенеративных и воспалительных изменений. Повреждение эндотелиального слоя провоцирует каскад патологических процессов с участием про- и противоспалительных факторов. Кроме того, прогрессирует тканевая гипоксия, а также происходит нарушение в системе гемостаза [10]. Также отмечается роль окислительного стресса и хронического воспаления на начальных этапах развития клапанной патологии [11].
Полученные нами данные дополняют ранее опубликованную работу, посвященную роли сывороточных уровней молекул клеточной адгезии и эндотелина, а также полиморфных вариантов генов, кодирующих данные молекулы, в патогенез ИЭ [8]. В нашем исследовании мы установили, что уровень генной экспрессии молекул кле- точной адгезии, за исключением VCAM1, был одинаков в нативных створках независимо от патологии клапана сердца. Ранее показано, что при воздействии на эндотелий клапана сердца наблюдается усиление экспрессии молекул адгезии сосудистых клеток (VCAM1) и молекул внутриклеточной адгезии (ICAM1) [12]. Известным фактом является то, что сосудистый эндотелий подвержен действию различных факторов (свободные радикалы, воспалительные белки и др.), однако система синтеза оксида азота является важным звеном поддержания сосудистого тонуса. Так, в одной из отечественных работ отмечается, что наличие генотипа 4b/4b гена NOS3 уменьшает вероятность возникновения эндокардита как инфекционной, так и неинфекционной природы [5]. В нашем исследовании отмечается статистически значимый сниженный уровень генной экспрессии в нативных клапанах сердца, пораженных ИЭ, по сравнению с контрольными образцами клапанов.
Основная масса научных исследований молекулярных механизмов развития дисфункции клапанов посвящена изучению процессов воспаления. Группа ученых, используя метод иммуногистохимического окрашивания, показала, что во время активного воспалительного ответа в створках клапана содержится значительное количество IL-8 и TNFɑ [13]. Неоднократно показано, что ИЭ сопровождается местным и системным воспалением с увеличением концентраций следующих цитокинов: IL-6,
IL-2R и IL-1β [14, 15]. Кроме того, установлено, что цитокины наряду с продуктами бактериального происхождения способны усиливать продукцию активных форм кислорода полиморфно-ядерными лейкоцитами и моноцитами путем активации НАДФН-оксидазы [16]. В одной из последних работ предложена гипотеза о том, что дисфункция клапанов сердца может быть связана с дефектом митохондрий, сопровождающимся увеличением супероксидных радикалов, являющихся предшественниками перекиси водорода.
В исследованиях отмечается, что высвобождение перекиси водорода в образцах миокарда пациентов с ИЭ в 2,14 раза выше по сравнению с образцами миокарда, полученными от пациентов с другой клапанной патологией [17].
В целом, в проведенном исследовании впервые показан профиль генной экспрессии маркеров окислительного стресса, а также молекул межклеточной адгезии, что может свидетельствовать о нарушении эндотелиального слоя клапанных структур.
Заключение
Створки нативных клапанов сердца, пораженных инфекционным эндокардитом, характеризуются сниженной экспрессией генов, вовлеченных в процессы окислительного стресса и генов, кодирующих молекулы клеточной адгезии.
Список литературы Изменение экспрессии генов в створках нативных клапанов сердца, пораженных инфекционным эндокардитом
- Del Giudice C., Vaia E., Liccardo D., Marzano F., Valletta A., Spagnuolo G. et al. Infective endocarditis: A focus on oral microbiota. Microorganisms. 2021;9(6):1218. https://doi.org/10.3390/microorganisms9061218.
- Faraji R., Behjati-Ardakani M., Faraji N., Moshtaghioun S.M., Kalantar S.M., Pedarzadeh A. et al. Molecular diagnosis of bacterial definite infective endocarditis by real-time polymerase chain reaction. Cardiol. Res. 2018;9(2):99-106. https://doi.org/10.14740/cr687w.
- Que Y.A., Haefliger J.A., Piroth L., François P., Widmer E., Entenza J.M. et al. Fibrinogen and fibronectin binding cooperate for valve infection and invasion in staphylococcus aureus experimental endocarditis. J. Exp. Med. 2005;201(10):1627-1635. https://doi.org/10.1084/jem.20050125.
- Ponasenko A.V., Kutikhin A.G., Khutornaya M.V., Rutkovskaya N.V., Kondyukova N.V., Odarenko Y.N. et al. Inherited variation in cytokine, acute phase response, and calcium metabolism genes affects susceptibility to infective endocarditis. Mediators Inflamm. 2017;2017:7962546. https://doi.org/10.1155/2017/7962546.
- Бахарева Ю.С., Максимов В.Н., Акиншина Е.И., Чапаева Н.Н. Ассоциация полиморфизма некоторых генов-кандидатов с развитием эндокардитов неинфекционной и инфекционной этиологии. Российский кардиологический журнал. 2018;(10):83-87. https://doi.org/10.15829/1560-4071-2018-10-83-87.
- Golias C., Batistatou A., Bablekos G., Charalabopoulos A., Peschos D., Mitsopoulos P. et al. Physiology and pathophysiology of selectins, integrins, and IgSF cell adhesion molecules focusing on inflammation. A paradigm model on infectious endocarditis. Cell Commun. Adhes. 2011;18(3):19-32. https://doi.org/10.3109/15419061.2011.606381.
- Дремина Н.Н., Шурыгин М.Г., Шурыгина И.А. Эндотелин в норме и при патологии. Международный журнал прикладных и фундаментальных исследований. 2016;10(2):210-214.
- Понасенко А.В., Цепокина А.В., Кутихин А.Г., Кудряевцева Ю.А. Полиморфизм генов белков, связанных с функцией эндотелия, у пациентов с инфекционным эндокардитом. Российский кардиологический журнал. 2018;(10):88-97. https://doi.org/10.15829/1560-4071-2018-10-88-97.
- Глушкова Т.В., Костюнин А.Е. Структура кальцификатов в биопротезах клапанов сердца, консервированных диглицидиловым эфиром этиленгликоля. Комплексные проблемы сердечно-сосудистых заболеваний. 2021;10(2):16-24. https://doi.org/10.17802/2306-1278-2021-10-2-16-24.
- Nunes M.C.P., Araújo I.R., Carvalho A.T., Andrade L.A., Resende M.H.L., Silva J.L.P. et al. Do cytokines play a role in predicting some features and outcome in infective endocarditis? Adv. Infect. Dis. 2013;3(2):115-119. https://doi.org/10.4236/aid.2013.32018.
- Branchetti E., Sainger R., Poggio P., Grau J.B., Patterson-Fortin J., Bavaria J.E. et al. Antioxidant enzymes reduce DNA damage and early activation of valvular interstitial cells in aortic valve sclerosis. Arterioscler. Thromb. Vasc. Biol. 2013;33:e66-e74. https://doi.org/10.1161/ATVBAHA.112.300177.
- Roberts S., Kosanke S., Dunn S.T., Jankelow D., Duran C.M.G., Cunningham M.W. Pathogenic mechanisms in rheumatic carditis: Focus on valvular endothelium. J. Infect. Dis. 2001;183(3):507-511. https://doi.org/10.1086/318076.
- Ekdahl C., Broqvist M., Franzén S., Ljunghusen O., Maller R., Sander B. IL-8 and tumor necrosis factor alpha in heart valves from patients with infective endocarditis. Scand. J. Infect. Dis. 2008;34(10):759-762. https://doi.org/10.1080/00365540210147912.
- Watkin R.W., Harper L.V., Vernallis A.B., Lang S., Lambert P.A., Ranasinghe A.M. et al. Pro-inflammatory cytokines IL6, TNF-alpha, IL1beta, procalcitonin, lipopolysaccharide binding protein and C-reactive protein in infective endocarditis. J. Infect. 2007;55(3)220-225. https://doi.org/10.1016/j.jinf.2007.05.174.
- Alter P., Hoeschen J., Ritter M., Maisch B. Usefulness of cytokines interleukin-6 and interleukin-2R concentrations in diagnosing active infective endocarditis involving native valves. Am. J. Cardiol. 2002;89(12):1400-1404. https://doi.org/10.1016/s0002-9149(02)02353-6.
- Ostrowski S., Kasielski M., Kordiak J., Nowak D. Elevated resting and agonist-induced whole blood chemiluminescence in patients with active infective endocarditis. Interact. Cardiovasc. Thorac. Surg. 2009;8(1):12-16. https://doi.org/10.1510/icvts.2008.183285.
- Ostrowski S., Kasielski M., Kordiak J., Zwolinska A., Wlodarczyk A., Nowak D. Myocardial oxidative stress in patients with active infective endocarditis. Int. J. Cardiol. 2013;167(1):270-276. https://doi.org/10.1016/j.ijcard.2011.12.102.


