Изменение электрического импеданса мяса коз в процессе автолиза
Автор: Антипова Л.В., Титов С.А., Кумалагова З.Х., Санин В.Н.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 2 (96) т.85, 2023 года.
Бесплатный доступ
Представлены данные по развитию мясного козоводства и показана перспективность этой подотрасли животноводства в получении мясных продуктов. Представлена динамика электрического импеданса козьего мяса в ходе автолиза. Для проведения исследований предложена электрофизическая методика, позволяющая на основе измерения амплитуды сигнала на образце, сдвига фаз между колебаниями тока и напряжения в цепи рассчитать активную и реактивную составляющие импеданса образца мяса и затем, согласно эквивалентной электрической схеме образца, найти параметры этой схемы - величины электрических сопротивлений и емкостей. Объектом исследования являлись длиннейшая мышца спины козьего мяса, имеющая особую ценность для производства мясных продуктов питания, в том числе функционального назначения. Измерения проводили в частотном диапазоне 10-100000 Гц. Обнаружено, что модуль комплексного сопротивления образцов мышечной ткани уменьшается в течение времени хранения, а зависимость угла сдвига фаз от частоты на частотах 10 - 500 Гц со временем сдвигается в сторону больших частот, причём величина экстремума на частотах около 50000 Гц уменьшается. Анализ зависимости параметров эквивалентной схемы образца от времени автолиза показывает, что данные изменения связаны с синтезом аденозинтрифосфорной кислоты в первые часы после убоя и увеличением проницаемости клеточных мембран. Результаты анализа имеют сходность с показателями при исследовании микроструктуры и изменениям водородного показателя мяса в ходе автолиза. Представленные данные могут быть положены в основу создания электрофизического экспресс-метода контроля автолиза и прогнозирования функционально-технологических свойств систем животного происхождения.
Электрический импеданс, мясо коз, автолиз, мясные продукты, развитие козоводства
Короткий адрес: https://sciup.org/140303218
IDR: 140303218 | УДК: 640 | DOI: 10.20914/2310-1202-2023-2-50-58
Текст научной статьи Изменение электрического импеданса мяса коз в процессе автолиза
DOI:
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
Антипова Л.В. и др. Вестник ВГУИТ, 2023, Т. 85, №. 2, С. 50-58 Введение
При общей тенденции роста продукции животноводства, мясное козоводство в России имеет хорошие перспективы развития с учетом технологических аспектов содержания и кормления, мясные козы в наибольшей степени подходят для разведения в личных хозяйствах населения, а также в промышленных масштабах, как альтернатива разведению КРС и МРС. [1]. Повсеместно возрастающий интерес к козьему молоку, особенно для функционального и специализированного (особенно детского) питания побуждает необходимость последующего накопления и рационального использования мяса, развития ассортиментных линеек козьих мясопродуктов. Однако научные основы данного направления переработки мяса коз развиты недостаточно.
Популярность коз и продуктов козоводства среди населения тесно связана с наращиванием поголовья, что диктует необходимость постановки на производство переработку коз с получением мяса и мясных продуктов разнообразного ассортимента на основе научного обоснования технологических условий.
Козоводство, как мясная подотрасль, получило распространение сравнительно недавно. Исторически оно связано с получением шерсти и молока. Наращивание числа голов этих животных ставит как актуальную задачу накопления козлятины позднего продуктивного периода, что требует исследования свойств козлятины в процессе хранения и переработки, и в первую очередь, связано с развитием автолитических превращений в сырье.
Между тем в мире сложилась определенная практика накопления и переработки козлятины по континентам (тыс. голов: Африка – 245, 1; Америка – 41,1; Европа – 18, 1; Азия – 545, 0; Австралия – 0,45). Природно-климатические условия разведения и содержания, национальные особенности культуры питания, уровни развития производства в странах мира объясняют разницу в объемах переработки (тыс. т: Китай – 137,87; Индия – 125, 46; Пакистан – 25, 53; Судан – 49,9; Иран – 25,53; Монголия – 15,45; Мексика – 8,90; Турция – 6,28; Испания – 2,89; США – 2,93; Франция – 1,25; Италия – 0,99)
Среди республик бывшего СССР заметно отличаются азиатские, такие как Россия, Казахстан, Киргизия, Азербайджан, Туркмения, Таджикистан, Узбекистан. При этом козоводство в России имеет выраженный региональный характер (тыс. голов): республика Дагестан – более 5073,5; Калмыкия – 2332,0; Ставропольский край – 2285,0; Тыва – 1137,1.
Породы коз принято подразделять на молочные и шерстяные. Последние в свою очередь подразделяются на европейские и индоафриканские, а также ангорские, кашмирские и др.
Соответственно получили известность и выделяются в группу мясных пород такие как как серана, бурская, бенгальская, таджикская, узбекская, дагестанская и др. (рисунок 1)
Рисунок 1. Мясные породы коз Figure 1. Meat breeds of goats
Разделка козьих туш мало чем отличается от традиционной, однако сырье более благополучно по показателям безопасности, особенно по радионуклидам, свинцу, мышьяку. Свойства мясных систем определяются в наибольшей степени глубиной и характером автолиза, т.е. биохимическими изменениями структуры и свойств, входящих в него компонентов, которые, как известно, в свою очередь определяют технологическую направленность и пригодность в разработке ассортиментных групп продуктов [2]. Изменение свойств мяса под воздействием автолитических процессов – сложнейшая фундаментальная задача, определяющая особенности и направления использования этого вида пищевого сырья. Биохимия мяса описывает прижизненные функции и строение тканей животных организмов, механизмы их превращений под действием ферментов и химических веществ. В настоящее время определены и описаны стадии автолиза, формирующие специфику строения белковых молекул, углеводных систем и тканей мяса, определяющих рациональность его использования в технологии ассортиментных линеек мясных продуктов [3,4]. На начальных стадиях автолиза мясо не имеет в достаточной мере необходимых органолептических свойств, на определенной стадии автолиза (посмертное окоченение) оно не пригодно для изготовления большинства мясопродуктов из-за высокой жесткости и низкой влагосвязывающей способности и лишь на стадии созревания оно имеет наиболее широкое технологическое применение. Ввиду технологической значимости автолиза были подробно изучены биохимические процессы, структурномеханические свойства, микроструктура тканей при автолитических превращениях крупного рогатого скота и свиней [5, 6].
На ход автолиза мяса большое влияние оказывает активность ферментов, расщепляющих белки – катепсинов [7], а также кальпаинов – кальций-зависимых цистеин-нейтральных протеиназ, определяющих деградацию миофиб-риллярных белков [8–10]. В [8] показана роль кальпаинов в формировании структурно-механических свойств мяса, определяющих его нежность. Внимание исследователей привлекает не только автолиз мяса скота, но и автолиз тканей других видов животных – птицы [11, 12], рыбы [13, 14], морских ракообразных [15] и даже автолитические превращения в одноклеточных микроорганизмах – бактериях и дрожжах [16, 18]. В работе [17] показано, что одними из факторов, влияющих на автолиз дрожжей Sacharomicescerevisae могут являться импульсные электрические поля. Обработка импульсными электрическими полями увеличивает количество маннозы, высвобождаемое в ходе автолиза. Среда, содержащая дрожжи, обработанная импульсными электрическими полями, содержала примерно в 2 раза больше маннопротеинов, чем среда, содержащая необработанные дрожжи. Исследование автолиза дрожжевых клеток имеет и некоторое практическое значение. Например, отработанные пивные дрожжи используются для производства дрожжевого экстракта путём автолиза [18].
Указанные причины подчеркивает желательность и необходимость оценки сырья при определении стадии автолиза.
Однако показатели превращений белково-углеводных систем мяса известными методами (морфологический и физико-химический) определить достаточно сложно, это требует времени, наличия специализированных кадров.
Электрофизике автолиза в существующей литературе пока не уделялось должного внимания.
Между тем, существует потребность в экспресс-диагностике автолиза, для которой могут быть применены электрофизические методы. Кроме того, представляет интерес и собственно изменение электрофизических свойств мяса в процессе автолиза, так как электрофизические методы обработки применяются в мясной технологии при массировании мяса, для ускорения его созревания, при термообработке в ходе изготовления колбасных изделий с целью улучшения функционально-технологических свойств мясного сырья.
Цель работы – исследование электрофизических свойств мышечной ткани коз на различных этапах автолиза.
Методы
Объектом исследования служила козлятина свеже забитая (в полутушах) произведённая в частном подсобном хозяйстве города Воронежа, из которой выделялась длиннейшая мышца спины в лабораторных условиях. В ней идентифицирована развитая мышечная ткань
Изменение электрического импеданса в объекте (частотная зависимость комплексного сопротивления) при воздействии электрического сигнала позволяет оценить электрофизические параметры тканей, в частности модуль комплексного сопротивления (Z), угол фазового сдвига между током и направлением активной и реактивной составляющих (емкостных) Z и Z .
Эти параметры возможно рассматривать при оценке внутренней структуры биологических объектов, то есть в нашем случае – параметров клеток мышечной ткани длиннейший мышцы. Весьма интересно проследить связь изменения свойств тканей и клеток в процессе развития автолиза, что, несомненно, повысило бы эффективность метода по сравнению с известными рутинными методами гистологического и физико-химического анализа.
Известно большое количество эквивалентных электрических схем биологических тканей, позволяющих интерпретировать экспериментальные результаты измерения их импеданса.
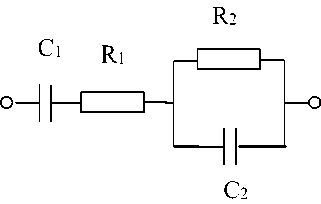
Рисунок 2. Электрическая эквивалентная схема исследуемых образцов тканей
Figure 2. Electrical equivalent circuit of the tested tissue samples
В ходе экспериментальных исследований избран вариант эквивалентной схемы (рисунок 2), где в качестве биологического объекта выступает система клеток ткани, окруженных межклеточным веществом в которых имеется клеточный сок. Принято, что эквивалент ёмкости на грани раздела электролиза и межклеточной жидкости – элемент С 1 ; сопротивление образующегося двойного электрического слоя – элемент R 1 . Система клеток биологической ткани имеет эквивалентное активное сопротивление R и ёмкость C , которые зависят от электрической ёмкости мембран клеток. Сопротивление R обусловлено сопротивлением мембран и внутриклеточным содержимым.
Величина активной составляющей импеданса определяется формулой:
Z R W= R + . R, • (1)
-
1 + ( COR2 C^ )
Реактивную составляющую можно рассчитать по формуле:
Zc ( ю ) =
1 to R 2 C
--+--2—— to c 1 + (toR c )2
Расчет модуля импеданса вели по формуле:
I Z |=7 Z R + Z C - (3)
Угол фазового сдвига определяли по фор- муле:
Ф = arctan
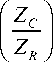
Из формулы (1) следует, что при ω→∞ значение ZR ( to ) = R , т.к
---—---7 ^ 0;
1 + ( to R c 2)
Из формулы (2): при стремлении ω→∞ величина —--> 0. При этом функция
ω С
Z c ( to ) =
to R2 C2
1 + (to R C22
имеет при частоте
ω
max
1 R R C R
максимум, величина которого
Zc ( to ) = 0,5 x R .
Определив из экспериментальных данных величины R и tomm можно рассчитать
С = —1—
-
2 n -
- ωR
max 2
При стремлении ω→∞ величина
Zc ( to )
1 1
--1--
ω С ω С
Тогда значения С1 определяем из фор- мулы:
C 1 =
Таким образом, проведя анализ частотных зависимостей
Zc
(
to
)
и
ZR
(
to
)
, можно определить все элементы эквивалентной схемы животной ткани.
Рассчитывались величины реактивной и активной составляющей импеданса
Zc
(
to
)
и
ZR
(
to
)
численными методами из системы уравнений (3), (4). По результатам измерения величин модуля комплексного сопротивления и угла фазового сдвига.
Блок-схема представлена на рисунке 3. Рисунок 3. Схема установки измерений Figure 3. Schematic diagram of the measurement setup
Измерительный сигнал поступает от генератора 1 на измерительную ячейку 2, последовательно с которой включен резистор 3. Переменные напряжения U
1
с резистора 3, а также с U
2
ячейки 2 подаются на измеритель сдвига фаз, который определяет разность фаз φ между колебаниями напряжения и, кроме того, действующие значения напряжений.
Величина R сопротивления 3 подбирается таким образом, чтобы падение напряжения на нем было значительно больше падения напряжения на измерительной ячейке. Расчёт модуля импеданса для рассматриваемого случая:
I
Z\
=
U
^
R
, (8)
Зная величины Z и φ из системы уравнений (3) и (4) можно определить значения активной Z
R
и реактивной Z
С
составляющих импеданса, а затем по вышеприведенной методике рассчитать параметры эквивалентной схемы.
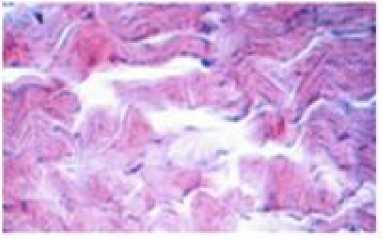
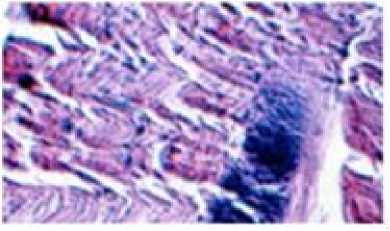
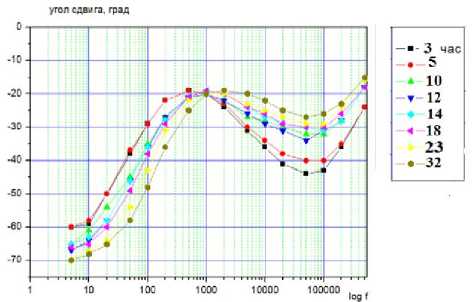
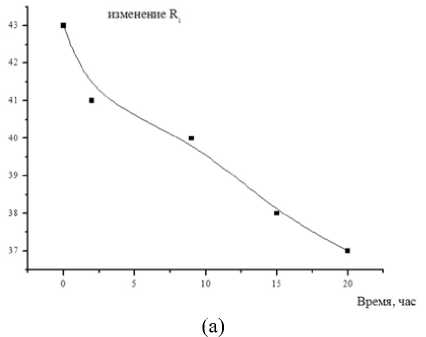
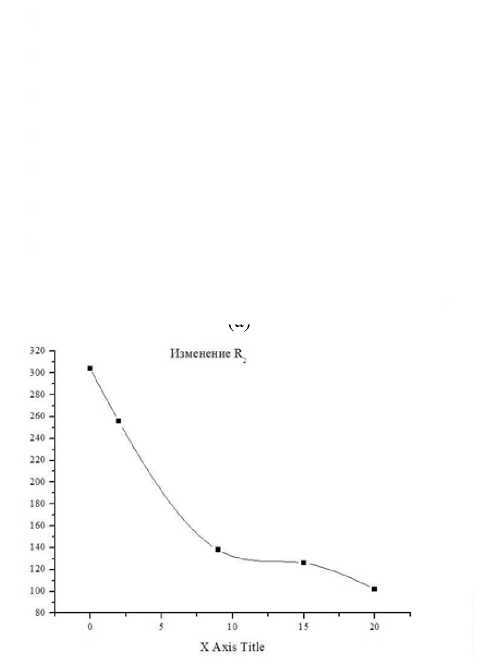
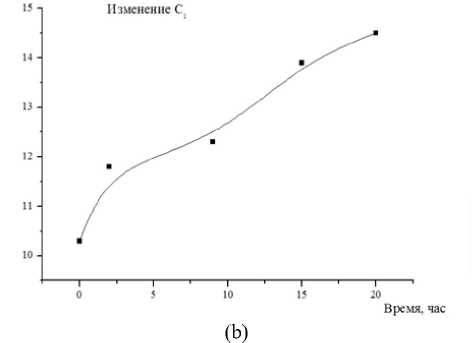
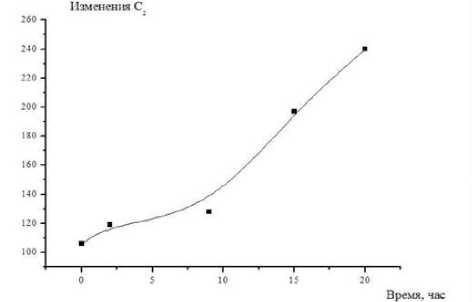
Измерения проводили при Т = 296 К в диапазоне частот от 5 до 500 кГц. Электродами служили покрытые оловом (чистота 99,9%) медные пластины. В ходе экспериментальных исследований, кроме расчётов, использовали также методы определения: рН – по ГОСТ Р 51478; глюкоза – по ГОСТ 29301; гликоген – по ГОСТ 34134. Микроструктура мяса определялась методом световой микроскопии в соответствии с [1]. Результаты и обсуждение Длиннейшую мышцу спины хранили при температуре -1 ÷ ± 4 градуса Цельсия. Периодически отрезая часть для сравнительного анализа изучения структуры мышечной ткани. Гистологию тканей изучали традиционным методом, параллельно. Авторы установили, что с истечением времени хранения мяса коз наблюдается развитие автолитических превращений: фрагментация и распад структуры клеток (рисунок 4), отложение солей кальция (рисунок 5), извитость мышечных волокон (рисунок 6). Рисунок 4. Фрагментация и распад мышечных волокон. Окр. Гематоксилин-Эозин. Ув.×200 Figure 4. Fragmentation and disintegration of muscle fibers. Hematoxylin-Eosin. Eq.×200. Рисунок 5. Отложение солей и кальция, в межмышечных пространствах обильные скопления транссудата. Окр. Гематоксилин-Эозин. Ув.×200 Figure 5. Deposition of salts and calcium, in intermuscular spaces abundant accumulations of transudate. Hematoxylin-Eosin. Eq.×200. Рисунок 6. Извитая микроструктура мышечных волокон. Окр. Гематоксилин-Эозин. Ув. ×200 Figure 6. Twisted microstructure of muscle fibers. Hematoxylin-Eosin. Eq. ×200. Из приведённых данных видно, что козье мясо представляет интерес как сырьевой ресурс с пониженным содержанием жира. Проведены необходимые измерения модуля комплексного сопротивления и угла фазового сдвига между временными зависимостями силы тока и напряжения на частотах 10–100000 Гц. Модуль комплексного сопротивления исследуемых образцов уменьшается в течение времени хранения. Зависимость угла сдвига от частоты на частотах 10–500 Гц со временем сдвигается в сторону больших частот, а величина экстремума на частотах 50000 Гц – уменьшается (рисунок 7). Рисунок 7. Зависимость угла сдвига от частоты Figure 7. Dependence of shear angle on frequency Экспериментальные графики на рисунках совпадают с расчетными для эквивалентной схемы, (рисунок 8)
Для данной эквивалентной схемы можно записать формулы (1)–(4), анализ которых приводит к выводу, что, измерив на стандартном оборудовании величины φ и Z в зависимости от частоты измерительного сигнала и рассчитав из уравнений (3), (4) активную и реактивную составляющие импеданса Z
R
и Z
С
, можно по их частотным зависимостям численными методами определить параметры эквивалентной схемы
С
,
R
,
R
,
С
.
Для этого, варьируем параметры эквивалентной схемы и подставляем их в формулы (1) и (2) до тех пор, пока рассчитанные по этим формулам частотные зависимости
Zc
(
ю
)
и
ZR
(
ю
)
не совпадут с определением по формуле (3) и (4).
Изменения параметров схемы от времени показано на рисунках. Классические представления об автолизе мышечной ткани связаны с ресинтезом аденозин-трифосфорной кислоты в первые часы после убоя благодаря анаэробному распаду гликогена, в результате чего понижается рН из-за накопления молочной кислоты. Это приводит к возрастанию концентрации высокоподвижных ионов водорода внутри клетки, что вызывает резкое снижение сопротивления R . Учитывая, что введение электродов в образец вызывает изменения в прилегающих клетках с некоторым их повреждением, можно заключить, что происходит обогащение двойного электрического слоя и соответственно изменяются параметры R и С , характеризующие состояние этого слоя. Сопоставление результатов электрофизических изменений с данными химического анализа мышечной ткани коз в ходе автолиза (таблица 1) показывает, что вышеописанные процессы происходят в первые 8 часов после убоя. (c)
Рисунок 8. Зависимость параметров эквивалентной схемы от времени, (a) сопротивление
R
, (b) емкость
С
, (c)
(d)
сопротивление
R
, (d) емкость
С
Figure 8. Time dependence of equivalent circuit parameters, (a) resistance , (b) capacitance , (c) resistance , (d) capacitance Таблица 1. Динамика изменения рН, содержания углеводных фракций в длиннейшей мышце спины козлятины Table 1. Dynamics of changes in pH, carbohydrate fractions content in goat back long muscle
Продолжительность хранения, час Storage time, hour
рН мышечной ткани pH of muscle tissue
Содержание глюкозы, мг % Glucose content, mg %
Содержание молочной кислоты, мг % Lactic acid content, mg %
1
6,18
95,2 ± 1,3
333,4 ± 1,3
5
5,51
109,4 ± 1,5
766,5 ± 1,6
12
5,54
141,2 ± 1,8
760,3 ± 1,6
24
5,59
127,4 ± 1,2
752,2 ± 1,7
48
5,62
120,2 ± 1,8
728,9 ± 2,1
72
5,88
126,6 ± 1,4
721,3 ± 1,5
120
5,68
130,5 ± 1,5
715,5 ± 1,8
240
5,82
145,5 ± 1,3
703,5 ± 1,6
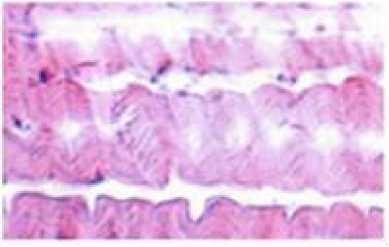
Снижение водородного показателя в этот период сопровождается высвобождением связанных ионов кальция, что приводит к изменению содержания кальпаина, распаду АТФ, а также деформации фибриллярного актина. Вследствие этого происходит образование актомиозина с последующим сокращением мышечных волокон – посмертным окоченением. На более поздних стадиях автолиза протекают заметные изменения клеточной структуры тканей и, в частности, деструкция мембранной системы клеток. Так происходит отслоение сарколеммы клетки мышечного волокна, сопровождающееся разрывом плазмолеммы в местах перехода в Т-систему и в отслоение от базальной мембраны. В этот же период происходит разволокнение и разрыхление соединительно-тканных прослоек между мышечными волокнами, что подтверждается сделанными нами микрофотографиями мышечной ткани коз спустя 24 часа после убоя (рисунок 9). Рисунок 9. Микроструктура мышечного волокна длиннейшая мышца спины через 24 часа хранения после убоя. Окр. Гематоксилин-Эозин. Ув.×200 Figure 9. Microstructure of muscle fiber of the longest muscle of the back 24 hours of storage after slaughter. Hematoxylin-Eosin staining. Eq.×200.
Кроме того, вследствие липофанероза, которому способствует снижение рН ткани, идут изменения морфологии мембран саркоплазматического ретикулума. Минимум зависимости угла фазового сдвига на частоте в области 103–105 Гц наблюдается для различных видов растительной и животной ткани и исчезает по мере термической или механической деструкции клеточной системы ткани. Исчезновение со временем минимума в области 50000 Гц для образцов мяса коз также можно связать с изменениями клеточной системы животной ткани на определенных стадиях автолиза (разрешение посмертного окоченения и созревание мяса). Возможно, ранний минимум обусловлен ограничением свободы передвижения ионов в клетке, тогда рост ионной проницаемости клеточных мембран, проявляющийся вследствие их автолитических изменений, способствует уменьшению величины минимума. Соответственно, при временах автолиза свыше 10 часов происходит рост эквивалентной емкости
С
, связанной с электроемкостью мембранной системы.
Анализ литературных данных показывает, что для управления ходом автолиза мяса кроме уже упомянутых электрофизических воздействий использовались также обработка концентратом сывороточных белков, проявляющих ингибирующие свойства по отношению к автолитическим превращениям мышечной ткани рыбы и коз [19], что в свою очередь отражалось на структурномеханических свойствах гелей, полученных из этих видов сырья. Выдерживание свинины в рассоле, обработанном ультразвуком, приводит к накоплению в среде избыточных электронов, способных активировать метмиоглобин, и, в конечном итоге, к стабилизации цвета мяса [20]. При использовании ультразвуковой обработки говядины воздействие ультразвука увеличивает количество автолизированных субъединиц и снижает численность субъединиц в интактной форме [21]. Соответственно такое воздействие значительно увеличивало индекс фрагментации миофибрилл и уменьшало сдвиговые напряжения в образцах мяса. Поэтому обработка ультразвуком может увеличивать нежность мышечной ткани говядины за счёт регулирования активации кальпаина и деградации белка во время автолиза. Однако для реализации всех этих методов влияния на автолиз и разработки соответствующего технологического оборудования необходима информация о ходе автолиза с течением времени, причём желательно, чтобы результаты измерений были бы получены немедленно для обеспечения возможности оперативной корректировки процесса автолиза [22]. Представленные в настоящей работе данные по электрофизике автолиза на примере мяса коз создают основу для дальнейших исследований, направленных на разработку экспресс-метода контроля автолиза c помощью электрофизических измерений. Заключение Особенности частотных зависимостей импеданса мяса коз при автолитических изменениях могут быть объяснены на основе существующих представлений о биохимии и микроструктуре мышечной ткани в ходе автолиза. На базе полученных в настоящей работе данных может быть создана экспресс-методика электрофизического контроля автолиза мяса коз. Данный метод имеем ряд преимуществ перед существующими: экспрессность, объективность, малая трудоемкость, не требует разрушения нативных структур. При создавшихся условиях мясного рынка, где заметное место может занять мясо коз, рассмотренные в статье подходы в определении стадии автолиза, а следовательно в оценке функциональнотехнологических свойств и качества мяса весьма перспективных.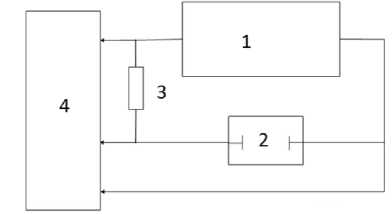
Список литературы Изменение электрического импеданса мяса коз в процессе автолиза
- Волков А.Д. Овцеводство и козоводство: учебник; 3е изд. Санкт-Петербург: Лань, 2020. 280 с. URL: https://e.lanbook.com/book/130483
- Цикин С.С., Родина Н.Д., Сергеева Е.Ю. Изучение свойств мясного сырья нетрадиционных видов животных с аномальным характером автолиза // Вестник аграрной науки. 2017. № 3. С. 158-163. URL: https://e.lanbook.com/journal/issue / 302027
- Боровков М.Ф., Волков А.Х., Папуниди Э.К., Якупова Л.Ф. Ветеринарно-санитарная экспертиза мяса и мясных продуктов: учебное пособие. Казань: КГАВМ им. Баумана, 2020. 184 с. URL: https://e.lanbook.com/book/156774.
- Криштафович В.И., Позняковский В.М., Гончаренко О.А., Криштафович Д.В. Товароведение и экспертиза мясных и мясосодержащих продуктов. Санкт-Петербург: Лань, 2020. 432 с. URL: https://e.lanbook.com/book/129085
- Мишанин Ю.Ф. Биотехнология рациональной переработки животного сырья: учебное пособие; 2е изд., стер. Санкт-Петербург: Лань, 2020. 720 с. URL: https://e.lanbook.com/book / 139248
- Слесаренко Н.А., Оганов Э.О., Степанишин В.В. Структурный контроль качества сырья и продуктов животного происхождения: учебник. Санкт-Петербург: Лань, 2019. 204 с. URL:https://e.lanbook.com/book / 122161
- Дворянинова О.П., Антипова Л.В., Соколов А.В. Протеолитические ферменты прудовых рыб: способы выделения и свойства // Известия ТИНРО (Тихоокеанского научно-исследовательского рыбохозяйственного центра). 2016. Т. 187. С. 245-253.
- Liu R., Lonergan S., Steadham E., Zhou G. et al. Effect of nitric oxide and calpastatin on the inhibition of µ-calpain activity, autolysis and proteolysis of myofibrillar proteins // Food chemistry. 2019. V. 275. P. 77-84. https://doi.org/10.1016/j.foodchem.2018.09.104
- Ramos P.M., Wright S.A., Delgado E.F., Van Santen E. et al. Resistance to pH decline and slower calpain-1 autolysis are associated with higher energy availability early postmortem in Bos taurus indicus cattle // Meat Science. 2020. V. 159. P. 107925. https://doi.org/10.1016/j.meatsci.2019.107925
- Ilian M.A., Bekhit A.E.D., Bickerstaffe R. The relationship between meat tenderization, myofibril fragmentation and autolysis of calpain 3 during post-mortem aging // Meat Science. 2004. V. 66. №. 2. P. 387-397. https://doi.org/10.1016/S0309-1740(03)00125-6
- Jamdar S.N., Harikumar P. Autolytic degradation of chicken intestinal proteins // Bioresource technology. 2005. V. 96. №. 11. P. 1276-1284. https://doi.org/10.1016/j.biortech.2004.10.014
- Chang Y.S., Hsu M.J., Chou R.G.R. Postmortem role of calpain-11 in ostrich skeletal muscle // Meat science. 2018. V. 143. P. 147-152. https://doi.org/10.1016/j.meatsci.2018.04.024
- Hansen L.T., Gill T., Røntved S.D., Huss H.H. Importance of autolysis and microbiological activity on quality of cold-smoked salmon // Food Research International. 1996. V. 29. №. 2. P. 181-188. https://doi.org/10.1016/0963-9969(96)00003-8
- Antipova L.V., Storublevtsev S.A., Titov S.A., Antipov S.S. et al. A study of the use of modified collagen of freshwater fish as a material for personal care products // Wound Healing. 2019.
- da Silva C.P., Bezerra R.S., Carvalho L.B. Biological value of shrimp protein hуdrоlуsаtе6 b5у-product produced by autolysis // LWT. 2017. V. 80. P. 456-461.
- Yamato M., Nakada R., Nakamura Y. Release of spirosin associated with potassium phosphate-induced autolysis in Lactobacillus reuteri DSM 20016 // Microbiological research. 1998. V. 153. №. 1. P. 29-35. https://doi.org/10.1016/S0944-5013(98)80018-9
- Martínez J.M., Delso C., Raso J. Factors influencing а6u0tоlуsis of Saccharomyces cerevisiae cells induced by pulsed electric fields // Food Microbiology. 2017. V. 73. P. 67-72.
- Tanguler H., Erten H. Utilisation of spent brewer's yeast for yeast extract production by autolysis: The effect of temperature // Food and bioproducts processing. 2008. V. 86. №. 4. P. 317-321. https://doi.org/10.1016/j.fbp.2007.10.015
- Rawdkuen S., Benjakul S. Whey protein concentrate: Autolysis inhibition and effects on the gel properties of surimi prepared from tropical fish // Food Chemistry. 2008. V. 106. №. 3. P. 1077-1084. https://doi.org/10.1016/j.foodchem.2007.07.028
- Krasulya O., Smirnova A., Bogush V., Shlenskaya N. et al. Estimation of the stability of skeletal muscle myoglobin of chilled pork treated with brine activated by low-frequency high-intensity ultrasound // Ultrasonics Sonochemistry. 2021. V. 71. P. 105363. https://doi.org/10.1016/j.ultsonch.2020.105363
- Wang A., Kang D., Zhang W., Zhang C. et al. Changes in calpain activity, protein degradation and microstructure of beef M. semitendinosus by the application of ultrasound // Food Chemistry. 2018. V. 245. P. 724-730. https://doi.org/10.1016/j.foodchem.2017.12.003
- Антипов С.Т., Панфилов В.А., Калашников Г.В. Оборудование для ведения тепломассообменных процессов пищевых технологий. Лань, 2020. 460 с.


