Изменения биологической и пищевой ценности зерна гороха и фасоли в результате его биоактивации
Автор: Вебер А. Л., Леонова С. А.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биотехнология пищевых продуктов и биологически активных веществ
Статья в выпуске: 3 т.27, 2024 года.
Бесплатный доступ
Актуальность исследования обусловлена целесообразностью использования биоактивированного зерна гороха и фасоли отечественной селекции в технологиях альтернативных продуктов сложного сырьевого состава для здорового, функционального и специализированного питания различных групп населения. Цель работы – изучить влияние разработанных технологических режимов биоактивации на пищевую и биологическую ценность, функционально-технологические свойства белково-углеводного комплекса зерна гороха и фасоли. В работе рассмотрены результаты исследований технологических и биохимических свойств зерна гороха селекции Башкирского НИИСХ и фасоли селекции Омского ГАУ при его биоактивации с использованием установки смарт-спраутер "Росинка". Изучены аминокислотный состав, ингибирующая активность зерна исследуемых сортов, усвояемость белка in vitro, функционально-технологические свойства белково-углеводного комплекса зерна. Исследования осуществляли с использованием общепринятых, современных инструментальных методов анализа свойств сырья и готовой продукции. Установлено, что применение разработанных технологических параметров биоактивации приводит к модификации функционально-технологических свойств структурообразующих нутриентов зерна, интенсивному накоплению всех аминокислот за исключением треонина, позволяет увеличить содержание белка в зерне гороха на 15,32 % и фасоли на 14,96 % по отношению к исходным значениям, повысить степень соответствия белка зерна гороха и фасоли эталонному белку ФАО/ВОЗ на 4,48 и 17,53 %, снизить активность ингибиторов протеаз зерна на 19,76 и 26,12 %, повысить переваримость белка зерна на 7,77 и 5,85 %. Результаты исследований доказывают целесообразность использования биоактивированного зерна гороха и фасоли для производства альтернативных продуктов сложного сырьевого состава, в том числе напитков на растительной основе и продуктов сегмента dairy alternatives.
Горох, фасоль пищевая ценность, белково-углеводный комплекс, peas, beans, nutritional value, protein-carbohydrate complex
Короткий адрес: https://sciup.org/142241946
IDR: 142241946 | УДК: 635.65:641.1 | DOI: 10.21443/1560-9278-2024-27-3-282-293
Текст статьи Изменения биологической и пищевой ценности зерна гороха и фасоли в результате его биоактивации
Вебер А. Л. и др. Изменения биологической и пищевой ценности зерна гороха и фасоли в результате его биоактивации. Вестник МГТУ. 2024. Т. 27, № 3. С. 282–293. DOI:
e-mail: , ORCID:
Veber, A. L. et al. 2024. Changes in the biological and nutritional value of pea and bean grains as a result of their bioactivation. Vestnik of MSTU, 27(3), pp. 282–293. (In Russ.) DOI:
Зернобобовые культуры (соя, фасоль, горох, нут, чечевица, люпин, вика яровая, бобы и др.), издавна широко культивируемые на территории Российской Федерации, являются стратегически важным резервом для решения проблемы дефицита белка у населения. Их особая ценность заключается не только в ликвидации дефицита белка, но и в улучшении фитосанитарного состояния полей за счет поддержания естественным путем плодородия почвы (обогащение ее доступными формами азота благодаря деятельности клубеньковых бактерий), сохранении растительного и подземного биоразнообразия. В отечественном земледелии в структуре посевных площадей, учитывая все типы хозяйств, зернобобовые культуры занимали в 2021 г. – 2,40 %, в 2022 г. – 2,31, в 2023 г. – 2,70 % от площади всех сельскохозяйственных культур. В указанной структуре посевных площадей зернобобовых культур 52,12–67,04 % удельного веса приходится на горох (без учета типа хозяйства населения) вследствие более высокой урожайности. Фасоль выращивается в небольших количествах в хозяйствах населения (валовый сбор составляет около 6 тыс. т). При этом самообеспеченность России фасолью составляет 22,7 %, 77,0 % приходится на импорт ( Зотиков и др., 2020; Зотиков и др., 2018 ).
Несмотря на разнообразие сортов бобовых культур, увеличение их посевных площадей, в том числе в мировом масштабе, за исключением сои, по сравнению с зерновыми невелико. Во многом это обусловлено слабым развитием рынка продуктов питания, производимых из зерна бобовых, низкой информированностью потребителя о его пользе, специфичностью вкусовых качеств, повышенным содержанием антиалиментарных веществ, а также ряда ингибиторов протеиназ, которые снижают активность пищеварительных ферментов, усвояемость и технологические свойства белка.
В настоящее время учеными разработано достаточно методов, способов и технологических приемов, направленных на инактивацию антиалиментарных веществ, например, замачивание в различных растворителях, экструдирование, измельчение, термическая обработка (поджаривание, микронизация, автоклавирование, СВЧ-обработка и кипячение) ( Фролов и др., 2020 ). Остаются актуальными традиционные методы селекции ( Зотиков и др., 2018 ), применяются также геномные и постгеномные технологии, механохимические ( Голязимова, 2010; Горлов и др., 2018 ) и механоферментативные ( Толкачева и др. 2017; Бычков и др., 2017; Витол и др., 2018 ) технологии. Биоактивация (проращивание) зерна является альтернативой механоферментативной обработки, в результате которой возрастают пищевая и биологическая ценность, полностью инактивируется или значительно снижается активность антиалиментарных веществ, повышается полноценность аминокислотного состава и усвояемость белка ( Вебер и др., 2017; Антипова и др., 2017; Шаскольский и др., 2007; Kim et al., 2005; Kariluoto et al., 2006; Buriro et al., 2010; Samtiya et al., 2020 ). Подтверждена целесообразность использования пророщенного зерна в различных отраслях пищевой промышленности ( Пащенко, 2009; Самофалова и др., 2016; Цапалова и др., 1999; Антипова и др., 2001; Romulo et al., 2022; Ерофеева, 2023 ). Однако данные о качественных и количественных изменениях биохимического состава, модификации белково-углеводного комплекса зерна гороха и фасоли сортов отечественной селекции, как и данные о целесообразности использования пророщенного зерна для получения альтернативных продуктов весьма немногочисленны.
Таким образом, целью работы явилось изучение влияния технологических режимов биоактивации на пищевую и биологическую ценность, функционально-технологические свойства белково-углеводного комплекса зерна гороха и фасоли с целью его дальнейшей переработки в альтернативные продукты питания.
Материалы и методы
Для проведения эксперимента использовали зерно гороха сорта Памяти Хангильдина (селекция БНИИСХ, Республика Башкортостан) и фасоли сорта Омичка (селекция ФГБОУ ВО Омского ГАУ, г. Омск), качество которых соответствовало требованиям ГОСТ 28674-20191 "Горох. Технические условия" и ГОСТ 7758-2020 "Фасоль продовольственная. Технические условия". Технологические режимы биоактивации зерна бобовых культур исследуемых сортов представлены на рис. 1 ( Leonova et al., 2023 ). Для биоактивации использовали установку смарт-спраутер "Росинка", в основу которой заложена технология аэропоники ( Устройство…, 2016 ).
Для оценки биохимического состава зерна исследованных сортов до и после биоактивации определяли: содержание белка методом Къельдаля по ГОСТ 10846-91, соотношение белковых фракций в зерне по методу Ермакова – Дурыниной2; влажность зерна – по ГОСТ 13586.5-2015, содержание жира в зерне – ГОСТ 29033-91, углеводов – ГОСТ 26176-2019 и ГОСТ 10845-98. Переваримость белка оценивали по общепринятой методике in vitro ( Покровский и др., 1965 ).
Микроскопические исследования проведены с использованием электронного микроскопа MF-BGU-LED-NE620 (Китай) с флуоресцентным осветителем и камерой для микроскопирования (модель FL-20) при общем увеличении микроскопа в видимой области спектра в пределах от 2000Х до 4000Х. Для обработки полученных микрофотографий использовали программу Capture 2.4.
Аминокислотный состав белка определяли методом высокоэффективной жидкостной хроматографии на жидкостном хроматографе LC-20AB Shimadzu. Разделение проводили на колонке Zorbax Eclipse XDB-C18 4.6 x 150 mm, 5цш (Agilent). Градиентный режим элюирования от 1 до 65 % за 40 мин. Скорость потока -1,4 мл/мин, элюент А – 0,02М раствор ацетата натрия, элюент В – метанол. Температура 35 °С, аналитическая длина волны – 338 нм. Погрешность определения менее 6 %. Также использовали систему капиллярного электрофореза "Капель – 105/105 М" по ГОСТ 31480-2012; ГОСТ Р 55569-2013 с последующим детектированием по методике М.04-38-2009 (ФР.1.31.2010.07015).
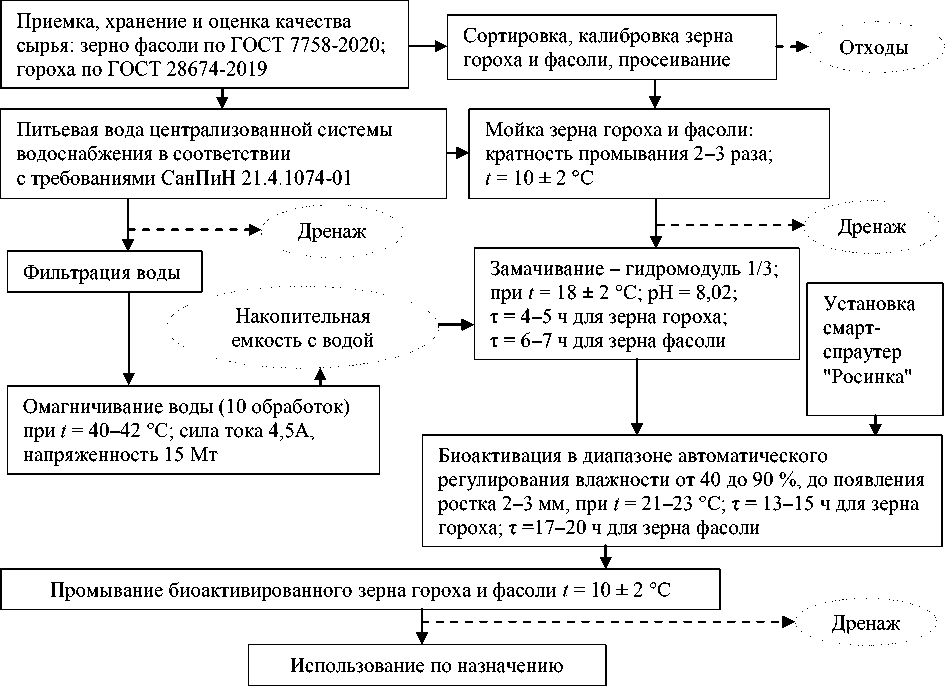
Рис. 1. Технологическая схема производства биоактивированного зерна гороха и фасоли исследуемых сортов Fig. 1. Technological scheme for the production of bioactivated grain peas and beans of the studied varieties
Биологическую ценность белков оценивали путем расчета аминокислотного скора по формуле с использованием шкалы ФАО/ВОЗ3
АК= мг АК выбелка _юо%.
мг АК в 1 г эталона
Активность протеаз определяли методом Эрлангера с модификациями (Соломинцев и др., 2009). К буферному раствору (Трис-HCl, рН 8) в ячейке иммунологического планшета добавляли такие же объемы раствора синтетического субстрата БАПНА – N, α-бензоил-DL-аргинин-4-нитроанилида (1 мг/мл) и исследуемого препарата и выдерживали при t = 30 °С в течение 30 мин, затем в реакционную смесь добавляли равный объем 10%-й уксусной кислоты для остановки реакции. Контрольная проба вместо БАПНА содержала воду. Оптическое поглощение полученного раствора выявляли на фотоколориметре Labsystems Uniskan (Финляндия) при длине волны 405 нм. Активность фермента выражали в оптических единицах (условные единицы ферментативной активности, Е). Активность ингибиторов трипсина определяли по методике Гофмана – Вайсблая с модификациями. Определение проводили аналогично ферментативной активности, буферный раствор содержал 1 мг/мл трипсина. Устанавливалась протеолитическая активность раствора (экстракт зерна исследуемых сортов в присутствии трипсина). При этом в прогретых образцах ферменты находились в денатурированном состоянии, т. е. собственной протеолитической активности в экстрактах не было. Во все пробы вносили равное количество трипсина. Исходя из того что значение протеолитической активности раствора (экстракт зерна исследуемых сортов в присутствии трипсина) напрямую зависит от подавляющей активности ингибиторов трипсина, был сделан вывод об ингибирующей активности зерна исследуемых сортов.
При определении активности уреазы в единицах рН на рН-метре использовался метод ГОСТ 13979.9-69. Статистическую обработку данных проводили, используя методы математической статистики с применением программного обеспечения Microsoft Excel (версия 2019 г.). При статистической обработке результатов исследований для каждого опытного образца стандартное отклонение не превышало 3,0 % при доверительной вероятности Р = 0,95.
Результаты и обсуждение
В результате проведенных ранее исследований по комплексной оценке качества сортов гороха (Чишминский 95, Чишминский 229 и Памяти Хангильдина) селекции Башкирского НИИСХ и фасоли сортов Омичка и Лукерья селекции Омского ГАУ осуществлена дифференциация сортов по целевому назначению. Установлено, что для производства альтернативных продуктов сложного сырьевого состава, в том числе напитков на растительной основе рекомендуется сорт гороха Памяти Хангильдина и фасоль сорта Омичка ( Вебер и др., 2022 ). Как уже отмечено ранее, биоактивация является этапом, влияющим на изменение биологической и пищевой ценности, органолептических показателей растительного сырья (табл. 1, рис. 2).
Таблица 1. Характеристика и органолептические показатели биоактивированного зерна гороха и фасоли исследуемых сортов
Table 1. Characteristics and organoleptic characteristics bioactivated grain of peas and beans of the studied varieties
|
Показатель |
Нативное зерно |
Биоактивированное зерно |
||
|
Горох, сорт Памяти Хангильдина |
Фасоль, сорт Омичка |
Горох, сорт Памяти Хангильдина |
Фасоль, сорт Омичка |
|
|
Внешний вид |
Форма шаровидная (семядоли желтые, рубчик светлый, закрыт остатком семядоли) |
Форма овальная |
Зерно выровненное, сферической формы |
Зерно шарообразной формы |
|
Ростки белого цвета длиной 2–3 мм; поверхность зерен – матовая, влажная |
||||
|
Консистенция |
Мучнистая, к моменту готовности (обработки) сохраняется целостность оболочек |
Мягкая, легко разжевывается, к моменту готовности (обработки) сохраняется целостность оболочек |
Мучнистая |
|
|
Цвет |
Желтый (с просвечивающими через семенную кожуру семядолями) |
Белый с серыми штрихами |
Ярко-желтый |
Бежевый |
|
Вкус |
Сладкий |
Сладковатый |
Сладковатый с солодовым послевкусием |
Солодовый с легким бобовым привкусом |
|
Запах |
Слабовыраженный запах гороха |
Слабовыраженный, специфический запах фасоли |
Легкий травянистый |
Легкий бобовый |

а б в г
Рис. 2. Зерно фасоли и гороха исследуемых сортов:
а – Памяти Хангильдина до биоактивации; б – Памяти Хангильдина после биоактивации; в – Омичка до биоактивации; г – Омичка после биоактивации
Fig. 2. Bean and pea grains of the studied varieties:
a – Memory of Khangildin before bioactivated; б – Memory of Khangildin after bioactivated;
в – Omichka before bioactivated; г – Omichka after bioactivated
В результате применения разработанных технологических режимов биоактивации установлены глубокие изменения биохимического состава зерна бобовых культур исследуемых сортов (табл. 2), протекающие под действием ферментного комплекса.
Таблица 2. Изменение биохимического состава зерна исследуемых сортов в результате процесса биоактивации
Table 2. Changes in the biochemical composition of grain studied varieties as a result of the bioactivation process
|
Показатель |
Горох, сорт Памяти Хангильдина |
Фасоль, сорт Омичка |
||
|
до \ |
после |
до \ |
после |
|
|
биоактивации |
биоактивации |
|||
|
Массовая доля влаги, % |
14,07 ± 0,110 |
43,65 ± 0,650 |
16,07 ± 0,110 |
43,43 ± 0,570 |
|
Массовая доля жира, % на с.в. |
1,56 ± 0,482 |
2,24 ± 0,010 |
1,67 ± 0,416 |
2,24 ± 0,192 |
|
Массовая доля крахмала, % на с.в. |
45,09 ± 2,141 |
37,26 ± 0,645 |
51,26 ± 0,475 |
43,20 ± 0,262 |
|
Массовая доля редуцирующих сахаров, % на с.в. |
0,84 ± 0,115 |
3,11 ± 0,159 |
0,44 ± 0,101 |
2,49 ± 0,012 |
|
Протеолитическая активность экстракта зерна исследуемых сортов в присутствии трипсина, Е |
167 ± 4,93 |
200 ± 7,50 |
111 ± 1,15 |
140 ± 2,00 |
|
Активность уреазы, ед. рН |
0,00 |
0,00 |
0,01 |
0,00 |
|
Переваримый белок, % |
52,48 ± 1,80 |
56,56 ± 0,10 |
49,48 ± 1,60 |
52,37 ± 0,11 |
|
Массовая доля белка, % на с.в. |
24,01 ± 2,493 |
27,69 ± 0,451 |
23,65 ± 0,437 |
27,19 ± 0,536 |
|
Фракционный состав белка, % от общего белка |
||||
|
Водорастворимый белок |
18,52 ± 0,45 |
25,56 ± 0,56 |
14,91 ± 0,30 |
19,00 ± 0,30 |
|
Солерастворимый белок |
77,85 ± 1,05 |
73,10 ± 1,05 |
82,82 ± 1,58 |
80,00 ± 1,60 |
|
Щелочерастворимый белок |
3,63 ± 0,04 |
1,34 ± 0,03 |
2,25 ± 0,05 |
1,00 ± 0,01 |
Данные табл. 1 и 2 свидетельствуют о различиях между образцами. Увеличение содержания редуцирующих сахаров, снижение количества крахмала на 17,36 и 15,72 % соответственно по отношению к исходным значениям свидетельствуют о деструкции и модификации крахмала.
Ингибирующая способность зерна фасоли существенно превышает ингибирующую активность зерна гороха как до, так и после биоактивации.
Применение разработанных методов позволяет полностью инактивировать фермент уреазу, снизить ингибиторную активность в пророщенном зерне гороха и фасоли на 19,76 и 26,12 % по отношению к исходным значениям, повысить переваримость белка зерна гороха на 7,77 и фасоли на 5,85 % по отношению к исходным значениям, а также, как было показано ранее, увеличить долю полиненасыщенной линолевой жирной кислоты ( Вебер и др., 2023 ). Аналогичные результаты, отражающие изменение активности ингибиторов трипсина в зерне фасоли в результате биоактивации, были обнаружены и другими учеными ( Катюк и др., 2019; Возиян и др., 2013 ).
Убедительным подтверждением модификации белкового комплекса является увеличение содержания белка в биоактивированном зерне гороха и фасоли на 15,32 и 14,96 % по отношению к исходным значениям, увеличение содержания водорастворимых белков на 38,01 % в зерне гороха и на 27,43 % в зерне фасоли по отношению к исходным значениям, снижение доли солерастворимой и щелочерастворимой фракций на 6,10 и 63,09 % по отношению к исходным значениям в горохе и на 3,40 и 55,55 % по отношению к исходным значениям в фасоли. Деструкция зерна в результате проращивания показана на фотографиях его микроструктуры (рис. 3).
Белки зерна при биоактивации набухают, становятся подвижными и переходят в раствор в виде коллоидов. Крахмальные гранулы теряют структуру и форму, разрушаются вследствие неоднородного набухания биополимеров. Появляется незначительное количество мелких и крупных скоплений декстринизированного крахмала, исчезают оформленные белково-жировые гранулы. Структурные изменения клеточных полимеров исследуемых сортов гороха и фасоли в результате биоактивации приводят к изменениям функционально-технологических свойств крахмала.
Учитывая, что в процессе биоактивации происходит увеличение протеолитической активности эндо-и экзопептидаз, белок бобовых культур структурно модифицируется, расщепляется до аминокислот и переходит в легкоусвояемое состояние. При исследовании аминокислотного состава нативного и биоактивированного зерна гороха и фасоли установлено, что у исследуемых сортов происходит интенсивное накопление всех аминокислот за исключением треонина. В результате определения биологической ценности белка исследуемых сортов до и после биоактивации путем расчета аминокислотного скора (АК) относительно стандартной шкалы ФАО/ВОЗ установлены количественные изменения лимитирующих аминокислот (табл. 3).


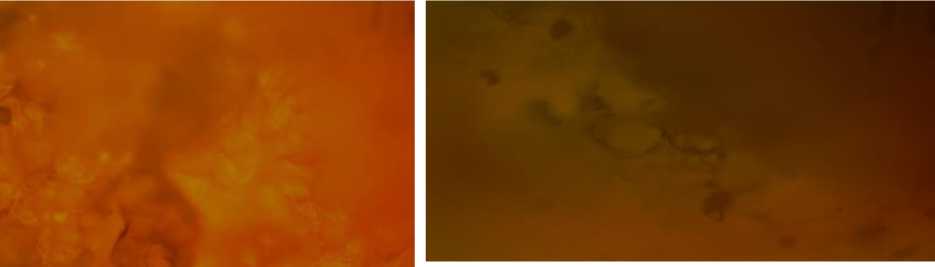
Рис. 3. Микроструктура зерна гороха и фасоли исследуемых сортов: а – Памяти Хангильдина до биоактивации; б – Памяти Хангильдина после биоактивации; в – Омичка до биоактивации; г – Омичка после биоактивации
Fig. 3. Microstructure of pea and bean grains of the studied varieties: а – Memory of Khangildin before bioactivation; б – Memory of Khangildin after bioactivation; в – Omichka before bioactivation;
г – Omichka after bioactivation
Таблица 3. Аминокислотный скор белка исследуемых сортов до и после биоактивации Table 3. Amino acid score of the protein of the studied varieties before and after bioactivation
|
Незаменимые аминокислоты (НАК) |
Горох, сорт Памяти Хангильдина |
Фасоль, сорт Омичка |
||||
|
до |
после |
до |
после |
|||
|
биоактивации |
биоактивации |
|||||
|
Аминокислотный скор, % |
||||||
|
Треонин |
119,90 |
86,33 |
123,05 |
58,30 |
||
|
Метионин + цистеин |
70,75 |
111,86 |
79,66 |
93,54 |
||
|
Валин |
87,59 |
91,18 |
13,38 |
15,72 |
||
|
Триптофан |
80,70 |
151,65 |
114,60 |
156,70 |
||
|
Фенилаланин + тирозин |
83,69 |
96,95 |
46,42 |
78,80 |
||
|
Изолейцин |
143,83 |
95,78 |
132,00 |
107,39 |
||
|
Лейцин |
89,39 |
88,82 |
||||
|
Лизин |
93,23 |
101,33 |
60,50 |
127,88 |
||
|
Гистидин |
28,23 |
32,23 |
24,22 |
26,64 |
||
Степень соответствия белка зерна гороха и фасоли эталонному белку ФАО/ВОЗ (рис. 4) увеличилась на 4,48 и 17,53 % соответственно, что позволяет говорить о большей полноценности белка биоактивированного зерна в сравнении с нативным, а также о целесообразности и эффективности использования разработанных параметров биоактивации.
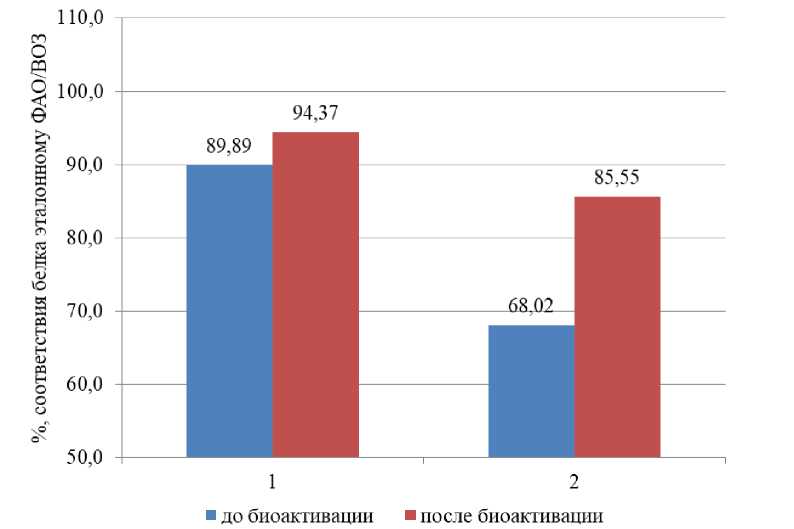
Рис. 4. Соответствие белка зерна эталонному белку ФАО/ВОЗ
(1 – горох сорт Памяти Хангильдина, 2 – фасоль сорт Омичка)
Fig. 4. Correspondence of grain protein to the FAO/WHO reference protein (1 – pea variety Memory of Khangildin, 2 – bean variety Omichka)
Обобщая полученные результаты, можно сделать вывод, что биоактивированное зерно гороха и фасоли является весьма перспективным сырьем для производства альтернативных продуктов питания сложного сырьевого состава, в том числе напитков на растительной основе.
Заключение
Установлены различия биохимического состава зерна гороха и фасоли исследуемых сортов до и после биоактивации.
Достигнутое в результате биоактивации зерна гороха и фасоли увеличение содержания белка на 15,32 и 14,96 % по отношению к исходным значениям, заменимых и незаменимых аминокислот за исключением треонина, водорастворимых белков на 38,01 и на 27,43 % по отношению к исходным значениям, снижение доли солерастворимой и щелочерастворимой фракций белка на 6,10 и 63,09 % по отношению к исходным значениям в горохе и на 3,40 и 55,55 % по отношению к исходным значениям в фасоли, а также снижение активности ингибиторов протеаз на 19,76 в горохе и на 26,12 % в фасоли по отношению к исходным значениям и повышение переваримости белка зерна гороха на 7,77 и фасоли на 5,85 % по отношению к исходным значениям способствует достижению повышенной пищевой и биологической ценности зерна.
Учитывая достигнутую степень модификации белково-углеводного комплекса, повышенную пищевую и биологическую ценность биоактивированного зерна гороха и фасоли, рекомендовано его применение в качестве основного сырья для производства альтернативных продуктов сложного сырьевого состава, в том числе напитков на растительной основе.
Выражаем благодарность доктору сельскохозяйственных наук, профессору, заместителю директора по научной работе Башкирского НИИ сельского хозяйства Ф. А. Давлетову за предоставленные селекционные сорта гороха и доктору сельскохозяйственных наук, профессору Омского ГАУ Н. Г. Казыдуб за предоставленные селекционные сорта фасоли.


