Изменения кардиогемодинамики и нарушения ритма сердца у пациентов после коронавирусной инфекции
Автор: Чистякова М. В., Говорин А. В., Гончарова Е. В., Кушнаренко Н. Н., Мудров В. А., Калинкина Т. В., Кудрявцева Я. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
Цель изучить нарушения ритма сердца и морфофункциональные изменения у пациентов через 3 мес. после перенесенной коронавирусной инфекции.Материал и методы. 96 больным, средний возраст 36 лет, пролеченным по поводу коронавирусной инфекции, через 3 мес. провели эхокардиографию, холтеровское мониторирование электрокардиограммы (ХМЭКГ). Пациентов разделили на группы в зависимости от степени поражения легочной ткани по данным компьютерной томографии (КТ): 1-я - 27 пациентов, КТ0, 2-я - 39 больных, КТ1-2, 3-я - 30 больных, КТ3-4; 22 пациента - контрольная группа. Статистика: учитывая распределения признаков, отличное от нормального, использовали непараметрические методы проверки гипотез.Результаты. У больных, перенесших коронавирусную инфекцию, через 3 мес. выявлено нарушение проводимости ритма сердца. Установлено повышение активности симпатического отдела вегетативной нервной системы (ВНС) (LF/HF): у пациентов 2-й группы значение медианы составило 5,9, в 3-й группе - 6,0; кроме того, снижался глобальный продольный систолический стрейн левого желудочка (ЛЖ) (-17,7 и -17,2 соответственно). У больных КТ3-4 повышалось систолическое давление в легочной артерии (37,0 мм рт. ст.), увеличивался размер левого предсердия, уменьшался сегментарный систолический стрейн ЛЖ в сравнении с изучаемыми группами (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Нарушение ритма, сердце, морфофункциональные изменения, левый желудочек
Короткий адрес: https://sciup.org/149144422
IDR: 149144422 | УДК: 616.98:578.834.1]-06:616.12-008.318:616.124.2 | DOI: 10.29001/2073-8552-2023-38-4-151-158
Текст научной статьи Изменения кардиогемодинамики и нарушения ритма сердца у пациентов после коронавирусной инфекции
УДК 616.98:578.834.1]-06:616.12-008.318:616.124.2
Известно, что коронавирусная инфекция (СOVID-19) является причиной увеличения числа обращений по поводу болезней системы кровообращения [1, 2]. Показано проникновение вируса в эндотелий сосудов с диффузным их поражением, воспалением, нарушением гемостаза и образованием микротромбов [1]. Эндотелиальная дисфункция рассматривается как универсальный пусковой фактор развития миокардита, кардиомиопатии и сердечной недостаточности [2, 3]. Кроме того, известен высокий тропизм вируса к кардиомиоцитам, SARS-CoV-2 обнаружен в аутопсии сердечной ткани у пациентов, умерших от инфекции. А также установлено наличие вирусных частиц в кардиомиоцитах и клетках эндокарда при помо- щи электронной микроскопии у пациентов, перенесших СOVID-19 [4, 5].
Согласно данным литературы, повреждение миокарда остается нередко не диагностированным. Так, при обследовании спортсменов после перенесенной SARS-CoV-2 частота клинически выраженного миокардита составила 0,31%, после проведения диагностики сердца с помощью магнитно-резонансной томографии (МРТ) частота миокардита увеличилась в 7,4 раза [6]. Около 78% пациентов, перенесших SARS-CoV-2 не менее чем две недели назад, получивших отрицательный результат на наличие вируса SARS-CoV-2 и не имеющих респираторных симптомов, имели различные изменения на МРТ сердца, а также выпот в полости перикарда [7, 8].
При изучении сердечно-сосудистой системы в отдаленном периоде (через год после заболевания) впервые выявлялись изменения геометрии желудочков сердца, сопровождающиеся нарушением их функции, увеличением частоты развития артериальной гипертензии и сердечной недостаточности [9]. Кроме того, у больных, перенесших коронавирусную инфекцию, были выявлены такие заболевания, как артериит, тромбоваскулит, перикардит и эндокардит [10, 11].
Между тем наиболее частыми осложнениями коронавирусной инфекции являются нарушения ритма сердца. Известно, что у пациентов, перенесших СOVID-19, возможно развитие как тахи-, так и брадиаритмий, фибрилляции предсердий, развитие желудочковой экстрасистолии, пароксизмальной наджелудочковой тахикардии [12] и удлинение интервала QT [13].
Цель нашего исследования: изучение нарушения ритма сердца и морфофункциональных изменений у пациентов через 3 мес. после перенесенной коронавирусной инфекции.
Материал и методы
96 пациентам, пролеченным по поводу коронавирусной инфекции, через 98,0 (92,0; 103,0) дней после установления диагноза провели эхокардиографию с тканевым допплеровским исследованием и холтеровское мониторирование электрокардиограммы (ХМЭКГ). Вирусный генез поражения был лабораторно подтвержден (носоглоточный ПЦР РНК коронавируса SARS-CoV -2 положительный). Все переболевшие коронавирусной инфекцией до болезни были практически здоровые, хронические заболевания, патологию сердечно-сосудистой системы отрицали. Набор пациентов осуществляли в период с июня по ноябрь 2020 г.
У большинства больных была двухсторонняя, поли-сегментарная, вирусно-бактериальная пневмония, по данным компьютерной томографии (КТ). Всех участников исследования разделили на 3 группы в зависимости от степени поражения легочной ткани, по данным компьютерной томографии (КТ): 1-я группа включала 27 пациентов с КТ0; 2-я группа – 39 пациентов с КТ1-2; 3-я – 30 больных с тяжелым течением КТ3 (19 человек) и КТ4 (11 пациентов). Возраст больных 1-й группы составил 35,5 [23,0; 47,0] лет, 2-й – 35,9 [35,2; 48,0] лет, 3-й – 36,7 [35,3; 47,4] лет. В 3-й группе большинство больных – 17 (56%) – имели избыточный вес, их индекс массы тела составил 25,2 [22,7; 27,4] кг/м2, тогда как в 1-й группе – 22,5 [21,7; 23,4] кг/м2 ( р 1-3 = 0,001), во 2-й – 23,4 [21,6; 24,8] кг/м2 ( р 2-3 = 0,04). Контрольная группа включала 22 здоровых добровольца соответствующего возраста, не привитых и не переносивших COVID-19 (набор контрольной группы осуществляли в августе 2020 г).
Пациенты 1-й группы принимали противовирусные препараты, витамин С, диазолин. Больные 2-й и 3-й групп получали антибиотики из группы макролидов, цефалоспорины III поколения, антикоагулянты, отхаркивающие и противовирусные препараты. Кроме того, 32% пациентам 2-й группы и всем больным 3-й группы был назначен гидроксихлорохин по схеме. Лечение исследуемых проводилось согласно временным рекомендациям 13-й версии МЗ РФ по профилактике, диагностике и лечению новой коронавирусной инфекции, действующим до 22 февраля 2022 г. Необходимо отметить, что в настоящий момент препарат гидроксихлорохин исключен из перечня реко- мендуемой терапии на всех стадиях заболевания.
В исследование не включали пациентов старше 48 лет, лиц с заболеваниями сердца и тяжелой сопутствующей патологией.
Выполняли допплер-эхокардиографию по стандартной методике на аппарате VIVID Е95. Размеры левого предсердия изучали по длинной оси левого желудочка (ЛЖ) и в апикальной позиции. Систолическое давление в легочной артерии изучали по скорости трикуспидальной регургитации.
Глобальную продольную деформацию ЛЖ исследовали методом не-допплеровского режима двухмерной серошкальной деформации из верхушечного доступа, регистрировали миокард с оптимальной визуализацией всех сегментов, с частотой кадров от 50 до 80 в секунду при стабильной регистрации ЭКГ. Четко трассировали эндокард, эпикардиальная поверхность трассировалась автоматически. Программа рассчитывала смещение картины пятен в пределах зоны интереса на протяжении сердечного цикла. После оптимизации зоны интереса программным обеспечением генерировались кривые стрейна для каждого сегмента.
ХМЭКГ проводили при помощи комплекса Аstrocard. Анализ показателей вариабельности ритма сердца (ВРС) осуществлялся в соответствии с рекомендациями Европейского общества кардиологов и Северо-Американского общества по электростимуляции и электрофизиологии. ВРС изучали на основе статистического анализа, полученного при холтеровском мониторировании 24-часовой записи ЭКГ с расчетом следующих показателей:
-
1) временных: средней частоты сокращений сердца в 1 мин, стандартного отклонения от средней продолжительности синусовых интервалов RR (SDNN), среднего стандартного отклонения RR всех 5-минутных фрагментов записи (SDANN), средней стандартных отклонений от средних значений длительности интервалов RR всех 5-минутных участков записи ЭКГ (индекс SDNN), среднеквадратического отклонения средней суммы квадратов различий между продолжительностью соседних интервалов RR (RMSSD), процента последовательных интервалов RR, различающихся более чем на 50 мс (pNN50);
-
2) спектральных, полученных с помощью быстрого преобразования Фурье: мощности спектра ВРС в диапазоне высоких частот (0,15–0,40 Гц) – HF, мощности спектра ВРС в диапазоне низких частот (0,04–0,15 Гц) – LF, отношения LF/HF.
Протокол исследования был одобрен этическим комитетом ЧГМА. До включения в исследование у всех участников было получено письменное информированное согласие.
Статистическая обработка результатов исследования осуществлялась с помощью пакета программ IBM SPSS STATISTICS Version 25.0. Проверка нормальности распределения количественных признаков проводилась по критерию Шапиро – Уилка. С учетом того, что распределение признаков отличалось от нормального во всех исследуемых группах, полученные данные представлены в виде медианы и межквартильного промежутка, Me [Q1; Q3]. Категориальные показатели представлены абсолютными (n) и относительными (в %) частотами встречаемости. Для сравнения количественных признаков в независимых 1–4-й группах использовался критерий Краскела – Уоллиса. При наличии статистически значимых различий проводились попарные апостериорные сравнения с помощью критерия Манна – Уитни с учетом поправки Бонферрони. Корреляционный анализ выполнен с помощью коэффициента корреляции Спирмена. Для сравнения номинальных показателей в группах использовали критерий χ2 Пирсона. Пороговый уровень значимости при проверке статистических гипотез составлял р = 0,05 [14].
Результаты
При обследовании пациентов через 3 мес. – 98,0 (92,0;103,0) дней после установления диагноза «новая коронавирусная инфекция (СOVID-19)» – переболевшие жаловались на боли, чувство тяжести в области сердца: 2 (7%) в 1-й группе, 4 (10%) во 2-й, 5 (16,6%) человек в 3-й группе ( χ2 = 1,3; df = 2; p = 0,52). Артериальная гипертензия выявлена у 4 (14,8 %) больных в 1-й группе, 6 (15,3 %) пациентов во 2-й и 11 (36,6 %) в 3-й группе ( χ2 = 5,6; df = 2; p = 0,06). Стойкую гипотензию отмечали 2 (6%) представителей 3-й группы ( χ2 = 4,5; df = 2; p = 0,11).
Когнитивные расстройства, в частности нарушение памяти, внимания, наблюдались у 4 (13,3%) пациентов 3-й группы ( χ2 = 9,2; df = 2; p = 0,01). На нарушение сна жаловались 16 (59,2%) пациентов 1-й группы, 21 (71%) пациент 2-й и 26 (86,6%) больных 3-й группы ( χ2 = 8,8; df = 2; p = 0,01). Было показано, что через 3 мес. после заболевания клинически выраженная тревога была у 4 (10,2%) пациентов 2-й группы и у 7 (23,3%) 3-й группы, при этом уровень депрессии у всех находился в пределах нормальных значений ( χ2 = 7,7; df = 2; p = 0,02) (оценивали по шкале HADS).
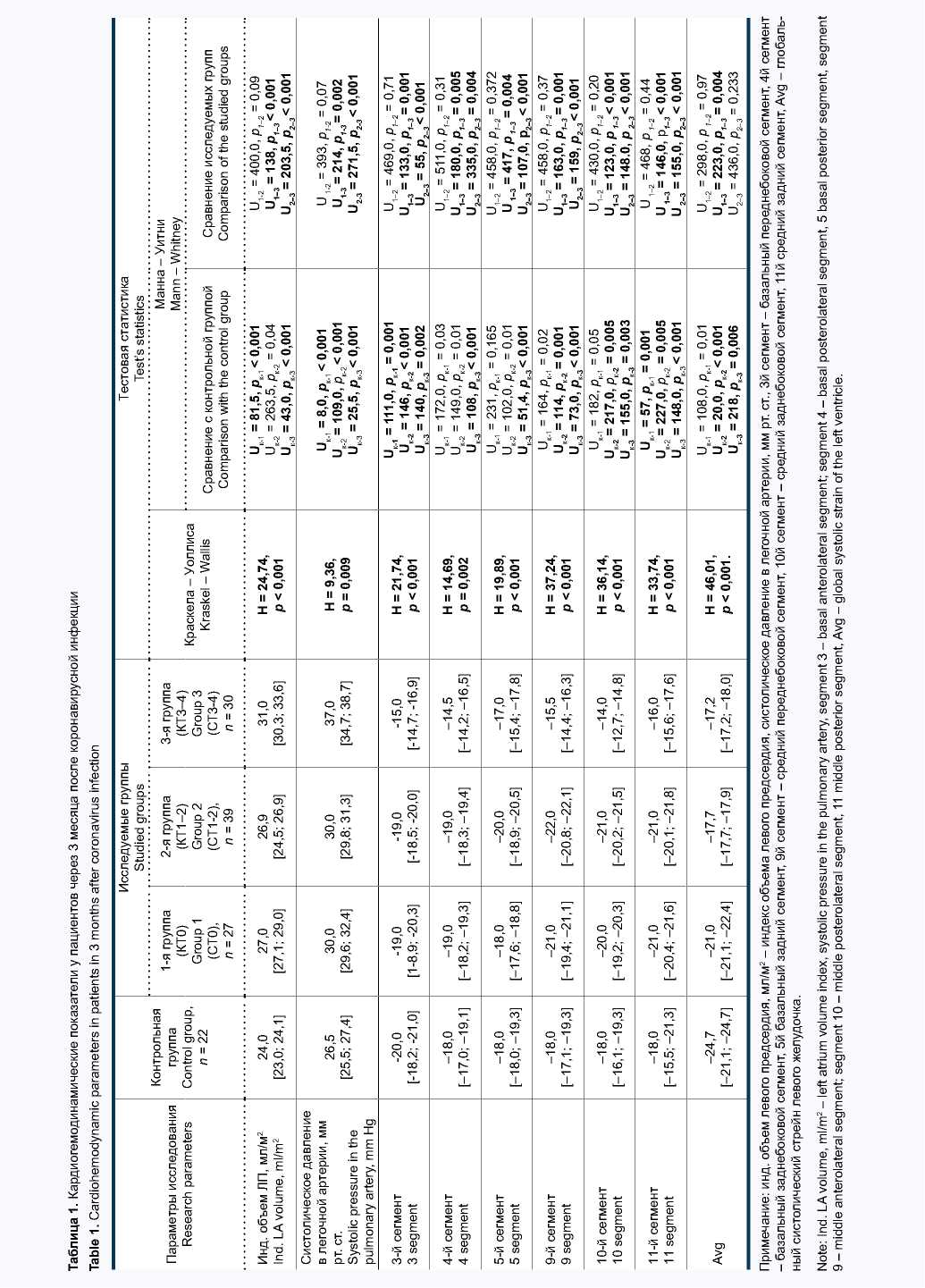
При анализе структурно-функциональных показателей сердца после перенесенной коронавирусной инфекции отмечалось увеличение индексированного объема левого предсердия во всех исследуемых группах по сравнению с контрольной группой. При этом данный показатель у больных 3-й группы составил 31 мл/м2 и был на 16% больше, чем у пациентов 2-й группы (табл. 1). Систолическое давление в легочной артерии у пациентов с КТ3–4 составило 37,0 [36,5; 38,6] мм рт. ст., что характеризует наличие умеренной легочной гипертензии.
При изучении продольной деформации ЛЖ у пациентов 3-й группы отмечалось снижение сегментарного систолического стрейна в базальных и медиальных (переднебоковом, заднебоковом и заднем) сегментах ЛЖ. Кроме того, у пациентов 2-й и 3-й групп было установлено снижение глобального систолического стрейна ЛЖ.
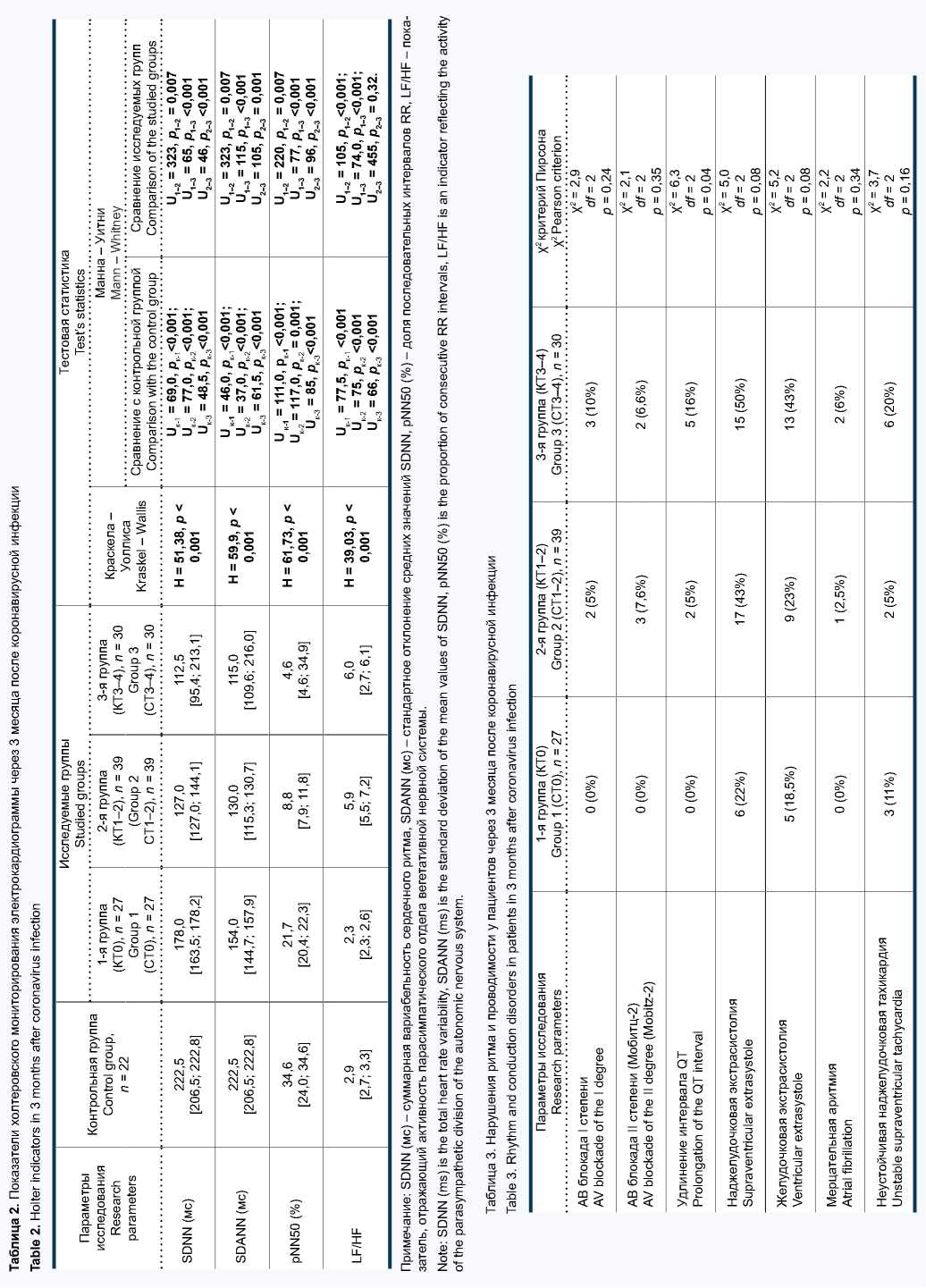
При изучении ВРС у больных, перенесших коронавирусную инфекцию, было выявлено снижение параметра SDNN, отражающего общую (суммарную) ВРС и показателя SDАNN (стандартное отклонение средних значений SDNN за 5-минутные сегменты 24-часовой записи) по сравнению со здоровыми лицами. Также отмечалось снижение показателя pNN50 (%), характеризующего долю последовательных интервалов RR, различие между которыми превышает доля последовательных интервалов 50 мс%, свидетельствующего о влиянии парасимпатического отдела вегетативной нервной системы (ВНС). Напротив, у пациентов 2-й и 3-й групп отмечалось повышение параметра LF/HF – характеризующего повышение активности симпатического отдела ВНС (табл. 2).
По данным ХМЭКГ, у пациентов 2-й и 3-й групп была установлена атриовентрикулярная (АВ) блокада I и II степени (табл. 3). Кроме того, у всех переболевших ко- ронавирусной инфекцией установлены желудочковые и наджелудочковые нарушения ритма сердца.
Установлена корреляционная зависимость между глобальным систолическим стрейном ЛЖ и параметром SDNN ( r = 0,54; p < 0,001), показателем интервала QT ( r = 0,67; p < 0,001) и тяжестью заболевания (КТ3 – 4) ( r = 0,73; p < 0,001).
Обсуждение и заключение
Таким образом, у больных, перенесших коронавирусную инфекцию, через 3 мес. отмечается нарушение ритма сердца. У пациентов с умеренной и тяжелой степенью выраженности заболевания также установлено повышение активности симпатического отдела ВНС, снижался глобальный продольный систолический стрейн ЛЖ. Кроме того, у больных КТ3–4 повышалось систолическое давление в легочной артерии, увеличивался размер левого предсердия и уменьшался сегментарный систолический стрейн ЛЖ.
Учитывая полученные нами данные, можно предположить, что у пациентов, перенесших COVID-19, происходит повреждение эндотелия сосудистого русла [1, 15] вследствие системного повышения провоспалительных цитокинов с развитием отека эндотелия, его дисфункцией и формированием повреждения сердечной мышцы. Возможно, что в результате репликации вируса в клетках миокарда происходит его поражение с развитием микроангиопатий и тромбозов, нарушением клеточной функции и развитием фиброза миокарда [1, 3], что проявляется повышенной жесткостью, снижением глобальной и сегментарной продольной деформации ЛЖ. В основе легочной гипертензии, вероятно, лежит длительно сохраняющийся эндотелиит сосудов малого круга кровообращения вследствие активности факторов воспаления, цитокинов и иммунных комплексов [1, 2].
Кроме того, возможно и развитие постковидных изменений в легких с формированием фиброза, что способствует сохранению легочной гипертензии после «выздоровления» и ремоделированию левого предсердия. Гипоксия и электролитные нарушения, развивающиеся из-за поражения легких, гиперактивность симпатической нервной системы, а также асинхронизация между сегментами вследствие разницы в активации миокарда в условиях повышенной постнагрузки предрасполагают к развитию аритмий и нарушению проводимости в сердце [11]. Применение препаратов для лечения коронавирусной инфекции, таких как гидроксиксихлорохин, антибиотики, противовирусные средства, способствует удлинению интервала QT с возможным развитием полиморфной желудочковой тахикардии и внезапной смерти [13]. Наличие избыточного веса у большинства тяжелых больных также может быть причиной кардиогемодинамических изменений.
Установленные корреляционные связи, вероятно, подтверждают, взаимосвязь дисфункции ЛЖ и нарушения ВРС, а также удлинение интервала QT.
Таким образом, у пациентов через 3 мес. после перенесенной коронавирусной инфекции выявлены нарушения ритма сердца. У пациентов с умеренной и тяжелой степенью выраженности заболевания также повышается активность ВНС, снижается глобальный систолический стрейн ЛЖ. Кроме того, у больных КТ3 – 4 повышено систолическое давление в легочной артерии, увеличен размер левого предсердия, снижен сегментарный систолический стрейн ЛЖ.
Список литературы Изменения кардиогемодинамики и нарушения ритма сердца у пациентов после коронавирусной инфекции
- Libby P., Lüscher T. COVID-19 is, in the end, an endothelial disease. Eur. Heart J. 2020;41(32):3038-3044. https://doi.org/10.1093/eurheartj/ehaa623.
- Идрисова Г.Б., Галикеева А.Ш., Шарафутдинов М.А., Зиннурова А.Р., Валиев А.Ш. Особенности проявлений хронических заболеваний после перенесенной коронавирусной инфекции COVID-19. Уральский медицинский журнал. 2022;21(3):15-20. https://doi.org/10.52420/2071-5943-2022-21-3-15-20.
- Xiong T.Y., Redwood S., Prendergast B., Chen M. Coronaviruses and the cardiovascular system: acute and long-term implications. Eur. Heart J. 2020;41(19):1798-1800. https://doi.org/10.1093/eurheartj/ehaa231.
- Basso C., Leone O., Rizzo S., De Gaspari M., van der Wal A.C., Aubry M.C. et al. Pathological features of COVID-19-associated myocardial injury: a multicentre cardiovascular pathology study. Eur. Heart J. 2020;41(39):3827-3835. https://doi.org/10.1093/eurheartj/ehaa664.
- Dolhnikoff M., Ferreira Ferranti J., de Almeida Monteiro R.A., Duarte-Neto A.N., Soares Gomes-Gouvêa M., Viu Degaspare N. et al. SARSCoV-2 in cardiac tissue of a child with COVID-19-related multisysteminfl ammatory syndrome. Lancet Child Adolesc. Health. 2020;4(10):790-794. https://doi.org/10.1016/S2352-4642(20)30257-1.
- Daniels C.J., Rajpal S., Greenshields J.T., Rosenthal G. L., Chung E.H., Terrin M. et al. Prevalence of clinical and subclinical myocarditis in competitive athletes with recent SARS-CoV-2 Infection: Results from the bigten COVID-19 cardiac registry. JAMA Cardiol. 2021;6(9):1078-1087. https://doi.org/10.1001/jamacardio.2021.2065.
- Puntmann V.O., Carerj M.L., Wieters I., Fahim M., Arendt C., Hoffmann J. et al. Outcomes of cardiovascular magnetic resonance imaging in patients recently recovered from coronavirus disease 2019 (COVID-19). JAMA Cardiol. 2020;5(11):1265-1273. https://doi.org/10.1001/jamacardio.2020.3557.
- Шелковникова Т.А., Максимова А.С., Рюмшина Н.И., Мочула О.В., Ваизов В.Х., Усов В.Ю. и др. Обобщенный портрет пациента одного кардиологического центра в период пандемии COVID-19 по данным магнитно-резонансной томографии сердца с парамагнитным контрастным усилением. Сибирский журнал клинической и экспериментальной медицины. 2022;37(4):105-113. https://doi.org/10.29001/20738552-2022-37-4-105-113.
- Ярославская Е.И., Криночкин Д.В., Широков Н.Е., Горбатенко Е.А., Гультяева Е.П., Гаранина В.Д. и др. Клинико-эхокардиографический профиль пациентов, перенесших пневмонию COVID-19, через год после выписки в зависимости от глобальной продольной деформации левого желудочка. Сибирский журнал клинической и экспериментальной медицины. 2022;37(4):52-62. https://doi.org/10.29001/2073-8552-2022-37-4-52-62.
- Lindner D., Fitzek A., Bräuninger H., Aleshcheva G., Edler C., Meissner K. et al. Association of cardiac infection with SARS-CoV-2 in confirmed COVID-19 autopsy cases. JAMA Cardiol. 2020;5(11):1281- 1285. https://doi.org/10.1001/jamacardio.2020.3551.
- Kogan E., Berezovskiy Y., Blagova O., Kukleva A., Semyonova L., Gretsov E. et al. Morphologically, immunohistochemically and PCR proven lymphocytic viral peri-, endo-, myocarditis in patients with fatal COVID-19. Diagn. Pathol. 2022;17(1):31. https://doi.org/10.1186/s13000-02201207-6.
- Gopinathannair R., Merchant F.M., Lakkireddy D.R., Etheridge S.P., Feigofsky S., Han J.K. et al. COVID-19 and cardiac arrhythmias: A global perspective on arrhythmia characteristics and management strategies. J. Interv. Card. Electrophysiol. 2020;59(2):329-336. https://doi.org/10.1007/ s10840-020-00789-9.
- Орлов Ф.А., Зайцев А.А., Кубенский Г.Е., Пантюхова Т.Н. Оценка длительности интервала QT у пациентов с COVID-19 на фоне лечения гидроксихлорохином и азитромицином. Consilium Medicum. 2020;22(12):15-19. https://doi.org/10.26442/20751753.2020.12.200540.
- Мудров В.А. Алгоритмы статистического анализа количественных признаков в биомедицинских исследованиях с помощью пакета программ SPSS. Забайкальский медицинский вестник. 2020;(1):140- 150. https://doi.org/10.52485/19986173_2020_1_140.
- Гамаюнов Д.Ю., Калягин А.Н., Синькова Г.М., Рыжкова О.В., Варавко Ю.О. Постковидный синдром и хроническая сердечная недостаточность: актуальные вопросы. Доктор.Ру. 2022;21(6):13-18. https://doi.org/10.31550/1727-2378-202221-6-13-18.


