Изменения синовиальной оболочки у больных ревматоидным артритом при артроскопии
Автор: Комарова Е.Б.
Журнал: Научно-практическая ревматология @journal-rsp
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.55, 2017 года.
Бесплатный доступ
В синовиальной оболочке (СО) на разных стадиях ревматоидного артрита (РА) могут преобладать экссудативные или пролиферативные процессы, сопровождающиеся деструкцией сустава. Особенности изменений СО следует учитывать при ранней диагностике РА и разработке комплексной терапии заболевания. Цель исследования - изучить изменения СО при артроскопии у больных с различной длительностью РА и разным уровнем антител к циклическому цитруллинированному пептиду (АЦЦП) в крови. Материал и методы. Артроскопия была выполнена 37 пациентам с РА, использовался артроскоп (Karl Storz GmbH, Германия) диаметром 2,4 мм с углом 30°. У 17 больных продолжительность РА была 2 лет преобладает ворсинчатая гиперплазия с образованием булавовидных ворсин (р60 Ед/мл ассоциировались с преобладанием воспалительной гиперплазии (р
Ревматоидный артрит, синовиальная оболочка, артроскопия, длительность заболевания, антитела к циклическому цитруллинированному пептиду
Короткий адрес: https://sciup.org/14945817
IDR: 14945817 | DOI: 10.14412/1995-4484-2017-241-244
Текст научной статьи Изменения синовиальной оболочки у больных ревматоидным артритом при артроскопии
For reference: Komarova EB. Synovial membrane changes in patients with rheumatoid arthritis revealed during arthroscopy. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2017;55(3):241-244 (In Russ.).
doi:
Синовиальная оболочка (СО) при ревматоидном артрите (РА) инфильтрирована большим количеством лимфоцитов и плазматических клеток. Она играет важную роль в патогенезе РА и может производить большое количество биологических агентов (комплемент, иммуноглобулины, цитокины, факторы роста, металлопротеиназы), ответственных за тканевое воспаление и повреждение (образуется паннус, возникают эрозии хряща и развивается деструкция костной ткани) [1, 2]. Артроскопия коленных суставов позволяет выявлять изменения СО, связанные с развитием хронического воспаления. При осмотре СО обращают внимание на цвет,
отечность, сосудистый рисунок, патологические включения на ее поверхности и в более глубоких слоях, на количество, форму, размеры и строение синовиальных ворсин. СО в норме, как правило, розового цвета, гладкая и прозрачная, с выразительным неярким рисунком тонкой сосудистой сети. При остром синовите наблюдаются выраженный отек, яркая или с застойным оттенком гиперемия СО, пролиферация и гипертрофия ее ворсин. Хронический синовит характеризуется застойной гиперемией, гиперплазией, склерозом и потерей прозрачности синовиального покрова; при разрастании ворсины приобретают булавовидную форму [3, 4].
Артроскопия является минимально инвазивной техникой, безопасной и эффективной для визуализации и биопсии СО в ревматологии. Она применяется как с диагностической (осмотр и биопсия СО с последующим гистологическим исследованием), так и с лечебной целью (синовэктомия в сочетании с дебридментом сустава), что является важным методом лечения хронического синовита при РА [4, 5]. Некоторые исследования показали, что воспалительные изменения СО коррелируют с клинической картиной, с рентгенологическими изменениями, а также с длительностью РА [6, 7]. Одним из основных иммунологических маркеров для ранней диагностики РА являются антитела к циклическому цитруллинированному пептиду (АЦЦП). Кроме того, АЦЦП служат предиктором тяжелого течения РА [8, 9].
Особенности изменений СО могут учитываться при проведении диагностики и разработке комплексной терапии РА.
Таблица 1 Протокол оценки СО сустава у больных РА при артроскопии
Баллы
Признаки
Гиперплазия синовиальной оболочки
0 – нет Гладкая поверхность оболочки
-
1 – незначительная Незначительный отек
-
2 – умеренная Значительный отек
-
3 – выраженная Синовиальная ткань образует складки
-
4 – резко выраженная Массивная ткань СО затрудняет осмотр
0 – отсутствует
1 – незначительная
-
2 – умеренная
-
3 – выраженная
-
4 – резко выраженная
-
Гиперемия СО
Сосуды четкие, тонкие, просматриваются Сосуды четкие, тонкие, акцент яркого рисунка Сосуды четкие, яркие, ровные и изогнутые, местами с лакунами Контуры сосудов нечеткие, рисунок сливается, много лакун Контуры сосудов плохо просматриваются, много лакун, густой красный цвет, местами цианоз
Атрофические изменения СО
0– нет
1 – незначительные
-
2 – умеренные
-
3 – выраженные
-
4 – резко выраженные
Синовиальная ткань нежно-розового цвета Сосудистый рисунок незначительный, но просматривается без пробелов Слабая васкуляризация, аваскулярные очаги желтоватого и беловатого цвета Аваскулярные поля
Желтая или белая аваскулярная вялая ткань
0– нет
1 – ворсинчатая
2 – смешанная
-
3 – комбинированная
0 – отсутствует
-
1 – слабо выраженый
-
2 – умеренный
-
3 – выраженный
-
4 – массивный
0– нет
-
1 – мелкие пластины
-
2 – массивные сгустки
Тип гиперплазии СО
Поверхность оболочки лишена ворсин Поверхность оболочки полностью покрыта ворсинами Ворсинчатая и безворсинчатая гиперплазия в одном отделе сустава
Выросты гиперплазированной оболочки покрыты ворсинами
Паннус
Нежная грануляционная ткань в области периферических отделов мениска Расширяется на мениски и поверхность суставного хряща Поглощает мениски
Расширяется на плато большеберцовой кости Фибрин
Цель исследования – изучить особенности СО коленного сустава при артроскопии у больных с различной длительностью РА и разным уровнем АЦЦП в крови.
Материал и методы
В исследование были включены 37 пациентов с РА; верификация диагноза согласно критериям Американской коллегии ревматологов/Европейской антиревмати-ческой лиги (АСR/EULAR) 2010 г. Среди обследованных преобладали женщины (84%), средний возраст составлял 41,3±11,4 года. У 17 (46%) пациентов продолжительность РА была <2 лет (средний возраст – 42,8±10,2 года, длительность заболевания – 12,8±7,6 мес); у 20 (54%) она варьировала от 2 до 8 лет (средний возраст – 46,2±12,3 года, длительность заболевания – 5,8±1,8 года). Уровень АЦЦП в крови определяли иммуноферментным методом (Orgentec, Германия). У 15 (40,5%) пациентов он не превышал 60 Ед/мл, у 22 (59,5%) был более высоким. Пациенты сравниваемых групп статистически не различались по клинико-демографическим показателям.
Все артроскопии были выполнены в одной и той же стерильной операционной, использовался артроскоп (Karl Storz GmbH, Tuttlingen, Германия) диаметром 2,4 мм с углом 30°. Артроскопия коленного сустава осуществлялась по стандартной методике: после обезболивания кожи и капсулы сустава 10–15 мл 1% раствора лидокаина делали два доступа (через разрез на коже длиной 4–5 мм) – верхнелатеральный и медиальный. Положение пациента было на спине, коленный сустав сгибали под углом 40° и заключали в подколенную подставку. Осматривали все отделы сустава, промывание сустава для визуализации проводили на протяжении всей процедуры, но сведено к минимуму (обычно от 500 до 1000 мл). После процедуры артроскопии на разрезы кожи накладывали стерильные повязки, на область колена – фиксирующую повязку. Вся процедура артроскопии записывалась на видео для последующей оценки изменений коленного сустава.
Исследование выполнено в соответствии с Хельсинкской декларацией, принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия), и одобрено этическим комитетом ГУ «Луганский государственный медицинский университет». Все пациенты подписали информированное согласие на участие в исследовании.
Протокол оценки артроскопических изменений СО суставов больного РА разработан на основе имеющихся методик [3] и собственного опыта (табл. 1).
Статистическую обработку данных осуществляли с помощью непараметрических методов на персональном компьютере с использованием пакетов лицензионных программ Statistica (Stat-Soft, США). Оценивали медиану (Ме), 25-й и 75-й перцентили, критерий Манна–Уитни (Z), статистически значимые различия определяли при уровне р<0,05.
Результаты
Результаты анализа изменений СО коленного сустава в зависимости от длительности РА представлены в табл. 2.
Выраженность воспалительной гиперплазии СО в сравниваемых группах была практически одинакова. При меньшей длительности РА гиперемия была более значительной. Большая длительность РА ассоциировалась с более выраженной ворсинчатой гиперплазией (булаво- видные ворсины; р<0,05). Прослеживалась тенденция к большей распространенности атрофических изменений при большей длительности РА, однако эти различия не достигали статистической значимости. У больных с разной длительностью РА не было выявлено достоверных различий и по степени развития паннуса. При меньшей длительности РА в полости коленных суставов, выявлялось большее количество фибрина (р<0,05).
Таким образом, у пациентов с длительностью РА <2 лет преобладает гиперемия СО с выраженным сосудистым рисунком (рис. 1), которая сопровождается накоплением фибрина (рис. 2). У больных с длительностью РА >2 лет преобладает ворсинчатая гиперплазия СО с образованием булавовидных ворсин (рис. 3).
При АЦЦП >60 ед/мл отмечались достоверно более выраженные воспалительная гиперплазия (р<0,01) и гиперемия (р<0,05) СО, чем при меньших значениях этого показателя (табл. 3). Разрастание паннуса (рис. 4) также было более значительным при АЦЦП >60 ед/мл (р<0,01). В то же время наличие ворсинчатой гиперплазии и количество фибрина при разных уровнях АЦЦП существенно не различались (см. рис. 4)
Обсуждение
Существуют методологические и классификационные подходы к оценке состояния внутрисуставного хряща при артроскопии у больных остеоартритом на разных стадиях, но без оценки СО [10]. Шведскими учеными был разработан артроскопический счет изменения СО при синовитах коленного сустава, который включал оценку гипертрофии, васкуляризации и гиперемии в баллах (0 – изменений нет, 4 – максимальные изменения) [4], однако это не отражало полную картину воспалительно-пролиферативных процессов в СО. В нашем исследовании были использова- ны критерии для оценки как воспалительно-экссудативных, так и пролиферативных процессов в СО при артроскопии у больных РА.
Ангиогенез является важным этапом патогенеза РА на ранних стадиях, обеспечивая миграцию иммуновос-палительных клеток в СО, снабжение питательными веществами и кислородом пролиферирующей ткани. Увеличенная площадь эндотелиальной поверхности также создает огромный потенциал для продукции цитокинов, молекул адгезии и факторов роста, что способствует развитию пролиферативно-деструктивных процессов в СО с формированием костно-хрящевых эрозий [11, 12]. В нашем исследовании у больных ранним РА преобладали процессы воспалительной гиперемии и васкуляризации СО, а также накопление фибрина, тогда как у больных с длительным течением РА превалирует гиперплазия СО. Ряд авторов подчеркивают, что именно в начале РА в СО интенсивно протекают процессы ангиогенеза и вос-
Таблица 2
Изменения СО суставов в зависимости от длительности РА, Ме [25-й; 75-й перцентили]
|
Признаки |
Длительность РА |
p |
|
|
<2 лет (n=17) |
≥ 2 лет (n=20) |
||
|
Воспалительная гиперплазия СО |
2 [1; 3] |
2 [1; 4] |
0,85 |
|
Гиперемия и выраженный сосудистый рисунок СО |
3 [1; 4] |
2 [1; 3] |
0,014 |
|
Ворсинчатая гиперплазия СО |
2 [1; 3] |
3 [2; 3] |
0,042 |
|
Атрофические изменения СО |
1 [1; 2] |
2 [1; 3] |
0,062 |
|
Наличие паннуса |
2 [1; 3] |
2 [1; 4] |
0,16 |
|
Наличие фибрина |
1 [0; 2] |
1 [0; 1] |
0,035 |
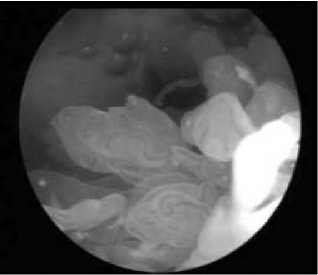
Рис. 1. Гиперемия и выраженный сосудистый рисунок СО коленного сустава у пациента с РА длительностью 10 мес
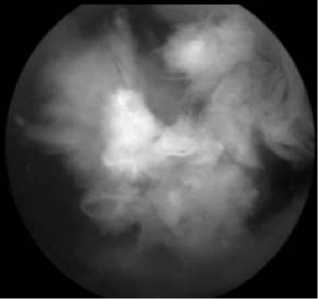
Рис. 2. Массивные сгустки фибрина у пациента с длительностью РА >5 лет
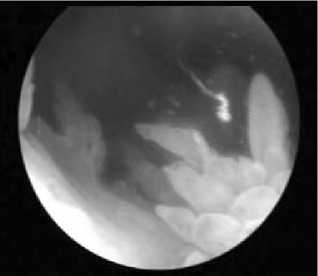
Рис. 3. Гиперплазия СО с булавовидными ворсинами у пациента с РА длительностью 3 года
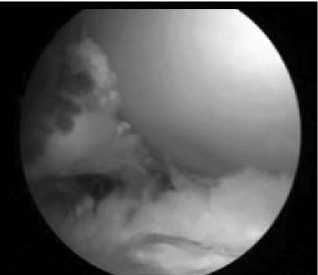
Рис. 4. Наличие паннуса в коленном суставе у высокопозитивного по АЦЦП больного РА
Таблица 3 Изменения СО суставов в зависимости от уровня АЦЦП в крови, Ме [25-й; 75-й перцентили]
В нашем исследовании при АЦЦП >60 ед/мл в СО отмечались более выраженные воспалительные процессы, ангиогенез и формирование паннуса, чем при меньших значениях этого показателя, что может быть связано с более агрессивным течением РА у данной категории больных с быстрым развитием костно-хрящевой деструкции [15]. Полученные данные подтверждают и другие авторы, наблюдавшие более тяжелое течение РА, раннее развитие деструкции в суставах и быстрое прогрессирование заболевания у высокопозитивных по АЦЦП больных [9, 16, 17].
Дальнейшее детальное исследование СО может способствовать разработке дифференцированного подхода к комплексному лечению РА в зависимости от длительности заболевания и тяжести течения. Артроскопия также может быть использована для оценки влияния терапии на процессы ангиогенеза и пролиферации СО у больных РА.
Список литературы Изменения синовиальной оболочки у больных ревматоидным артритом при артроскопии
- Dhaouadi T, Sfar I, Abelmoula L, et al. Role of immune system, apoptosis and angiogenesis in pathogenesis of rheumatoid arthritis and joint destruction, a systematic review. Tunis Med. 2007;85(12):991-8.
- Hitchon CA, El-Gabalawy HS. The synovium in rheumatoid arthritis. Open Rheumatol J. 2011;5:107-14 DOI: 10.2174/1874312901105010107
- Лялина ВВ, Шехтер АБ. Артроскопия и морфология синовитов. Москва: Наука; 2007. 108 с.
- Klint E, Catrina AI, Matt P, et al. Evaluation of arthroscopy and macroscopic scoring. Arthr Res Ther. 2009;11:R81 DOI: 10.1186/ar2714
- Carl HD, Swoboda B. Effectiveness of arthroscopic synovectomy in rheumatoid arthritis. Rheumatology. 2008;67(6):485-90.
- Capitanescu B, Simionescu C, Margaritescu C, et al. Clinical and morphological aspects of sinovitis in early rheumatoid arthritis. Curr Health Sci J. 2011;37(1):17-20.
- Vordenbäumen S, Sewerin P, Lö gters T, et al. Inflammation and vascularisation markers of arthroscopically-guided finger joint synovial biospies reflect global disease activity in rheumatoid arthritis. Clin Exp Rheumatol. 2014 Jan-Feb;32(1):117-20.
- Machold KP. Very recent onset rheumatoid arthritis: clinical and serological patient characteristics associated with radiographic progression over the first years of disease. Rheumatology (Oxford). 2007;46:342-9 DOI: 10.1093/rheumatology/kel237
- Algergawy SA, Abd El-Sabour M, Osman AS, et al. Early diagnostic and prognostic values of anti-cyclic citrullinated peptide antibody and cartilage oligomeric matrix protein in rheumatoid arthritis. Egypt J Immunol. 2013;20(2):11-20.
- Лучихина ЛВ, Каратеев ДЕ. Новые подходы к ранней диагностике артроза и перспективы его патогенетической терапии. Современная ревматология. 2014;8(4):33-8
- Paleolog EM. The vasculature in rheumatoid arthritis: cause or consequence? Int J Exp Pathol. 2009;90(3):249-61 DOI: 10.1111/j.1365-2613.2009.00640.x
- Marrelli A, Cipriani P, Liakouli V, et al. Angiogenesis in rheumatoid arthritis: a disease specific process or a common response to chronic inflammation? Autoimmun Rev. 2011;10(10):595-8 DOI: 10.1016/j.autrev.2011.04.020
- Clavel G, Bessis N, Lemeiter D, et al. Angiogenesis markers (VEGF, soluble receptor of VEGF and angiopoietin-1) in very early arthritis and their association with inflammation and joint destruction. Clin Immunol. 2007;124(2):158-64 DOI: 10.1016/j.clim.2007.04.014
- Раденска-Лоповок СГ. Ревматические заболевания. Морфологическая диагностика: Руководство для врачей. Москва: Практическая медицина; 2014. С. 13
- Van Oosterhout M, Bajema I, Levarht EW, et al. Differences in synovial tissue infiltrates between anti-cyclic citrullinated peptidepositive rheumatoid arthritis and anti-cyclic citrullinated peptidenegative rheumatoid arthritis. Arthritis Rheum. 2008 Jan;58(1):53-60 DOI: 10.1002/art.23148
- Boyesen P, Hoff M, Odegard S, et al. Antibodies to cyclic citrullinated protein and erythrocyte sedimentation rate predict hand bone loss in patients with rheumatoid arthritis of short duration: a longitudinal study. Arthritis Res Ther. 2009;11(4):R103 DOI: 10.1186/ar2749
- Демидова НВ. Взаимосвязь иммуногенетических и иммунологических маркеров и их влияние на активность заболевания и рентгенологическое прогрессирование у больных ранним ревматоидным артритом. Научно-практическая ревматология. 2009;47(3):12-7


