Изменения слизистой оболочки желудка и двенадцатиперстной кишки у больных раком молочной железы в процессе адъювантного и неоадъювантного лечения таксанами и доксорубицином
Автор: Королева И.А., Вельшер Л.З., Казюлин А.Н., Кучерявый Ю.А., Оганесян Т.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 (38), 2010 года.
Бесплатный доступ
Проведено ретроспективное мультицентровое случай-контроль исследование на модели неоадъювантной и адъювант- ной полихимиотерапии рака молочной железы. По данным ЭГДС оценивались изменения слизистой оболочки гастро- дуоденальной зоны. Установлено, что частота воспалительных и деструктивных изменений слизистой оболочки верхнего отдела желудочно-кишечного тракта достаточно высока и нарастает во времени, что создает необходимость адекватного динамического контроля за состоянием слизистой оболочки.
Рак молочной железы, изменение слизистой оболочки гастродуоденальной зоны, химиотерапия
Короткий адрес: https://sciup.org/14055613
IDR: 14055613 | УДК: (616.33+616.342):616.76:618.19-006.6:615.28
Текст научной статьи Изменения слизистой оболочки желудка и двенадцатиперстной кишки у больных раком молочной железы в процессе адъювантного и неоадъювантного лечения таксанами и доксорубицином
Рак молочной железы (РМЖ) – одно из самых распространенных заболеваний среди женщин развитых стран мира, занимающее второе место по заболеваемости и первое место по смертности среди злокачественных новообразований у женщин [10–12]. В Российской Федерации ежегодно под наблюдением находится более 400 тысяч женщин, страдающих РМЖ, и их число неуклонно растет. Так, если в 1999 г. их было 337,356, то в 2006 г. – 437,774 человека. Увеличилась и распространенность данной патологии в России: в 1997 г. этот показатель составил 214,7 на 100 тысяч, в 2007 г. – 318,0 на 100 тысяч населения [8]. Ежегодно в мире регистрируется почти 700
Таблица 1
Основные токсические эффекты наиболее часто применяемых схем химиотерапии РМЖ [7]
|
Побочные эффекты |
Схемы химиотерапии |
|||
|
АТ |
NT |
NAC |
FАС |
|
|
Тошнота, рвота III–IV степени |
27 % |
14,3 % |
8,5 |
81,9 |
|
Диарея I–II степени |
1,8 % |
- |
- |
- |
|
Запоры |
- |
24,7 % |
23,2 % |
24,5 % |
|
Стоматит I–IV степени |
41 % |
6 % |
- |
6,2 % |
|
Стоматит III–IV степени |
6 % |
- |
- |
6,2 % |
Примечание: АТ (доксорубицин + таксол), NT (навельбин + таксол), NAC (навельбин + доксорубицин + циклофосфамид), FAC (5-фтор-урацил + доксорубицин + циклофосфамид)
тысяч новых случаев РМЖ. Смертность от этого заболевания в мире составляет 17,9 на 100 тысяч женского населения [1].
Частота встречаемости гастроинтестинальной токсичности у больных РМЖ, получающих химиотерапию, зависит от схемы лечения и достигает 81,9 % случаев (табл. 1). Гастроинтестинальная токсичность обусловлена прямым повреждающим действием цитостатиков на эпителиальные клетки [4], присоединением инфекции, а также иммунодепрессивным действием химиотерапии [2, 3, 5, 6].
Материал и методы. Проведено ретроспективное мультицентровое случай-контроль исследование на модели неоадъювантной и адъювантной полихимиотерапии рака молочной железы. В исследовании оценивались результаты комплексного обследования, лечения 1643 больных раком молочной железы, а также последующего наблюдения за частью из числа включенных больных в течение 5 лет. Всего проанализировано более 4200 архивных историй болезни и 2900 амбулаторных карт в 4 клиниках г. Москвы и г. Самары за период 1993–2003 гг., пролеченных/проконсультирован-ных в соответствии с медико-экономическими стандартами РМЖ.
Все пациентки подвергались неоадъювантной и адъювантной химиотерапии, а также оперативному вмешательству в объеме радикальной мастэктомии. Диагноз рака молочной железы на момент включения в исследование был подтвержден данными цитологического и/или гистологического исследования. Всем больным до начала исследования были установлены распространенность (стадия) и гистологическое строение опухоли, согласован план противоопухолевого лечения. Окончательная гистологическая верификация осуществлялась по анализу операционного материала. Средний возраст больных составил 52,3 ± 2,8 года, возрастной диапазон 28–72 года. Большинство больных находилось в возрастной группе от 41 до 55 лет (66,9 %). Средний период наблюдения за всей популяцией в целом составил 2,9 года. В течение 5 лет прослежена история болезни у 607 больных по медицинской документации, остальные больные за этот период времени выбыли из исследования по разным причинам.
Критерии включения в исследование: 1) впервые установленный, морфологически верифицированный РМЖ II–IIIВ стадии;
-
2) HER2-отрицательный статус опухоли;
-
3) статус ECOG 0–1;
-
4) отсутствие клинических признаков метастатического поражения головного мозга.
Критерии исключения: 1) первично-множественный рак; 2) прогрессирование заболевания в процессе лечения, дальнейшего наблюдения; 3) сопутствующая иммуно- или гормонотерапия по поводу РМЖ; 4) тяжелые сопутствующие соматические или психические заболевания, требующие специального лечения, включая тя-
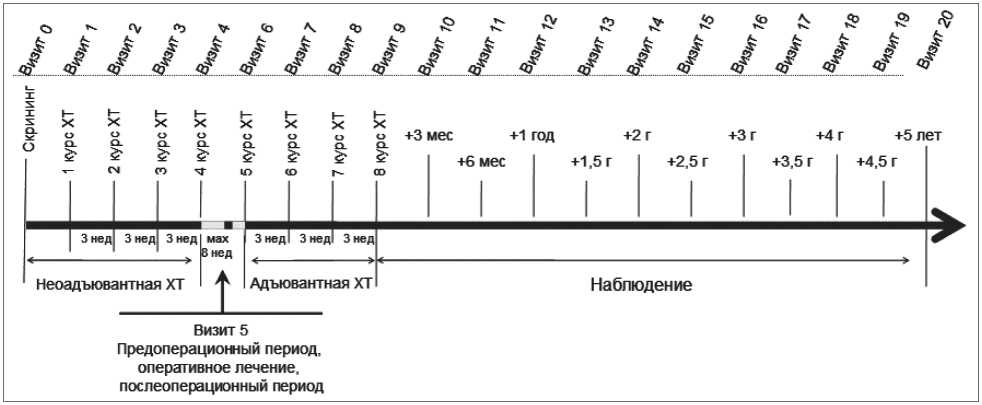
Рис. 1. Схема протокола исследования
желые инфекционные заболевания в активной форме на момент включения; 5) хронические заболевания, требующие постоянного или длительного приема кортикостероидов, нестероидных противовоспалительных препаратов и других лекарственных средств с известной гепато- и гастроинтестинальной токсичностью; 6) злоупотребление алкоголем; 7) беременность.
Всем больным, включенным в исследование, проведено комбинированное лечение в объеме неоадъювантной (4 цикла по схеме паклитаксел в дозе 175 мг/м2 + доксорубицин в дозе 50 мг/м2 или доцетаксел в дозе 75 мг/м2 + доксорубицин в дозе 50 мг/м2) и адъювантной полихимиотерапии (4 цикла паклитаксел в дозе 175 мг/м2 + доксорубицин в дозе 50 мг/м2 или доцетаксел в дозе 75 мг/м2 + доксорубицин в дозе 50 мг/м2), радикальной мастэктомии. Каждый курс химиотерапии заключался в парентеральном введении таксанов и доксорубицина в течение 1 дня с последующим трехнедельным перерывом. Интервал между 4 и 5-м курсом не более 8 нед (период оперативного лечения). Все больные получали премедикацию, рекомендованную для схем с паклитакселом и децетакселом. Кроме того, практически всем (91,6%) пациенткам со II и III стадиями опухолевого процесса проводилась стандартная послеоперационная лучевая терапия. Всем больным репродуктивного возраста рекомендована контрацепция физическими ме- тодами в процессе проведения химиотерапии и в течение 5 лет после завершения лечения.
Исследование включало 21 визит (рис. 1). В процессе химиотерапии визиты 1–4 и 6–9 имели допустимую погрешность ± 7 дней, интервал между 4 и 5-м курсом химиотерапии – не более 8 нед, в течение первого года наблюдения (визиты 10–12) допустимой погрешностью явки считалось 2 нед, в течение оставшегося срока наблюдения (визиты 13–20) – 1 мес.
Для статистической обработки данных использован пакет Access, Excel программы Microsoft Office XP. Данные, полученные с использованием встроенных математических модулей Access Microsoft Office XP, были подвергнуты полному статистическому анализу с использованием программ БИОСТАТ 4.03 и Sta-tistica release 6.0 for Windows (StatSoft, USA).
Результаты и обсуждение
Эндоскопическое исследование верхнего отдела желудочно-кишечного тракта в процессе химиотерапевтического лечения выполнялось, в том числе и в динамике, у 493 больных (30 %). В том числе ЭГДС выполнялась у 54,43 % больных с болями в животе (411 из 756) и у 95,4 % больных с более типичными для поражения ПЖ болями (370 из 388). У 68 пациентов с язвенной болезнью в анамнезе ЭГДС выполнялась на 0 или 1 визите. У 17 больных на этих же визитах ЭГДС была проведена в отсутствие зарегистрированного болевого абдоминального синдрома. Таким образом, до начала введения химиопрепаратов ЭГДС была выполнена у 89 пациентов, в остальных случаях исследование выполнялось на протяжении визитов 2–9, т.е. анализировалась острая токсичность химиотерапевтического лечения. У всех 89 пациенток, которым выполнялась ЭГДС на начало химиотерапии, каких-либо повреждений СО гастродуоденальной зоны не выявлено. У 3 пациенток из этой группы, несмотря на язвенный анамнез и наличие болей, рецидива язвы также не было. У 356 больных из 493 (72,2 %) эндоскопическое исследование проводилось повторно, реже многократно. Наличие или отсутствие боли при повторных исследованиях мы решили не исследовать, объединив все случаи вместе. В связи с тем, что ЭГДС не входила в обязательный скрининг, было решено провести совокупный анализ всех результатов ЭГДС, проведенной на всех плановых и дополнительных визитах. В итоге было проанализировано 926 протоколов ЭГДС от 493 больных. За проявления токсичности по данным ЭГДС принимали усиление воспалительных и/или появление некротических изменений СО гастродуоденальной зоны по сравнению с исходной картиной (для больных с выполненной ЭГДС до введения цитостатиков, а также для всех случаев повторного выполнения исследования), а также любые острые дефекты СО. Хронические эрозии (полные) в анализ не включались, поскольку они характеризуются весьма сложным патогенезом и прямого отношения к проведению химиотерапии не имеют.
Частота острых воспалительных и деструктивных изменений СО верхнего отдела желудочно-кишечного тракта была достаточно высока и нарастала во времени. В связи с ограниченным числом наблюдений мы решили провести объединенный анализ частоты токсичности курсов химиотерапии по данным ЭГДС в подгруппах (неоадъювантные и адъювантные курсы) (табл. 2).
В целом, острые изменения гастродуоденальной слизистой (острая воспалительная реакция, острые эрозии, язвы) отмечены у 311 больных, что составило 63,1 % от числа обследованных и 18,9 % от общего числа больных. Частота острых воспалительных изменений в процессе химиотерапии в группе обследован- ных оказалась более чем в 3 раза выше, чем в общей выборке. Эндоскопические изменения у больных язвенной болезнью встречались статистически достоверно чаще по сравнению с частотой признака в общей выборке и в подгруппе обследованных (p<0,05). В то же время у 249 больных без предшествующего язвенного анамнеза регистрировались острые изменения, что составило 15,2 % от общего числа больных и 58,6 % от числа обследованных. При этом не получено статистически достоверных различий по сравнению с общей выборкой, не разделенной по наличию и отсутствию фоновой язвенной болезни. Таким образом, достаточно высокая частота острых изменений слизистой оболочки гастродуоденальной зоны, выявленная в общей выборке, в определенной степени была достигнута не за счет больных с язвенной болезнью. С другой стороны, высокая частота воспалительных и деструктивных изменений в СО, хотя и достоверно меньшая, чем в подгруппе больных язвенной болезнью (p<0,05), определенно связана с химиотерапевтическим лечением.
Частота гастротоксичности по данным ЭГДС в процессе полихимиотерапии у больных РМЖ
Таблица 2
|
Группы больных |
Частота повреждения СО |
||
|
Всего больных |
При неоадъювантной химиотерапии |
При адъювантной химиотерапии |
|
|
От общего числа (n=1643) |
311 (18,9 ±1,0 %)** |
97 (5,9 ± 0,6 %)** *** |
308 (18,8 ± 1,0 %)** |
|
От числа обследованных (n=493) |
311 (63,1 ± 2,2 %)* |
97 (19,7 ± 1,8 %)* *** |
308 (62,5 ± 2,2 %)* |
|
От числа больных язвенной болезнью (n=68) |
62 (91,2 ± 3,4 %)* ** |
39 (57,4 ± 6,0 %)* ** *** |
59 (86,7 ± 5,0 %)* ** |
|
От общего числа без предшествующей язвенной болезни (n=1575) |
249 (15,2 ± 0,9 %)** |
58 (3,7 ± 0,5 %)** *** |
249 (15,2 ± 0,9 %)** |
|
От числа обследованных без предшествующей язвенной болезни (n=425) |
249 (58,6 ± 2,4 %)* |
58 (13,6 ± 1,7 %)* *** |
249 (58,6 ± 2,4 %)* |
Примечание: * – различия статистически значимые по сравнению с уровнем токсичности в общей выборке больных (p<0,05); ** – различия статистически значимы по сравнению с уровнем токсичности у обследованных (ЭГДС) больных (p<0,05); *** – различия статистически значимы по сравнению с уровнем токсичности, возникшей при адъювантной химиотерапии (p<0,05).
формирует предпосылки для разработки мер профилактики острой гастропатии, как это имеет место при назначении нестероидных противовоспалительных средств. Доказательством состоятельности этого положения послужит анализ эффективности проведенных профилактических мероприятий, приведенный ниже.
У 356 больных выполнено 789 повторных эндоскопических исследований, что составило в среднем 2,2 раза в процессе проведения полихимиотерапии. Показаниями для динамического исследования в 230 случаях являлись эндоскопически подтвержденные признаки острой гастроинтестинальной токсичности. У 126 больных повторные исследования были однократно проведены по клиническим показаниям (симптомы гастроинтестинальной токсичности) либо в отсутствие обнаруженных нами изменений. Таким образом, у 230 больных с признаками гастроинтестинальной токсичности всего было выполнено 663 исследования, что составило в среднем 2,9 исследования на одного пациента.
Учитывая особенности дизайна исследования, отсутствие протоколов ЭГДС от всей выборки и профилактический прием рядом пациентов гастропротективных средств, достаточно сложно оперировать полученными данными ввиду возможных неточностей. Однако общая тенденция вполне понятна – повреждения СО в процессе химиотерапии наступают очень часто, нарастая во времени (от курса к курсу), особенно у больных язвенной болезнью, и, возможно, частично корректируются гастропротекторами, изменения СО, и, в большей степени, не мониторируются с помощью динамических ЭГДС.


