Изменения спектра производных фибринопептида в плазме крови при действии о-изобутил-s-(2-диэтиламиноэтил) метилтиофосфоната
Автор: Краснов И.А., Подольская Е.П., Гончаров Н.В., Бабаков В.Н., Глашкина Л.М., Ермолаева Е.Е., Дубровский Я.А., Прокофьева Д.С., Войтенко Н.Г., Смолихина Т.И., Поляков Н.Б., Радилов А.С., Краснов Н.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии. Интерпретация данных, методология, применение
Статья в выпуске: 4 т.18, 2008 года.
Бесплатный доступ
Известно, что при воздействии фосфорорганических соединений (ФОС) на организм происходит подавление активности ряда ключевых ферментов, что подтверждается простыми методами лабораторной и клинической биохимии. Однако диагностика при хроническом действии малых доз ФОС или в отдаленные сроки после острой интоксикации затруднена вследствие отсутствия подавления или восстановления активности этих ферментов. Определение пептидного спектра плазмы или сыворотки крови может служить альтернативным и более чувствительным методом диагностики интоксикации. В данной работе приведены пептидные спектры плазмы и сыворотки крови крыс и человека, полученные при субхроническом воздействии российского VX (RVX) на крыс in vivo или однократном воздействии на кровь человека in vitro. Показано, что основной пептидный фон в плазме крови или сыворотки человека и крысы после воздействия RVX составляют производные фибринопептида А, что свидетельствует об инактивации экзопептидаз при воздействии RVX.
Короткий адрес: https://sciup.org/14264569
IDR: 14264569 | УДК: 577.112.6
Текст научной статьи Изменения спектра производных фибринопептида в плазме крови при действии о-изобутил-s-(2-диэтиламиноэтил) метилтиофосфоната
В настоящее время уничтожение химического оружия в соответствии с федеральной целевой программой "Уничтожение запасов химического оружия в Российской Федерации" является одной из приоритетных технологических задач. Однако существует опасность для персонала, участвующего в выполнении работ, которая может быть связана как с однократным острым поражением в аварийных ситуациях, так и с хроническим отравлением малыми дозами отравляющих веществ (ОВ) [1]. Доказательством поражения ОВ может служить изменение биохимической активности определенных ферментов, так называемых биомаркеров интоксикации. Так, известными биомаркерами острой и подострой интоксикации организма фосфорорганическими соединениями (ФОС) являются ферменты ацетилхолинэстераза (АХЭ) и бутирилхолинэстераза (БХЭ), активность которых снижается. Из перечня ФОС наиболее токсичным считается О-изобутил-S-(2-диэтил-аминоэтил)метилтиофосфонат — российский VХ (RVX). Как и другие ФОС, RVX обладает цитотоксическим действием на клетки нервной системы, печени, системы крови, а также вызывает неблагоприятные эффекты при длительном воздействии субтоксических концентраций [2]. Однако диагностика при действии малых доз ФОС вообще и RVX в частности затруднена отсутствием подавления активности АХЭ или БХЭ.
В последние годы активно развивается область протеомики, которая получила название пептидо-мика [3–5]. Это направление достаточно перспективно при поиске биомаркеров различных патологических состояний, в том числе и при интоксикации. Воздействие ОВ на организм приводит к появлению нехарактерных для здорового состояния соединений, которые могут быть детектированы тем или иным способом. К таким соединениям в первую очередь относятся белки и пептиды крови. Набор низкомолекулярных пептидов можно рассматривать как "молекулярный отпечаток" состояния биологических систем, или "роспись" (signature). Состояние пептидного спектра ("пептидом", "деградом") отражает состояние определенных белков-ферментов, активность или сам факт существования которых чрезвычайно сложно измерить прямыми биохимическими методами [6, 7]. С точки зрения специфичности и чувствительности наиболее удобным методом для анализа пептидов является масс-спектрометрия (МS), а применительно к массовому анализу наиболее подходящим методом представляется масс-спектрометрия с ионизацией лазерной десорбцией в присутствии матрицы (MALDI).
Целью данной работы было изучение пептидного спектра низкомолекулярной фракции плазмы крови крыс при интоксикации RVX, а также пептидного спектра плазмы крови человека при взаимодействии с RVX in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
Субхроническую интоксикацию крыс обеспечивали добавлением RVX в питьевую воду животных в течение трех недель, из расчета ежедневного потребления вещества в дозе 1/100 ЛД50. Низкомолекулярную фракцию пептидов плазмы крови крыс получали путем осаждения белков плазмы ацетонитрилом с 2 % уксусной кислоты в соотношении 1 : 2 в течение 30 мин при 4 °С с последующим центрифугированием при 10 000 g в течение 30 мин. Затем осадок перерастворяли в 0.1 % растворе трифторуксусной кислоты (ТФУ), а не-растворившуюся фракцию из неосажденных на предыдущей стадии белков удаляли центрифугированием при 10000 g в течение 10 мин. Пробу обессоливали с помощью мембраны с привитой фазой С-18, помещенной в микроколонку, после чего пептиды, которые связались с мембраной, смывали на мишень 60 %-м раствором ацетонитрила в 0.1 %-м ТФУ, содержащим а-циано-4-гидрокси-коричную кислоту в концентрации 10 мг/мл.
Цельную венозную кровь от здоровых доноров отбирали в вакуумные пробирки, содержащие ЭДТА (Becton Dickinson). Цельную кровь инкубировали с RVX в конечной концентрации 0.1 мг/мл при 37 °С в течение 1 часа. Затем кровь центрифугировали при 1000 g 10 мин. Низкомолекулярную фракцию пептидов плазмы крови человека получали путем осаждения белков плазмы ацетонитрилом с 2 % уксусной кислоты в соотношении 1 : 2 в течение 30 мин при 4°С и последующим центрифугированием при 10000 g в течение 30 мин.
Масс-спектрометрический анализ пептидов проводили на времяпролетном масс-спектрометре Ultraflex-TOF-TOF (Bruker Daltonics, Bremen, Germany) с источником MALDI, оснащенном УФ-лазером (337 нм) в режиме детектирования положительных ионов с использованием рефлектрона при следующих настройках ионного источника. Напряжение на IS1 — 25 кВ, IS2 — 21.75 кВ, напряжение на линзах (Lens) 9.5 кВ, напряжения на рефлектроне (Ref) — 26.99 и 13.80 кВ (Ref 2). Ионы детектировали в диапазоне m / z от 700 до 2000.
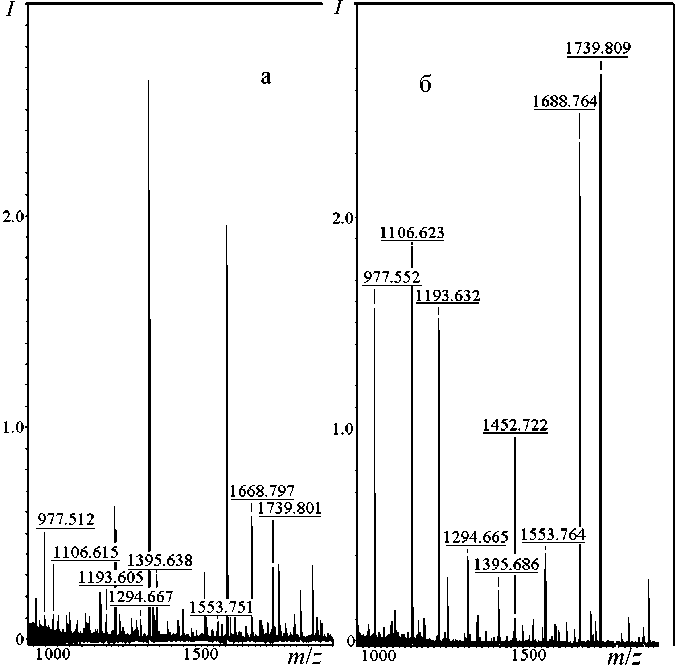
Рис. 1. Масс-спектры пептидной фракции плазмы крови контрольных крыс (а) и крыс после субхронической интоксикации RVX (б)
Обработку спектров, полученных при помощи масс-спектрометра MALDI-TOF-TOF проводили при помощи программного обеспечения Flex Analysis 2.4 (Bruker Daltonics, Bremen, Germany). К спектрам применяли сглаживание по алгоритму Savizky Golay (ширина 0.1 m / z , 1 цикл), и вычитание базовой линии согласно алгоритму Convex Hull. Использовали следующие параметры детекции пиков: алгоритм детекции пиков SNAP; соотношение сигнал/шум 2; порог качества спектра 100). Поиск в базе SwisProt осуществляли с помощью программного комплекса MASCOT (Matrix Science, Великобритания). Точная моноизотопная масса и форма изотопного распределения вычислялись при помощи программы MassPro (ИАнП РАН). Данные MS-MS анализа представлялись с помощью программы Sequence Viewer 2.0 (ИАнП РАН).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
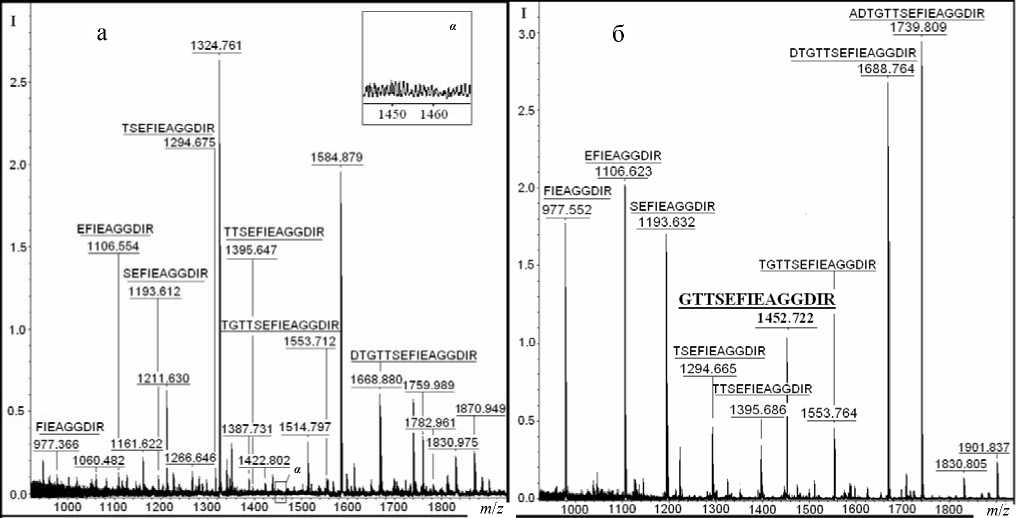
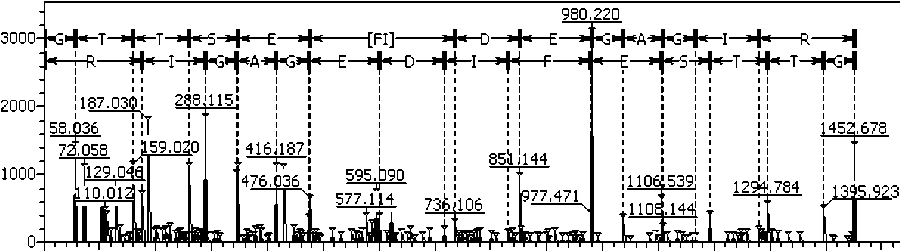
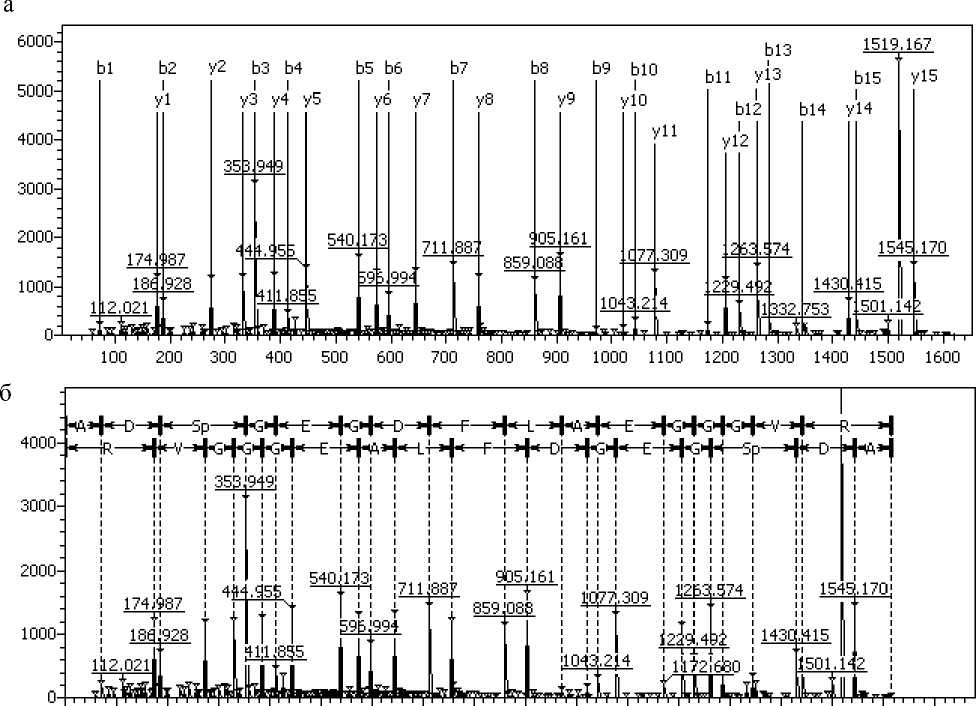
Основной целью данной работы было выявление и идентификация пептидных маркеров влияния RVX на низкомолекулярную фракцию плазмы крови крыс и человека. На первом этапе проводился масс-спектрометрический анализ проб, по- лученных от крыс, подвергнутых воздействию RVX in vivo, и контрольных проб из плазмы крови здоровых крыс. При сравнении спектров значительного различия между пептидными пулами по качественному составу в диапазоне масс 700– 2000 Да не было обнаружено. Но ряд сигналов, не выделяющихся по интенсивности из общего пула в спектрах контрольной группы, становятся мажорными в спектрах образцов экспериментальной группы (рис. 1, б). Кроме того, в этих спектрах появляется сигнал с MH+ 1452.77 Да, который отсутствует в контроле. Для каждого из пептидов, которым соответствуют указанные сигналы, был проведен MS-MS анализ, результат которого показал, что все они относятся к фибринопептиду А, который является частью фибриногена, и характеризуются потерей одной аминокислоты с N-конца (рис. 2, б). На рис. 3 приведен фрагментный спектр пептида с MH+ 1452.77 Да с указанием b- и y-фрагментных серий. Как показано на рисунке, данный спектр принадлежит пептиду с аминокислотной последовательностью GTTSEFIDEGAGIR, являющемуся частью фибринопептида А ADTGTTSEFIDEGAGIR с потерей трех аминокислот с N-конца.
1266 646
1060.482
1.0
б
TSEFIEAGGDIR
1294.665
'TSEFIEAGGDIR
1395.686
1553.764
а
1324.761
TSEFIEAGGDIR
1294.675
1688.764
EFIEAGGDIR
1106.623
TGTTSEFIEAGGDIR
GTTSEFIEAGGDIR
1452.722
1584.879
1193.612
TGTTSEFIE-
1553.712
DTGTTSEFIEAGGDIR
1211.630
FIEAGGDIR
1387.731 1514.797
1161.622
977.366
^i.QVi
|----1 α ul^laJj^JUd^
1668.880175998g
1000 1100 1200 1300
1L. m / z
1870.949
1782.961 |
1830.975
ADTGTTSEFIEAGGDIR
1739.809
DTGTTSEFIEAGGDIR
SEFIEAGGDIR
1193.632
1000 1100 1200
SEFIEAGGDIR
FIEAGGDIR
977.552
1300 1400 1500
1600 1700
1901.837
1830.805
EFIEAGGDIR 1106.554
TTSEFIEAGGDIR
1395.647
α
.1V.vWJaWWW
1450 1460
1800 m / z
Рис. 2. Масс-спектры пептидной фракции плазмы крови контрольных крыс (а) и крыс после субхронической интоксикации RVX (б). Показано отсутствие пептида с MH+ 1452.77 Да в плазме крови контрольных животных (а)
а
3000-
ы
Ь2
ЬЗ Ь4
у4
Ь5
уб
Ь7
Ь8
980.220
Ь9 .
2000-
У1
у2 уЗ
У5
у7
у8
У У
187.0311
2(8
: 58, )36
ЫО Ы1 yll
| Ы2 уЮ
ЫЗ
у12
1 DOO-
^129^
159.02
е
У13
452.678
110.012
595. )90
577.1 .4
73 i
977.471
1106.539
б
Ш 73 >106 s wk wЦ itwkw, м р.w^w
110Е
t , к ^W
лЖ pwgTTj ,
1395.92.3
100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500
О 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500
Mass/Charge
Рис. 3. Масс-спектр пептида GTTSEFIDEGAGIR с MH+ 1452.77 Да, полученный тандемной масс-спектрометрией (а), и определение его последовательности (б)
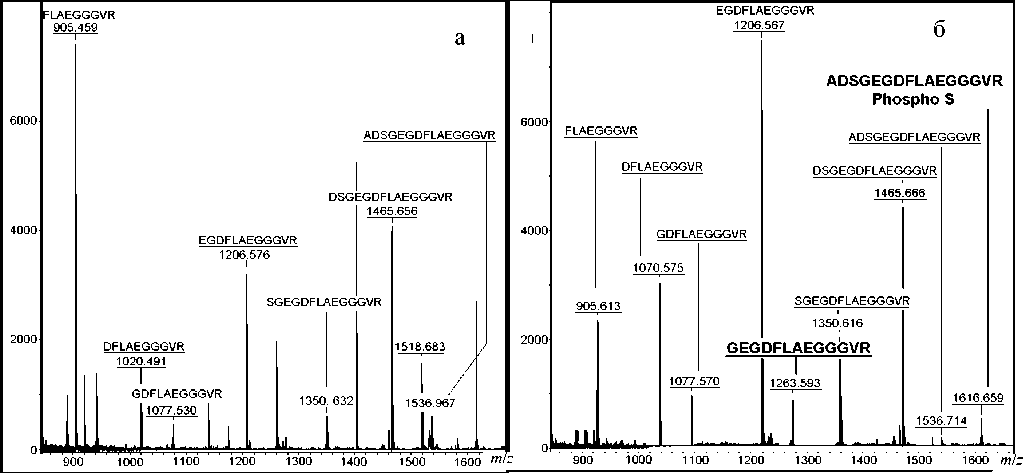
Рис. 4. Масс-спектры пептидной фракции плазмы крови человека (а) и плазмы крови человека после инкубации с RVX in vitro (б)
Таким образом, в низкомолекулярной фракции плазмы крови крыс, подвергнутых субхронической интоксикации RVX, обнаружен пептид фибриногеновой природы; этот факт наряду с характерным изменением пептидного спектра в целом может служить молекулярным свидетельством интоксикации RVX.
В следующем эксперименте мы добавляли RVX в кровь человека in vitro (см. раздел "Материалы и методы"), после чего исследовали пептидную фракцию плазмы крови. Как и в эксперименте с крысами in vivo, некоторые компоненты спектра становятся мажорными (рис. 4, б). Более того, все мажорные сигналы в процессе идентификации были отнесены к фибринопептиду А, лишенного аминокислот с N-конца. Масс-спектрометрический анализ образцов контрольной плазмы и плазмы с добавлением RVX показал определенное сходство полученных результатов с теми, что были получены в эксперименте in vivo с кровью крыс. В образцах появляется пептид GEGDFLAEGGGVR, MH+ 1263.6 Да, также имеющий фибриногеновую природу и характеризующийся отсутствием трех аминокислот по сравнению с фибринопептидом человека (ADSGEGDFLAEGGGVR). MS-MS спектр пептида GEGDFLAEGGGVR приводится на рис. 5.
Таким образом, в обоих экспериментах обнаружен фрагмент фибринопептида, отсутствующий в контрольных пробах и имеющий разницу с родительским пептидом в три аминокислоты, отщепленные с N-конца. Фрагменты фибринопептидов крысы и человека начинаются с глицина с N-конца, а предшествующая отщепленная аминокислота является нейтральной и имеет гидроксильную группу (треонин в фибринопептиде крысы и серин в фибринопептиде человека) (см. таблицу).
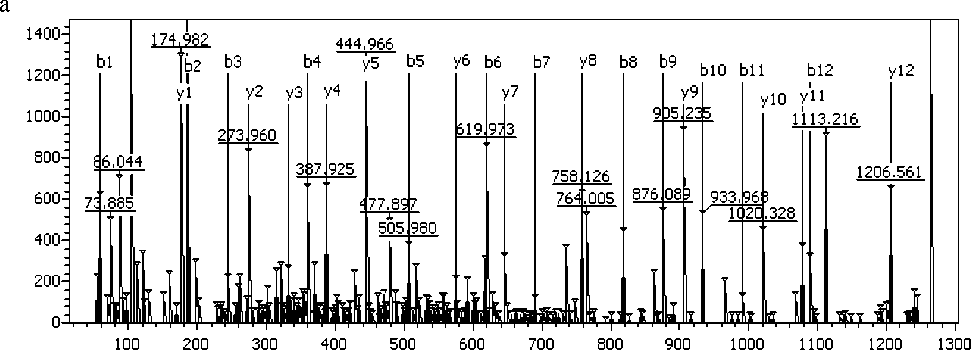
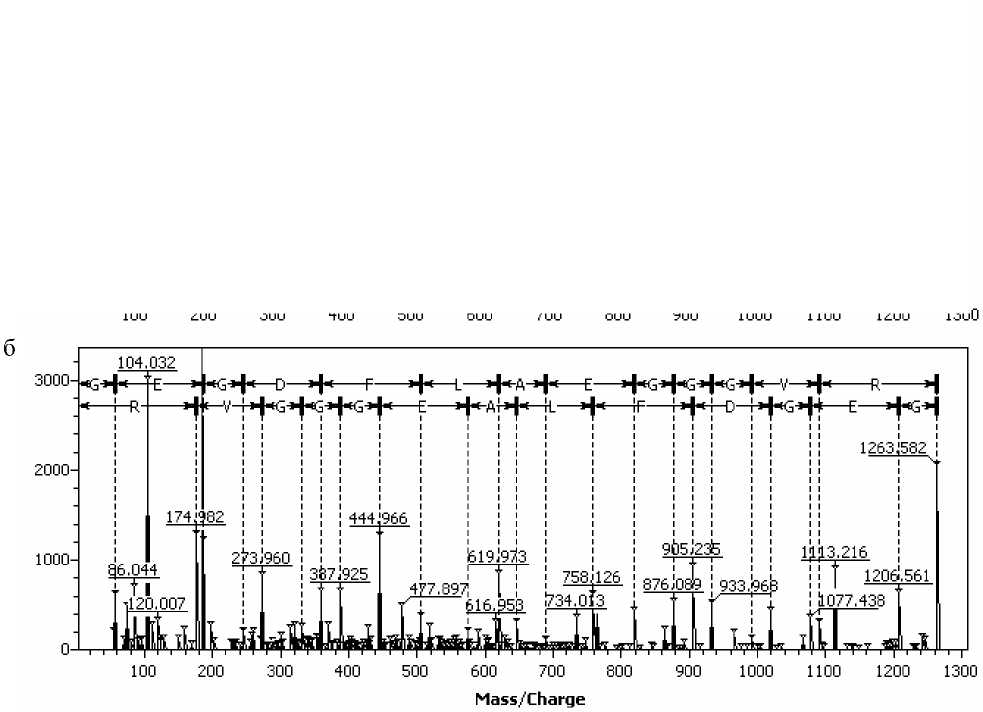
Рис. 5. Масс-спектр (а) пептида GEGDFLAEGGGVR MH+ 1263.6 Да, полученный тандемной масс-спектрометрией, и определение его последовательности (б)
Пептиды, относящиеся к фибринопептиду А, выявленные в плазме крови крысы и человека, в контроле и при действии RVX
|
№ п/п |
Крыса |
Человек |
||||
|
Пептид (MH + Да) |
Контроль |
VX |
Пептид (MH + Да) |
Контроль |
VX |
|
|
1 |
ADTGTTSEFIDEGAGIR + Phospho ST |
– |
– |
ADSGEGDFLAEGGGVR + Phospho ST (1616.6515) |
– |
+ |
|
2 |
ADTGTTSEFIDEGAGIR (1739.809) |
+ |
+ |
ADSGEGDFLAEGGGVR (1536.6912) |
+ |
+ |
|
3 |
DTGTTSEFIDEGAGIR (1668.772) |
+ |
+ |
DSGEGDFLAEGGGVR (1465.6481) |
+ |
+ |
|
4 |
TGTTSEFIDEGAGIR (1553.745) |
+ |
+ |
SGEGDFLAEGGGVR (1350.6212) |
+ |
+ |
|
5 |
GTTSEFIDEGAGIR (1452.697) |
– |
+ |
GEGDFLAEGGGVR (1263.5891) |
– |
+ |
|
6 |
TTSEFIDEGAGIR (1395.676) |
+ |
+ |
EGDFLAEGGGVR (1206.5677) |
+ |
+ |
|
7 |
TSEFIDEGAGIR (1294.628) |
+ |
+ |
GDFLAEGGGVR (1077.5251) |
+ |
+ |
|
8 |
SEFIDEGAGIR (1193.580) |
+ |
+ |
DFLAEGGGVR (1020.5036) |
+ |
+ |
|
9 |
EFIDEGAGIR (1106.548) |
+ |
+ |
FLAEGGGVR (905.4767) |
+ |
+ |
По-видимому, при действии RVX происходит ингибирование ряда экзопептидаз (N-аминопептидаз), в результате чего изменяется количественное соотношение компонентов низкомолекулярной фракции плазмы крови, в частности наблюдается значительное усиление сигналов фиб-ринопептидных фрагментов по отношению к остальным сигналам в спектре, а также появляются другие пептиды, имеющие фибриногеновую природу. С другой стороны, возможно ингибирование антитромбина, что приводит к усиленному расщеплению фибриногена и повышению уровня фиб-ринопептида А. Так, помимо вышеназванного пептида с MH+ 1263.6 Да в пробах плазмы человека с добавлением RVX появляется еще один пептид c MH+ 1616.6 Да. По результатам анализа методом тандемной масс-спектрометрии, данный сигнал был также отнесен к фибринопептиду А, фосфорилированному по серину (рис. 6). Фибри-нопептид А — это пептид, отщепляемый тромбином от фибриногена при активации системы свертывания крови. Тромбин гидролизует 4 пептидные связи Arg–Gly в фибриногене, в результате чего образуются фибринопептиды А и В [8]. Функциональное значение отщепленных фибринопептидов и их фрагментов остается неясным.
Таким образом, на основе полученных результатов можно сделать следующие выводы.
-
• Основной пептидный фон в плазме крови человека и крысы после воздействия RVX составляют пептиды, принадлежащие к фибриногену, в частности к фибринопептиду А.
-
• Пептиды, входящие в состав низкомолекулярной фракции сыворотки крови (GTTSEFIDEGAGIR) и (GEGDFLAEGGGVR) соответственно крысы и человека, могут появляться в результате инактивации экзопептидаз при воздействии RVX [7].
-
• Два пептида, имеющие фибриногеновую природу в сыворотке крови человека, а именно ADSGEGDFLAEGGGVR + Phospho (ST) и GEGDFLAEGGGVR, могут свидетельствовать о воздействии RVX на организм, в частности на систему гуморального гемостаза.
О 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 1700
Mass/Charge
Рис. 6. Масс-спектр (а) пептида ADSGEGDFLAEGGGVR , фосфорилированного по серину с MH+ 1616.6 Да, полученный тандемной масс-спектрометрией, и определение его последовательности (б)


