Измерение удельной теплоёмкости стёкол на основе B2O3+Bi2O3 в широком интервале температур
Бесплатный доступ
В данной работе методом охлаждения экспериментально исследована температурная зависимость удельной теплоёмкости стёкол, полученных на основе соединения 2B2O3+Bi2O3 (2:1) с добавлением к 1 молю этого соединения 0,01, 0,02, 0,04, 0,08, 0,12, 0,5 молей NaOH. Экспериментально показано, что с ростом содержания Na в исходной смеси температурные зависимости удельной теплоёмкости стёкол от температур расплава до температур, близких к комнатным, имеет сложный характер. Дана их физическая интерпретация на основе особенностей молекулярной подвижности в области температур до и выше температуры стеклования.
Удельная теплоёмкость, стекло, температура, скорость охлаждения
Короткий адрес: https://sciup.org/147241781
IDR: 147241781 | УДК: 53, | DOI: 10.14529/mmph230310
Текст научной статьи Измерение удельной теплоёмкости стёкол на основе B2O3+Bi2O3 в широком интервале температур
Интерес к изучению кристаллов и стёкол на основе оксидных соединений бора и висмута не ослабевает, поскольку на их основе создаются материалы, используемые в различных областях науки и техники, в частности в нелинейной оптике для создания твердотельных ультрафиолетовых лазеров, лазерной и оптоволоконной технике [1–4]. Бораты висмута могут использоваться в качестве преобразователей частоты лазерного излучения на основе вынужденного комбинационного рассеяния [1]. Стёкла на основе оксида висмута, обладающие высокими значениями показателя преломления и широкой областью прозрачности в видимом и ИК-диапазоне, являются перспективными материалами для практического применения [5, 6]. После обнаружения нелинейнооптических и пьезоэлектрических свойств у кристаллов BiB3O6 появился повышенный интерес исследователей к изучению боратов висмута [7–12]. Были обнаружены четыре модификации кристалла BiB 3 O 6 : α, β, γ и δ [10, 11].
Экспериментально установлено влияние состояния расплава на формирование метастабиль-ных состояний в системе Bi 2 O 3 – B 2 O 3 . В этой системе обнаружено пять кристаллизующихся соединений: Bi 24 B 2 O 39 , Bi 4 B 2 O 9 , Bi 3 B 5 O 12 , BiB 3 O 6 и Bi 2 B 8 O 15 [13], два из которых 5Bi 2 O 3 :3B 2 O 3 и 1Bi 2 O 3 :1B 2 O 3 образуются в метастабильном состоянии [14, 15].
Имеется много работ, посвященных получению, изучению структуры, определению электрических, оптических свойств соединений системы Bi 2 O 3 – B 2 O 3 . Однако существуют лишь ограниченные сведения по их теплофизическим и термодинамическим свойствам [16–20]. Сведений о влиянии Na на свойства системы Bi2O3 – B2O3 в литературных источниках нами не обнаружено.
При изучении ДТА [19] бинарного соединения Na 2 B 4 O 7 +Bi 2 O 3 нами было показано, что в широком диапазоне концентраций получаются многофазные соединения различного состава, включающего как кристаллические, так и аморфные фазы [20]. Однако среди различных по составу и структуре компонент кристаллической фазы не обнаружены тройные соединения, содержащие B, Bi и Na. Тем не менее в интервале мольных концентраций Bi 2 O 3 менее 0,3 (здесь и далее используется мольная концентрация) получены качественные прозрачные стёкла [21], однородные по составу и структуре, оптические и электрические свойства которых зависят от состава и технологических факторов. Получены температурные зависимости удельной теплоёмкости Na 2 B 4 O 7 +Bi 2 O 3 [22], которые имели характерный максимум при температуре, соответствующей температуре стеклования. Увеличение концентрации Bi2O3 приводило к смещению максимума удельной теплоёмкости в область низких температур, а его величина уменьшалась (эффект больших масс в согласии с [22]). Во всех образцах с разной концентрацией Bi 2 O 3 соотношение Na по отношению к B было неизменным и составляло ½. В связи с этим в данной работе было интересно проследить влияние Na на температурную зависимость удельной теплоёмкости бората висмутового стекла. Для решения этой задачи были получены образцы стекла состава 2B 2 O 3 – Bi 2 O 3 .
Образцы для изучения влияния Na на свойства стёкол 2B2O3+Bi2O3 (брутто формула Bi2B4O9) получали следующим образом: сначала с целью удаления сорбированной воды исходные вещества (Bi 2 B 4 O 9 и NaOH) прокаливали на воздухе в муфельной печи в течение двух часов при температуре 573 К. Далее в молей NaOH добавляли к одному молю порошка предварительно полученного стекла Bi 2 B 4 O 9 . Полученную смесь размалывали в шаровой мельнице в течение часа с целью гомогенизации состава. Затем смесь плавили при 1050 К в платиновом тигле, выдерживали расплав в течение 7 часов, быстро охлаждали расплав в керамическом тигле [20].
Таблица 1
Содержание кристаллической и аморфной фаз в образцах Bi 4 B 2 O 9 и Bi 2 B 4 O 9 + β ·NaOH
|
NaOH, моль |
Компоненты |
Кристаллическая фаза, % |
Аморфная фаза, % |
|
0 |
Bi4B2O9 |
16,58 |
83,42 |
|
0 |
Bi2B4O9 |
1,68 |
98,32 |
|
0,01 |
Bi 2 B 4 O 9 |
1,53 |
98,47 |
|
0,02 |
Bi 2 B 4 O 9 |
1,43 |
98,57 |
|
0,04 |
Bi 2 B 4 O 9 |
1,24 |
98,76 |
|
0,08 |
Bi2B4O9 |
1,40 |
98,60 |
|
0,12 |
Bi2B4O9 |
1,52 |
98,48 |
|
0,50 |
Bi 2 B 4 O 9 |
1,51 |
98,49 |
Известно, что состав Bi4B2O9 хорошо кристаллизуется с образованием объёмного кристалла Bi4B2O9 [13–15], но даже при быстром охлаждении, как это видно из рис.1, образуются как кристаллические, так и аморфные фазы. Симметричный состав Bi2B4O9 и образцы с любыми концентрациями NaOH при быстром охлаждении образуют однородные, прозрачные стёкла. Это было подтверждено рентгенофазовым анализом (см. рис. 1). По рентгеновским дифрактограммам было определено содержание кристаллической и аморфной фаз в образцах Bi4B2O9 и Bi2B4O9+e-NaOH. Расшифровка дифрактограмм по определению состава кристаллической фазы образцов проводилась при поддержке программы Search-Match-DEMO, а для определения содержания аморфной фазы использовали программу OriginPro 17 [23]. Результаты расчётов содержания аморфной и кристаллической фаз для состава 2Bi2O3-B2O3 и Bi2O3-2B2O3+e'NaOH приведены в таблице и проиллюстрированы на рис. 2. Как видно из таблицы, доля кристаллической фазы в составе Bi4B2O9 намного больше, чем в составе Bi2O3–2B2O3. С повышением концентрации Na до 0,04 содержание аморфной фазы растёт, а при 0,08 и 0,12 – уменьшается.
1.8
1.6
1.4
1.2
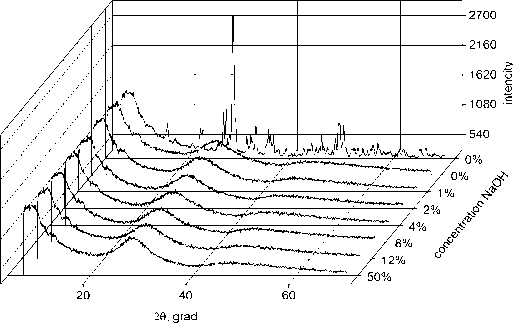
Рис. 1. Рентгеновские дифрактограммы стёкол
Bi2B4O 9 + ^ NaOH и Bi4B2O 9 (дальняя кривая)
1.0
0 5 10 15 20 25 30 35 40 45 50
c NaOH , %
Рис. 2. Содержание кристаллической фазы в образцах Bi 2 O3-2B 2 O3+ e -NaOH от концентрации NaOH в исходной смеси
Особенности температурной зависимости удельной теплоёмкости стёкол, полученных на основе Bi2O3+2B2O3 с добавкой в молей NaOH (в расчёте на один моль Bi2B4O 9 ), изучались на установке, описанной в [22], которая позволяла компьютерную регистрацию температуры образца и эталона при непрерывном свободном охлаждении расплава в окружающую среду до комнатной температуры. В качестве эталона использовался пустой платиновый тигель с крышкой. Сначала определяли удельную теплоёмкость тигля с образцом cp,x по известной формуле
c
p, x
cp , t
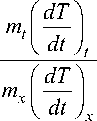
полученной на основе уравнения Ньютона-Рихмана (здесь: mt, (dT/dt), cp,t - масса, скорость охлаждения и удельная теплоёмкость пустого платинового тигля; mx, (dT/dt) , cp,x - масса, скорость охлаждения и удельная теплоёмкость платинового тигля с образцом соответственно). Затем cn•m -cnt p,x x p,t по формуле c = —------— p, ms
' mt
–
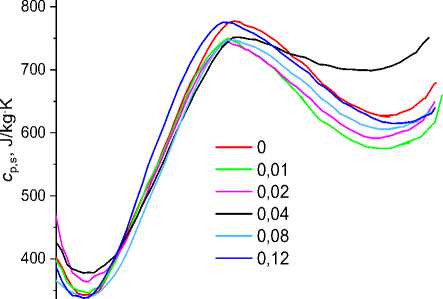
рассчитывали удельную теплоёмкость образца cp,s, где ms масса образца [20]. Результаты расчётов представлены на рис. 3.
400 500 600 700 800 900 1000 1100
T, K
0,4 400 500 600 700 800 900 1000
T, K
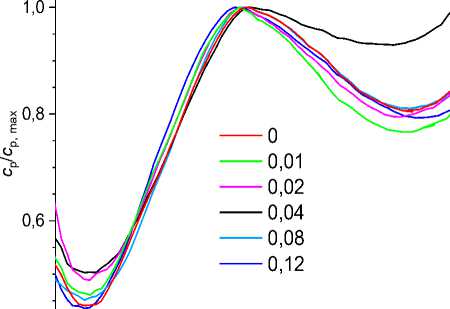
Рис. 3. Температурная зависимость удельной теплоёмкости (слева) и относительной удельной теплоёмкости (справа) стёкол состава Bi 2 B 4 O 9 +p^NaOH. Числа в легендах - мольные доли (в) NaOH в расчёте на 1 моль Bi 2 B 4 O 9 в образцах, полученных длительной выдержкой расплава и быстрого охлаждения
Из рис. 3, на котором представлены температурные зависимости удельной теплоёмкости образцов Bi 2 B 4 O 9 с различным содержанием NaOH в исходной смеси, видно, что все c р,si ( T ) стёкол Bi 2 B 4 O 9 + e 'NaOH проходят через максимум, соответствующий температуре стеклования. Для этого вида стёкол отношение удельной теплоёмкости при температуре расплава вблизи 980 K к максимальной удельной теплоёмкости равно cps 980/ cp s max ~ 0,8, а для образца 4 оно равно 0,94. Расчётная теплоёмкость расплава при температуре 980 K значительно превышает удельную теплоёмкость при низкой температуре (350 K). Значение удельной теплоёмкости стёкол в максимуме и его положение слабо зависит от мольного содержания Na в образце. Так, удельная теплоёмкость в максимуме образцов 1 и 6 равна ~775 Дж/кг^К, а образцов 2-5 ~747 Дж/кг^К. Температура максимума меняется в пределах 685 ± 12 К. В большей степени влияние Na сказывается на характере температурной зависимости удельной теплоёмкости в области температур выше температуры стеклования. Добавление 0,01 моля NaOH в исходную смесь приводит к уменьшению удельной теплоёмкости при температуре 980 K с 626 до 575 Дж/кг∙К. Увеличение NaOH до 0,02 несколько увеличивает значение удельной теплоёмкости до 595 Дж/кг∙К. Ещё большее увеличение удельной теплоёмкости наблюдается при увеличении содержания NaOH до 0,04 (наименьшее значение на интервале от температуры стеклования до 1050 K составляет 0,94 с p,smax = 705 Дж/кг∙К). Дальнейшее увеличение концентрации NaOH до 0,08 и 0,12 приводит к уменьшению удельной теплоёмкости c p s 5, cp s 6< cp s 1 (605 и 616 Дж/кг^К соответственно). Аналогичные изменения расчётной удельной теплоёмкости наблюдаются и при других температурах выше температуры стеклования, которые представлены на рис. 4 в виде концентрационных зависимостей при разных температурах.
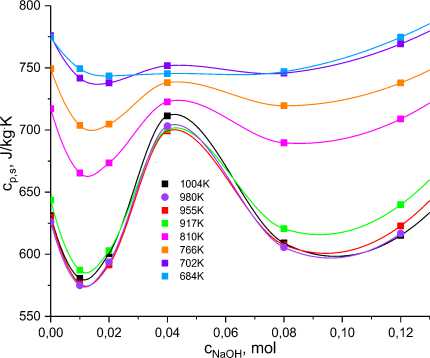
Рис. 4. Зависимости удельной теплоёмкости c от содержания мольной доли NaOH в стекле Bi 2 B 4 O 9 при разных температурах в интервале 680–1005 K
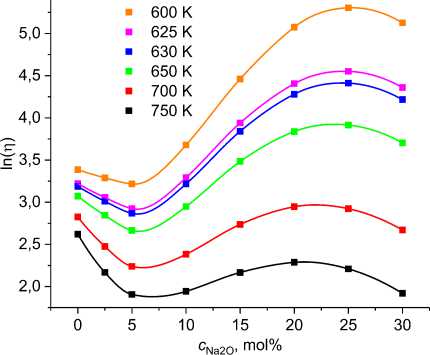
Рис. 5. Зависимость логарифма вязкости стёкол (1–α)B2O3+αNa2O от концентрации α м- пературах. Кривые рассчитаны по данным кривых концентрационных зависимостей температур равной вязкости стёкол (1–α)B2O3+αNa2O, приведённых в работе
Немилова С.В. (Nemilov S.V. p. 12, Fig.11) [24]
Из рис. 4 видно, что вблизи максимума удельной теплоёмкости стекла Bi 2 B4O 9 + ^ -NaOH, то есть при температурах, близких к температуре стеклования (684 K), её значения мало изменяются в зависимости от содержания Na. По мере удаления в область более высоких температур наблюдается рост удельной теплоёмкости с ярко выраженной аномалией его усиления при добавлении в стекло порядка 0,04–0,05 моля NaOH. Визуальные наблюдения течения расплава получаемых образцов свидетельствуют, что расплав Bi 2 B 4 O 9 с добавлением 0,04 моля NaOH обладает наименьшей вязкостью среди расплавов Bi 2 B 4 O 9 с другими мольными добавками NaOH. В связи с отсутствием технических и организационных возможностей провести непосредственные экспериментальные исследования вязкости изучаемых объектов воспользуемся результатами других авторов. В работе С.В. Немилова [24] приведены (p. 12, Fig. 11) концентрационные зависимости температур равных вязкостей для системы (1- ^ )^В 2 О 3 + ^ -Na 2 O. Ниже на рис. 5 представлены концентрационные зависимости логарифма вязкости стёкол (1— ^ )-В 2 О 3 + ^ -Na 2 O при разных температурах, рассчитанные по упомянутым зависимостям из работы Немилова.
Из рис. 5 видно, что в области концентраций Na 2 O, близких к 5 %, наблюдается минимум вязкости расплава В 2 О 3 . При больших концентрациях вязкость растет, а при содержании оксида натрия 25–30 % начинается её уменьшение. Такое поведение концентрационной зависимости вязкости объясняется возможностью образования соединений B в четверной координации в результате взаимодействия молекулярных структур, образованных оксидом бора с оксидом натрия [24]. Образование бора в четверной координации имеет концентрационную зависимость с максимумом при концентрации оксида натрия ~30 % [25]. Образование бора в четверной координации может способствовать образованию связей соседних молекулярных слоёв (сшивка). Такая возможность растёт с увеличением концентрации оксида натрия. При малых концентрациях Na 2 O сшивающий эффект мал, наоборот, преобладает разрушающий (разрыхляющий) эффект.
Из наблюдаемого эффекта малых концентраций Na 2 O на рис. 5 и NaOH на рис. 2 и рис. 4 следует, что в основе влияния Na на формирование структуры, на температурные зависимости вязкости и на особенности температурной зависимости удельной теплоёмкости при непрерывном быстром охлаждении расплава в стёклах (1- ^ )^В 2 О3 +^Na 2 O и В1 2 О 3 -2В 2 О 3 +ДNaOH лежат одни и те же молекулярные механизмы, связанные с образованием атомов B в четверной координации. Использование экспериментальных результатов по влиянию на вязкостные свойства боратного стекла оправдано тем, что используемая нами щёлочь NaOH, как показал её рентгенофазовый анализ до и после отжига, содержала более 40 % оксида натрия [20]. Наличие в используемом модификаторе NaOH и Na 2 O делает возможным протекание в расплаве оксида бора и оксида висмута реакций с образованием бора в третьей и четверной координации с добавлением реакции присоединения OH– и Na+ по месту разрыва связи немостикового кислорода, что усиливает разрушающее действие натрия.
Таким образом, исследовалась температурная зависимость удельной теплоемкости в условиях непрерывного быстрого охлаждения (от тысяч К/мин до десятков К/мин). От начальной стадии охлаждения (∼2000 K/мин) до достижения максимальных значений удельной теплоёмкости процесс протекает в условиях динамического размораживания кластерной молекулярной подвижности расплава стёкол. При приближении к температуре максимума интенсивность этого процесса существенно замедляется, а при дальнейшем уменьшении температуры и скорости её изменения начинается процесс структурного стеклования (кластерная подвижность вымораживается), который продолжается вплоть до достижения температур, близких к комнатным.
Список литературы Измерение удельной теплоёмкости стёкол на основе B2O3+Bi2O3 в широком интервале температур
- Becker, P. Thermal and Optical Properties of Glasses of the System Bi2O3-B2O3 / P. Becker // Cryst. Res. Technol. - 2003. - Vol. 38, Iss. 1. - P. 74-82.
- Кузьмичева, Г.М. Структурные особенности боратов висмута в системе nBi2O3-mB2O3 / Г.М. Кузьмичева, Т.И. Мельникова // Журнал неорганической химии. - 2009. - Т. 54, № 1. -С.74-81.
- Юхин, Ю.М. Химия висмутовых соединений и материалов / Ю.М. Юхин, Ю.И. Михайлов. - Новосибирск: Наука, 2001. - 359 с.
- Висмутсодержащие системы: строение и физико-химические свойства / В.М. Денисов, Н.В. Белоусова, Г.К. Моисеев и др. - Екатеринбург: УрО РАН, 2000. - 525 с.
- Егорышева, А.В. Стеклообразование в системе Bi2O3-B2O3-BaO / А.В. Егорышева, В.Д. Володин, В.М. Скориков // Неорган. материалы. - 2008. - Т. 44. № 11. - С. 1397-1401.
- Высокотемпературная теплоемкость стекол боратов висмута / Л.А. Иртюго, В.М. Денисов, В.П. Жереб и др. // Журнал Сибирского федерального университета. Серия: химия. - 2011. - Т. 4, № 4. - С. 344-349.
- Monoclinic Bismuth Triborate BiB3O6 - a New Efficient x(2)+x(3) - Nonlinear Crystal Multiple Stimulated Raman Scattering and Selfsum - Frequency Lasting Effects / A.A. Kaminskii, P. Becker, L. Bohaty etal. // Optic Commun. - 2002. - Vol. 206, Iss. 1-3. - P. 179-191.
- Egorysheva, A.V. Efficient Nonlinear Optical Material BiB3O6 (BiBO) / A.V. Egorysheva, V.M. Skorikov // Inorganic Materials. - 2009. - Vol. 45, no. 13. - Р. 1461-1476.
- Phenomenon of Metastable Liquation during BiB3O6 Crystallization / F.Yu. Zavartsev, S.A. Koutovoia, V.V. Voronov et al. // Journal of Crystal Growth. - 2005. - Vol. 275, Iss. 1-2. -Р.e637-e641.
- Зайцев, А.И. Фазообразование в процессе кристаллизации стёкол состава BiB3O6 / A.И. Зайцев, А.Д. Васильев // Фазовые переходы, упорядоченные состояния и новые материалы. - 2007. - С. 1-4.
- Phase Transitions Among Four BiB3O6 Polymorphs: a Detailed Investigation / R. Cong, J. Zhu, Y. Wang et al. // CrystEngComm. - 2009. - Vol. 11. - P. 1971.
- Observation of the Sixth Polymorph of BiB3O6: In Situ High-Pressure Raman Spectroscopy and Synchrotron Xray Diffraction Studies on the в-Polymorph / R. Cong, T. Yang, J. Sun et al. // Inorganic Chemistry. - 2013. - Vol. 52, no. 13. - Р. 7460-7466.
- Levin, E.M. The System Bi2O3-B2O3 / E.M. Levin, C.L. McDaniel // Journal of the American Ceramic Society. - 1962. - Vol. 45, no. 8. - P. 355-360.
- Жереб, В.П. Метастабильные состояния в оксидных висмутсодержащих системах / B.П. Жереб. - М.: МАКС пресс, 2003. - 163 с.
- Каргин, Ю.Ф. Фазовая диаграмма метастабильных состояний системы Bi2O3-B2O3 / Ю.Ф. Каргин, В.П. Жереб, А.В. Егорышева // Журнал неорганической химии. - 2002. - Т. 47, № 8. - C. 1357-1364.
- Crystal Growth, Thermal and Optical Performance of BiB3O6 / B. Teng, J. Wang, Z. Wang et al. // J. Cryst. Growth. - 2001. - Vol. 233, Iss. 1-2. - P. 282-286.
- Growth of Sillenite-Structure Single Crystals / V.M. Skorikov, Yu.F. Kargin, A.V. Egorysheva et al. // Inorganic Materials. - 2005. - Vol. 41, Suppl. 1. - P. S24-S46.
- Стеклообразование в системе Bi2O3-B2O3. Термические устойчивость и структура стекол / В.П. Жереб, Н.А. Бабицкий, Т.В. Бермешев и др. // Журнал Сибирского федерального университета. Химия. - 2014. - Т. 7, № 3. - С. 371-382.
- Кучакшоев, Д.С. Дифференциально-термический анализ бинарной системы Bi2Ü3 + Na2B4O7 / Д.С. Кучакшоев, А.Г. Джабаров // Доклады Академии наук Республики Таджикистан. -2015. - Т. 58, № 12. - C. 1096-1099.
- Кучакшоев, Д.С. Влияние NaOH на удельную теплоёмкость стёкол системы B2O3-2Bi2O3 в зависимости от температуры / Д.С. Кучакшоев // Политехнический вестник. Серия: Интеллект. Инновация. Инвестиции. - 2022. - № 3(59). - С. 32-35.
- Кучакшоев, Д.С. Свойства стёкол на основе соединений Bi2O3 и Na2B4O7 / Д.С. Кучакшоев, А.Г. Джабаров, А. Холов // Доклады Академии наук Республики Таджикистан. - 2020. - Т. 63, № 7-8. - C. 488-493.
- Кучакшоев, Д.С. Определение удельной теплоемкости стёкол на основе боратов висмута / Д.С. Кучакшоев, А.Г. Джабаров, А. Холов // Известия Национальной академии наук Таджикистана. Отделение физико-математических, химических, геологических и технических наук. - 2022. -№ 4.- C. 77-83.
- Кучакшоев Д.С., Джабаров А.Г., Холов А. Рентгенофазовый анализ стёкол (2Bi2O3-B2O3) и (Bi2O3-2B2O3) с различной концентрацией NaOH в формовочной смеси. - Доклады Академии наук Республики Таджикистан. - 2022. - Т. 65, № 1-2. - C. 69-74.
- Nemilov, S.V. Viscosity of Borate Glass-forming Melts: Spesific Fetures of the BO4 Tetrahedron as a Kinetic Unit / S.V. Nemilov // Glass Physics and Chemistry. - 1997. - Vol. 23, no. 1. - P. 126.
- Griscom, D.L. Borate Glass Structure / D.L. Griscom // Borate Glasses. Structure, Properties, Applications. Springer Science+Business Media New York, 1978. - P. 11-138.


