Измерения и анализ локальной церебральной гемодинамики у больных с сосудистыми мальформациями головного мозга
Автор: Чупахин Александр Павлович, Черевко Александр Александрович, Хе Александр Канчерович, Телегина Надежда Юрьевна, Кривошапкин Алексей Леонидович, Орлов Кирилл Юрьевич, Панарин Вячеслав Александрович, Баранов Виктор Ильич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ангионеврология и нейрохирургия
Статья в выпуске: 4 т.16, 2012 года.
Бесплатный доступ
Впервые проведены измерения скорости и давления крови в артериях головного мозга до четвертых сегментов при наличии артериовенозных мальформаций и артериальных аневризм. Разработан и внедрен аппарат диаграмм «давление - скорость» и «расход - поток энергии», позволяющий характеризовать тип сосудистой аномалии по гемодинамическим параметрам и отслеживать эффективность операции. На основании вейвлет-анализа локальных гемодинамических параметров в пораженных и здоровых ветвях артерий обнаружено изменение низкочастотной части спектра кровотока после операции. Полученные результаты дают качественные и количественные признаки аномалии сосудов головного мозга и позволяют оценить эффективность эмболизации в процессе операции.
Артериовенозные мальформации, артериальные аневризмы, гемодинамические параметры
Короткий адрес: https://sciup.org/142140502
IDR: 142140502 | УДК: 616.1
Текст научной статьи Измерения и анализ локальной церебральной гемодинамики у больных с сосудистыми мальформациями головного мозга
ВАК 14.01.18
Поступила в редакцию 10 августа 2012 г.
А.А. Черевко,
А.К. Хе,
Н.Ю. Телегина,
А.Л. Кривошапкин,
К.Ю. Орлов,
В.А. Панарин,
В.И. Баранов, 2012
Впервые проведены измерения скорости и давления крови в артериях головного мозга до четвертых сегментов при наличии артериовенозных мальформаций и артериальных аневризм. Разработан и внедрен аппарат диаграмм «давление – скорость» и «расход – поток энергии», позволяющий характеризовать тип сосудистой аномалии по гемодинамическим параметрам и отслеживать эффективность операции. На основании вейвлет-анализа локальных гемодинамических параметров в пораженных и здоровых ветвях артерий обнаружено изменение низкочастотной части спектра кровотока после операции. Полученные результаты дают качественные и количественные признаки аномалии сосудов головного мозга и позволяют оценить эффективность эмболизации в процессе операции. Ключевые слова: артериовенозные мальформации; артериальные аневризмы; гемодинамические параметры.
Сосудистые заболевания центральной нервной системы являются одной из основных причин смертности и инвалидизации населения России. Особенно неблагоприятные условия складываются в регионе Сибири. Одной из частых причин геморрагического инсульта является разрыв артериальных аневризм (АА) сосудов головного мозга. По статистике, ежегодно разрыв аневризм происходит от 8 до 21 случаев на 100 000 человек. Приблизительно 15% пациентов с аневризматическим субарахноидальным кровоизлиянием погибает, не достигнув больницы. Около 50% пациентов в течение ближайших шести месяцев повторяют кровоизлияние, с летальностью до 70%. Сосудистый спазм увеличивает риск развития летальных исходов после субарахноидального кровоизлияния в 2,3 раза и снижает число хороших исходов более чем на 1/3 [12]. Единственный выход для таких пациентов – оперативное лечение: микрохирургическое или эндоваскулярное.
С появлением неинвазивных методов обследования возрастает количество случайно выявленных, неразорвавшихся аневризм. Остается до конца неясным, какие из этих аневризм должны подвергаться оперативному лечению. Очевидно, что в определении показаний для хирургического лечения неразорвавшейся аневризмы следует учиты- вать совокупность факторов риска ее потенциального разрыва. Гемодинамическим факторам здесь отводится ведущая роль.
Другой причиной внутричерепных кровоизлияний являются артериовенозные мальформации (АВМ). В последнее десятилетие значительные успехи достигнуты в эндоваскулярном лечении АВМ. Использование нового эмболизирующего материала Onyx позволило добиться тотального выключения АВМ только эндоваскулярным методом более чем у половины пациентов; в то же время остается достаточно высоким процент осложнений, приводящих к стойкой инвалидизации и смерти. В самой крупной опубликованной моноцентровой серии из 350 пациентов эти показатели составили 7,1 и 1,4% [15]. Наиболее тяжкие осложнения связаны с перипроцедуральными кровоизлияниями, частота которых, по разным данным, варьирует от 2 до 16,7% [16]. Для предупреждения такого рода осложнений возникает потребность в моделировании возможных интраоперационных изменений гемодинамики в АВМ и окружающем мозге.
Последние десятилетия характеризуются революцией в нейрохирургии, связанной с появлением нового приборного и медицинского обеспечения (томография различных типов, оборудование для внутрисосу- дистой хирургии). Это оборудование позволяет получать и использовать информацию о кровотоке непосредственно во время операции. Ставится задача виртуального моделирования хода операции и активного использования результатов моделирования в реальном режиме времени. Исследование гемодинамики головного мозга человека в норме и при патологии является комплексной проблемой, требующей описания общих физиологических закономерностей мозгового кровообращения, получения экспериментальной информации о гемодинамике мозга методами магнитно-резонансной томографии (МРТ), компьютерной рентгеновской томографии (КТ), допплерографии, математического моделирования на основе этих данных. Это позволяет создавать компьютерные модели аномалий (артериовенозные мальформации, артериальные аневризмы) для использования в медицинской практике.
Исключительная сложность сосудистой системы мозга, физиологических механизмов в регуляции мозгового кровообращения, отсутствие полных и надежных экспериментальных данных о мозговом кровотоке объясняют отсутствие в настоящее время единой модели, описывающей течение крови в сосудах мозга. Различные геометрические параметры и механические свойства сосудов (артерий, вен, капилляров), учет влияния на течение форменных элементов крови, высокая вариабельность кровотока в различных структурах мозга вносят существенные сложности в создание адекватных гемодинамических моделей [1, 2, 4, 5, 7–9, 11, 13, 14].
Моделирование гемодинамики головного мозга – это моделирование нестационарного, пульсирующего течения крови по сети сосудов вариативной геометрии с активно реагирующими на пульсации потока стенками. Эта сеть погружена в субстанцию мозга, которая, в свою очередь, находится в твердой черепной коробке. Для создания моделей, которые могут использоваться в реальном режиме времени, необходимо совершенствовать глобальные модели кровотока в мозге в целом. Эти модели должны основываться на данных эксперимента. Данная работа выполнена в рамках проекта комплексного исследования патологических изменений сосудов головного мозга человека, включающего: клинико-физиологический анализ, математическое и компьютерное моделирование, предназначенного для разработки новых подходов к диагностике, прогнозированию и лечению.
В общем виде задачи исследования могут быть сформулированы так. Имеются две операции, схожие по своим визуальным результатам (ангиограммам), но с различными клиническими исходами. Определить гемодинамические причины возникших осложнений и показания к хирургическому лечению у пациентов со случайно выявленными аномалиями сосудов головного мозга.
Глобальная цель исследования – нахождение признаков, параметров, которые качественно и количественно определяют безопасность хирургического лече- ния. Достижение этой цели невозможно без глубокого и всестороннего экспериментального и теоретического исследования гемодинамики сосудов головного мозга.
МАТЕРИАЛ И МЕТОДЫ
В нейрохирургическом центре ННИИПК с помощью прибора Volcano ComboMap проводились измерения давления и скорости кровотока в сосудах головного мозга при наличии аномалий: АВМ и АА. Датчик прибора имеет диаметр 0,36 мм и позволяет измерять с высокой точностью одновременно давление и скорость потока крови в сосудах диаметром более 1,5 мм. Скорость измеряется ультразвуковым допплеровским методом (12 МГц).
Измерения проводили в нескольких точках сосуда, расположенных на различных расстояниях от аномалии. Особый интерес представляют измерения, проводимые в одной и той же точке сосуда до и после операции по устранению сосудистой аномалии. Они позволяют описать качественные свойства и количественные параметры кровотока, сопутствующие аномалии. Полученную информацию (цифровые массивы значений давления и скорости кровотока) обрабатывали, очищали от шумов, в ней выделяли значимые фрагменты и проводили ее компьютерный анализ. Цифровая запись данных велась во время операции непрерывно, графики давления и скорости выводились на экран монитора прибора в реальном режиме времени. В этих цифровых массивах имелись различные шумы, возникающие при передвижении датчика, установлении его в позицию, обеспечивающую устойчивую запись данных. Вследствие этого окончательные данные представлены в виде фрагментов длительностью от 10–15 до 150–200 с.
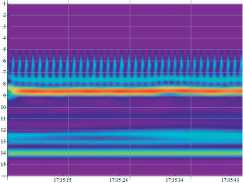
Карта операции включает в себя: клинические данные (дата, вид и локализация аномалии, результат операции); первичные графики давления и скорости потока крови в различных точках сосудов головного мозга на протяжении всей операции; набор фрагментов, соответствующий отрезкам времени, в течение которых проводились измерения в различных точках сосудов. Эти фрагменты содержат очищенные от шумов отрезки графиков давления и скорости, на основании которых выполняются качественный и количественный анализ кровотока. В каждом из фрагментов выполнен вейвлет-анализ цифровых массивов (сигналов) давления и скорости кровотока, на основании которого строились вейвлет-скейлограммы – динамические, нестационарные спектральные портреты.
В период с октября 2011 по апрель 2012 г. в нейрохирургическом центре ННИИПК были проведены 16 операций, во время которых измеряли давление и скорость кровотока, из них в 13 снималась цифровая информация с последующей обработкой и составлением карт операций. Из этих 13 операций внутрисосудистая эмболизация АВМ осуществлялась в шести, АА – в шести, каро-тидо-кавернозного соустья (ККС) в одном случае.
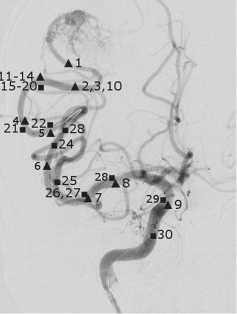
Рис. 1.
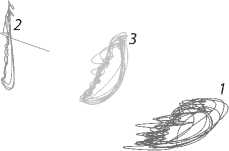
Ангиограмма сосудов с отмеченными положениями датчика.
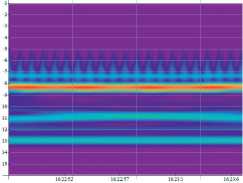
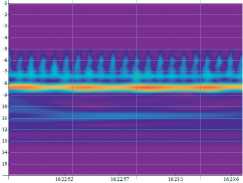
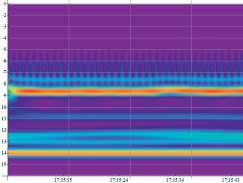
Рис. 2.
Скейлограммы давления и скорости в афференте до операции (а) и после нее (б).
РЕЗУЛЬТАТЫ
Рассмотрим подробнее результаты измерений на примере типичной операции по внутрисосудистой эмболизации АВМ. На рис. 1 приведена ангиограмма сосудов головного мозга в районе АВМ (левый угол снимка) с отмеченными положениями датчика, в которых проводились измерения. Для некоторых позиций проводилось несколько измерений – например, с 15 по 20. Проводник с датчиком виден как светлая кривая в позициях 5, 22. Номера отметок возрастают со временем, положения датчика в моменты до эмболизации отмечены треугольником, после нее – квадратом.
Вейвлет-скейлограммы сигналов, соответствующих этим значениям давления и скорости, показаны на рис. 2. Вейвлет-преобразование одномерного сигнала позволяет анализировать свойства сигнала одновременно в частотном и физическом пространствах. Разложение сигнала производится по специальным локализованным вейв-лет-функциям, зависящим от времени. Результатом вейв-лет-преобразования является двумерный массив амплитуд-значений коэффициентов разложения этого сигнала по базису из вейвлет-функций. В отличие от Фурье-анализа вейвлет-анализ дает динамику спектра нестационарного процесса [1]. Спектр сигнала – это поверхность в трехмерном пространстве, на рис. 2 представлена ее проекция на плоскость (время – частота), при этом частота измеряется в логарифмических переменных.
На скейлограммах хорошо видны линии спектра, отвечающие сердечным сокращениям (частота 1 Гц) и дыхательному циклу. Эти спектральные линии отвечают высоким частотам и не изменяются в процессе операции. Сильнее меняется картина в области низких частот, при этом наблюдаются как расщепления спектральных линий, так и изменение интенсивности сиг- нала на выделенных частотах. Изменение спектра интракраниального кровотока в терминах Фурье-анализа изучалось отечественными нейрохирургами [3].
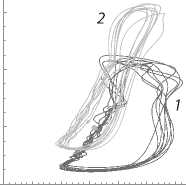
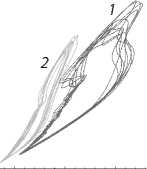
Диаграмма Dp, u давление – скорость (рис. 3, а, в ) представляет собой построенную на плоскости ( p, u ) кривую зависимости p = p (u) , которая соответствует временным зависимостям p = p (t), u = u (t) . При возрастании времени точка пробегает диаграмму против часовой стрелки. Диаграмма DQ E расход – поток энергии (рис. 3, б, г ) строится по данным давления и скорости в сосуде сечением S . Величины Q и E вычисляются по формулам:
,
Е = £(||м|2 -v—^pu-ndS, где ρ, p, й – плотность, давление, скорость потока крови, п – нормаль к сечению сосуда S.
Диаграммы Dp, u и DQ, E сохраняют свою форму вдоль сосуда. Они имеют характерную геометрию, различную для разных аномалий. Эти диаграммы меняют свой размер и положение после операции.
Диаграмма Dp, u для АВМ меняет свое положение на плоскости ( p, u ), переходя из правой нижней части в левую верхнюю. Это объясняется тем, что при эмболизации АВМ аномально высокая скорость в афференте понижается, давление повышается до нормального. Диаграмма DQ, E сохраняет характерную форму пера, но резко уменьшается в размере и перемещается к началу координат на плоскости ( Q, E ). При введении эмболизата диаграмма DQ, E плавно уменьшается в размере и монотонно
Рис. 3.
Фазовые диаграммы D p, u
(слева) и DQ, E (справа) до операции (1), после нее (2) и при частичной (более 90%) эмболизации (3): а, б – АВМ; в, г – АА.
CL s s
в
0,8
g 0,6
0,4
0,2
20 40
V, cм/c
60 80
б
1,0


1,5
o.
s
s
10 20 30 40 50 60
V, cм/c
0,5 1,0
Q, cм3/c
1,5
3 1,0
0,5
0,5 1,0 1,5
Q, cм3/c
сдвигается к началу координат. Это происходит до введения большей части эмболизата (80–90%). Затем, после введения оставшейся части, она резко смещается к началу координат и уменьшается в размере (рис. 3, б ).
При наличии в сосуде АА диаграммы Dp, u и DQ, E имеют характерную S-образную форму. Эта форма сохраняется после эмболизации аневризмы, но сами диаграммы существенно уменьшаются в размерах (рис. 3, в, г ).
Наличие аномалий в сосудистой сети изменяет как гемодинамические (скорость, давление потока), так и прочностные параметры этой сети. АВМ и АА по-разному влияют на прочностные, упругие свойства церебральных сосудов. Диаграмма Dp, u дает своеобразное уравнение состояния аномалии, характеризуя различные механические свойства сети сосудов с аномалией в процессе ее разгрузки ускоряющимся потоком крови и нагрузки – при торможении потока.
Измерения проведены в большом числе сосудов, имеющих диаметры от 1,5 мм до 5 мм. Получены значения для скорости потока 10–150 см/с, давления 20–180 мм рт. ст., при этом скорости свыше 60–80 см/с характеризуют наличие АВМ. Эти данные согласуются со значениями давления и скорости кровотока, получаемыми при транскраниальной допплерографии в проксимальных сегментах артерий виллизиева круга [3].
Обнаружены качественные различия скейлограммы до и после операции. Построены и проанализированы диа- граммы Dp, u (давление – скорость) и DQ, E (расход – поток энергии). Обнаружены качественные различия этих диаграмм для разных видов аномалии (АВМ и АА), установлены качественные и количественные изменения этих диаграмм в процессе операции. Показано, что они наглядно характеризуют степень эмболизации аномалии, в частности, позволяют определить момент полного закрытия артериовенозного шунта еще до ангиографического подтверждения данного события.
ВЫВОДЫ
-
1. Впервые проведено измерение гемодинамических параметров в дистальных церебральных сосудах при различных видах сосудистых аномалий.
-
2. Разработан и внедрен аппарат диаграмм «давление – скорость» и «расход – поток энергии», позволяющий характеризовать тип сосудистой аномалии (АВМ и АА) по гемодинамическим параметрам и отслеживать эффективность операции.
-
3. Создано программное обеспечение, позволяющее визуализировать фазовые диаграммы «давление – скорость» и «расход – поток энергии» в ходе операции, что уже на данном этапе исследования дало возможность хирургу определять момент полного выключения АВМ. Представляется, что правильная интерпретация изменений этих диаграмм в ходе операции позволит выработать критерии прекращения эмболизации и снизить число перипроцеду-ральных кровоизлияний.
-
4. Отмечено качественное изменение спектра вейв-лет-скейлограмм после эмболизации. Более детальный анализ, как качественный, так и количественный, требует дальнейшего всестороннего изучения.
Список литературы Измерения и анализ локальной церебральной гемодинамики у больных с сосудистыми мальформациями головного мозга
- Aстафьева Н.М.//УФН. 1996. Т. 166, № 11. С. 1145-1170.
- Aшметов И.В., Буничева A.Я., Мухин С.И. и др. Компьютер и мозг. Новые технологии. М., 2005.
- Гайдар Б.В., Семенютин В.Б., Парфенов В.Е. и др. Транскраниальная допплерография в нейрохирургии. СПб., 2008.
- Левтов В.А., Регирер С.А., Шадрина Н.Х. Реология крови. М., 1982.
- Медицина в зеркале информатики. М., 2008.
- Мозг: фундаментальные и прикладные проблемы//Вест. РAH. № 5-6. 2010. С. 397-520.
- Парашин В.Б., Иткин Г.П. Биомеханика кровообращения. М., 2005.
- Педли Т. Гидродинамика крупных кровеносных сосудов. М., 1983.
- Петров И.Б.//Труды МФТИ. 2009. Т. 1, № 1. С. 5-16.
- Сибирский международный нейрохирургич. форум: Сб. науч. материалов. Новосибирск, 2012.
- Система кровообращения и артериальная гипертония: биофизические и генетико-физиологические механизмы, математическое и компьютерное моделирование. Новосибирск, 2008.
- Хирургия аневризм головного мозга. Т. I-III.
- Quarteroni A., Tuveri M., Venezani A.//Comput. Visual. Sci. 2000. V. 2. P. 163-197.
- Sforza D.M., Putman C.M., Cebral J.R.//Fluid Mech. 2009. V. 41. P. 91-107.
- Saatci I., Geyik S., Cekirge H.S. et al.//J. Neurosurg. 2011. V. 115 (1). P. 78-88.
- Liu L., Jiang C., He H. et al.//Interv. Neuroradiol. 2010. V. 16 (1). P. 47-57.


