Изолированная химиоперфузия печени у пациента с лейомиосаркомой брыжейки тонкой кишки и метастатическим поражением печени
Автор: Решетов И.В., Мануковский В.А., Демко А.Е., Черемисов В.В., Осипов А.В., Тания С.Ш., Привалов М.А., Бабич А.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.23, 2024 года.
Бесплатный доступ
Актуальность. Лечение нерезектабельных метастатических злокачественных новообразований печени остается проблемой, особенно у больных колоректальным раком. Традиционная системная лекарственная терапия часто неэффективна, а применение трансартериальной химиоэмболизации ограничено в результате системной токсичности некоторых лекарственных веществ. Изолированная химиоперфузия, сочетающая высокую эффективность и низкую системную токсичность, является компромиссом в лечении пациентов с изолированным метастатическим поражением печени. Описание клинического случая. Пациент с диагнозом: Лейомиосаркома брыжейки тонкой кишки, перенес несколько операций и курсов химиотерапии, однако метастазы в печени продолжали прогрессировать. Для проведения изолированной химиоперфузии печени мелфаланом была выполнена сложная хирургическая операция, включающая мобилизацию сосудов в области печени, кроме того, для снижения объема опухоли и профилактики осложнений была проведена атипичная резекция печени.
Изолированная химиоперфузия печени мелфаланом, метастатическое поражение печени, лейомиосаркома
Короткий адрес: https://sciup.org/140305903
IDR: 140305903 | УДК: 616.341-006.363-033.2:616.36-08:615.28 | DOI: 10.21294/1814-4861-2024-23-2-126-132
Текст научной статьи Изолированная химиоперфузия печени у пациента с лейомиосаркомой брыжейки тонкой кишки и метастатическим поражением печени
Лечение пациентов с нерезектабельными злокачественными новообразованиями печени остается нерешенной проблемой [1–3]. Наиболее часто изолированное метастатическое поражение печени наблюдается у больных колоректальным раком [3, 4]. Традиционно пациенты с билобарным поражением печени получают лекарственное лечение, которое не всегда оказывается достаточно эффективным [1, 3]. Другим методом лечения, который может быть применен в таком случае, является трансартериальная химиоэмболизация [2, 5]. Несмотря на высокую эффективность трансартериальной химиоэмболизации печени при первичных и метастатических новообразованиях, ее применение ограничено, поскольку существует риск высокой системной токсичности, так как используемые лекарственные вещества после прохождения печени неминуемо попадают в системный кровоток. К таким препаратам относится мелфалан и фактор некроза опухолей альфа [6–8].
Изолированная химиоперфузия печени (ИХП) представляет собой метод регионарной химиотерапии. Он заключается в сосудистой изоляции печени от системного кровотока и применении изолированного искусственного кровообращения. При этом внутри печени создается высокая концентрация лекарственного препарата, который не попадает в системное русло. Поэтому применение ИХП представляется целесообразным у пациентов с изолированным поражением печени, когда исчерпаны возможности традиционного лечения и необходимо использование токсичных препаратов в высокодозном режиме [6–8].
Клиническое наблюдени е
Пациент Б., 58 лет, с диагнозом: Лейомиосаркома брыжейки тонкой кишки. Состояние после комплексного лечения, включающего резекцию тонкой кишки со стенкой мочевого пузыря в январе 2017 г. Прогрессирование: изолированное метастатическое поражение печени. Атипичная резекция печени в марте 2019 г. Состояние после 14 курсов противоопухолевой лекарственной терапии. Первая линия химиотерапии состояла из схемы доксорубицин + ифосфомид в стандартном режиме, проведено 6 курсов. Вторая линия – па-зопаниб, 4 курса. На фоне III линии лечения (рего-рафениб, 4 курса) наблюдалось прогрессирование заболевания (рис. 1). Учитывая наличие потенциально эффективного препарата в отношении
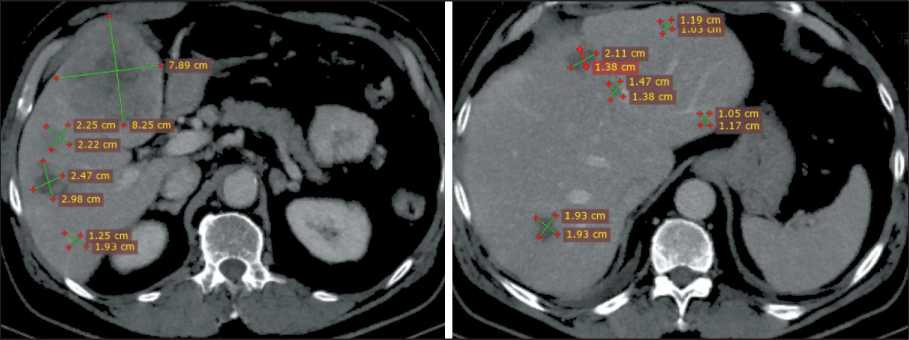
Рис. 1. Компьютерная томография органов брюшной полости. Билобарное метастатическое поражение печени. Примечание: рисунок выполнен авторами
Fig. 1. Computed tomography of the abdomen. Liver metastases in right and left lobes. Note: created by the authors
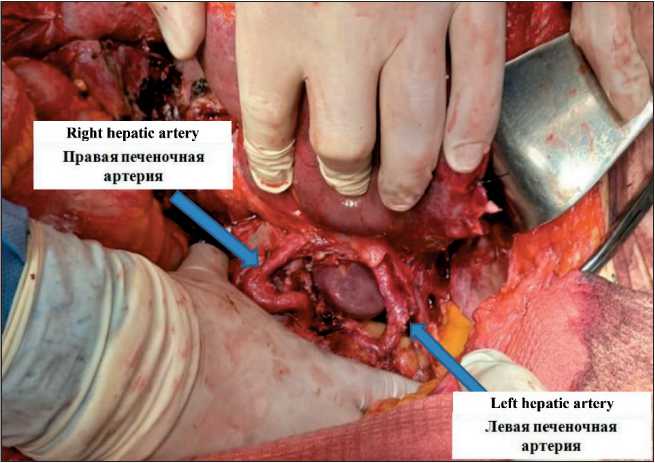
Рис. 2. Интраоперационное фото. 2-й тип артериальной анатомии печени по N.A. Michels.
Примечание: рисунок выполнен авторами Fig. 2. Intraoperative photo. 2 type N.A. Michels.
Note: created by the authors
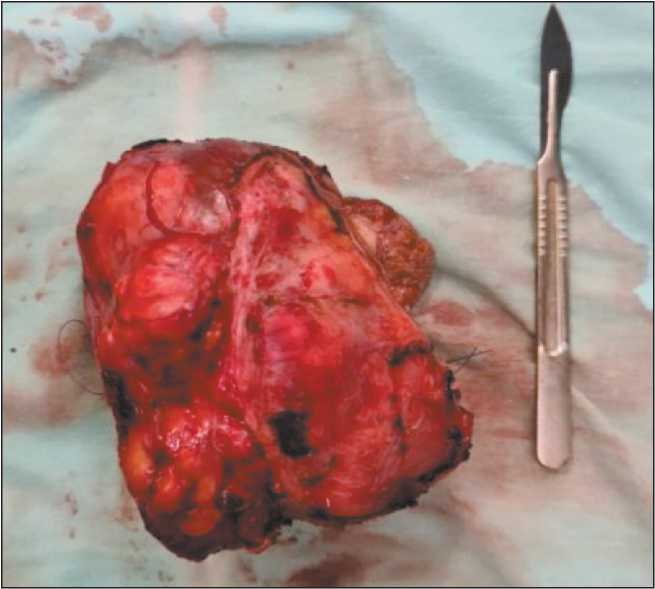
Рис. 3. Макропрепарат. Участок 4-го сегмента печени с новообразованием. Примечание: рисунок выполнен авторами Fig. 3. Macrospeciment. Part of 4 hepatic segment with tumor. Note: created by the authors сарком (мелфалан), принято решение об изолированной химиоперфузии печени мелфаланом.
-
1) в ретропеченочный сегмент НПВ установлена канюля 18 Fr, ее верхушка позиционирована на уровне кавальных ворот;
-
2) НПВ канюлирована в подпеченочном отделе на 1 см выше ее бифуркации, конец канюли 18 Fr направлен в каудальном направлении;
-
3) канюлирована воротная вена, конец канюли 10 Fr направлен в каудальном направлении;
-
4) внутренняя яремная вена канюлирована канюлей диаметром 10 Fr;
-
5) после пережатия общей и собственной печеночных артерий рассечена передняя стенка гастро-дуоденальной артерии и, после получения хорошего ретроградного кровотока, перевязан дистальный конец, в проксимальный конец установлена канюля 10 Fr;
-
6) выполнена артериотомия левой печеночной артерии, в нее установлена канюля диаметром 8 Fr.
Затем замыкались перфузионные контуры: 1-й контур (основной) – подача раствора в правую и левую печеночные артерии, забор крови из ретропеченочного отдела НПВ; 2-й контур (шунт) – забор крови из НПВ (от почек и нижних конечностей) и портальной вены, возврат – во внутреннюю яремную вену. Кровоток по 2-му контуру осуществлялся при помощи центрифужного насоса Maquet без использования резервуара. Скорость кровотока по шунту – 1800–2200 мл/мин. Резервуар основного контура заполнен следующим
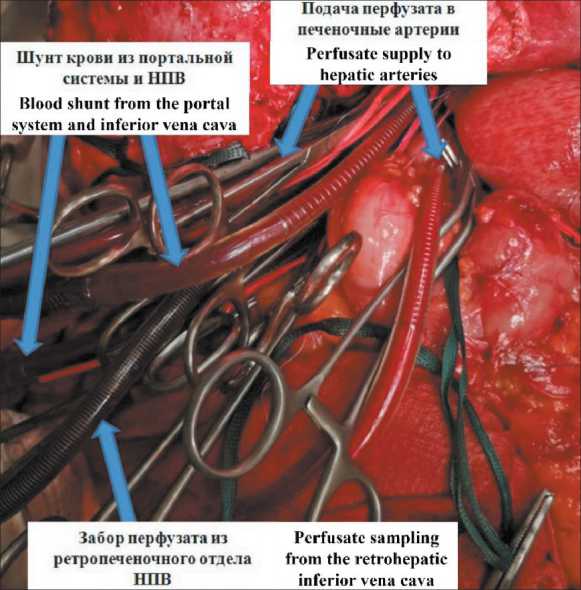
Рис. 4. Интраоперационное фото. Изолированная химиоперфузия печени.
Примечание: рисунок выполнен авторами Fig. 4. Intraoperative photo. Isolated hepatic chemoperfusion.
Note: created by the authors составом: 300 мл эритроцитарной массы, 700 мл физиологического раствора и мелфалан из расчета 1,5 мг на 1 кг массы тела. Содержимое основного контура, перед подачей в печеночные артерии, направлялось в оксигенатор с теплообменником при помощи роликового насоса аппарата искусственного кровообращения Stockert S5. Cкорость перфузии по основному контуру – 1200–1600 мл в мин, давление в артериальной канюле – 120– 180 мм рт. ст. Перфузию проводили в условиях гипероксии и гипертермии при температуре 40 °С. Длительность ИХП – 60 мин (рис. 4). После окончания ИХП печень отмывалась 1500 мл 5 % раствора глюкозы. Были удалены канюли и ушиты места канюляции сосудов, восстановлена целостность левой печеночной артерии, гепарин нейтрализован раствором протамина сульфата. Выполнена холецистэктомия, лапаротомная рана ушита послойно.
Время операции – 4 ч 30 мин. Интраоперационная кровопотеря – около 1200 мл. Осложнений в интраоперационном и послеоперационном периоде не отмечено. Длительность нахождения в отделении реанимации составила 2 сут. Уровни АЛТ и АСТ нормализовались на 4-е сут после операции. Пациент выписан на 9-е сут после операции в удовлетворительном состоянии.
Через 30 сут после ИХП выполнена контрольная мультиспиральная компьютерная томография органов брюшной полости, по данным которой отмечен частичный ответ опухоли по шкале mRECIST (рис. 5).
Обсуждение
Целесообразность применения ИХП при злокачественных новообразованиях печени остается предметом дискуссий [6–10]. Стоит отметить, что среди методов регионарной химиотерапии этот вариант лечения является наименее изученным [7, 8, 10] и не включен в отечественные стандарты лечения первичных и метастатических заболеваний печени. При анализе зарубежной литературы установлено, что ИХП включена в стандарты лечения метастатической увеальной меланомы [7, 11]. В работах некоторых исследователей встречаются данные о применении ИХП у пациентов с метастатическим поражением печени, при прогрессировании колоректального рака или нейроэндокринных опухолей желудочно-кишечного тракта [6, 8‒10]. Авторы делают заключение, что применение ИХП может быть оправдано при изолированном метастатическом поражении печени, когда исчерпаны возможности традиционных методов лечения [6, 9, 10, 12]. Анализ литературы, посвященной лечению с изолированным метастатическим по-
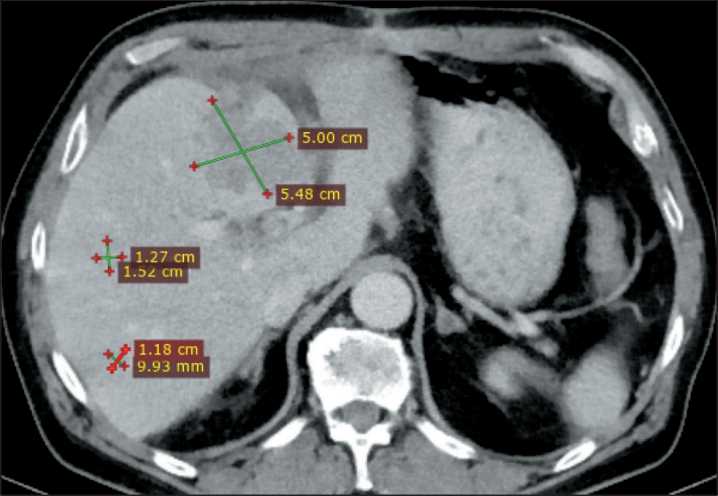
Рис. 5. Компьютерная томография органов брюшной полости через 30 дней после химиоперфузии. Частичный ответ по шкале mRECIST.
Примечание: рисунок выполнен авторами Fig. 5. Computed tomography, 30-day after chemoperfusion. Partial response (mRECIST).
Note: created by the authors
ражением печени при прогрессировании лейомиосаркомы, выявил одну публикацию, в которой систематизирован опыт лечения 331 пациента с изолированным метастатическим поражением печени при прогрессировании сарком различных локализаций. При этом 5-летняя выживаемость пациентов, у которых невозможно выполнить R0 резекцию печени, составила 4 %. Несмотря на неудовлетворительные результаты, авторы считают системную химиотерапию основной лечебной опцией у таких пациентов [13, 14]. Стоит отметить, что в отечественной и зарубежной литературе мы не встретили ни одной публикации о применении ИХП у пациентов с лейомиосаркомой брыжейки тонкой кишки с метастазами в печень.
Полученные нами результаты, а именно частичный ответ новообразования, свидетельствуют о безопасности и обоснованности применения ИХП у пациентов с изолированным метастатическим поражением печени при прогрессировании лейомиосаркомы брыжейки тонкой кишки.
Заключение
Изолированная химиоперфузия мелфаланом является безопасной и технически выполнимой процедурой. Вместе с тем, роль ИХП в лечении пациентов с изолированным метастатическим поражением печени при прогрессировании лейомиосаркомы подлежит уточнению с позиции оценки отдаленных результатов.
Список литературы Изолированная химиоперфузия печени у пациента с лейомиосаркомой брыжейки тонкой кишки и метастатическим поражением печени
- Polikarpov A.A., Tarazov P.G., Granov D.A., Polysalov V.N. Rentgenendovaskulyarnye protsedury v lechenii bol'nykh s nerezektabel'nymi metastazami kolorektal'nogo raka v pecheni. Rossiiskii onkologicheskii zhurnal. 2014; 19(4): 40-1.
- Tarazov P.G., Polikarpov A.A., Granov D.A. Arterial'naya khimioembolizatsiya v lechenii bol'nykh metastazami zlokachestvennogo kartsinoida v pechen'. Annaly khirurgicheskoi gepatologii. 2010; 15(3): 19-24.
- Adam R., Kitano Y. Multidisciplinary approach of liver metastases from colorectal cancer. Ann Gastroenterol Surg. 2019; 3(1): 50-6. https://doi.org/10.1002/ags3.12227.
- Tzeng C., Aloia T. Colorectal Liver Metastases. J Gastrointest Surg. 2012; 17: 195-201. https://doi.org/10.1007/s11605-012-2022-3.
- Gruber-Rouh T., Naguib N., Eichler K., Ackermann H., Zangos S., Trojan J., Beeres M., Harth M., Schulz B., Nour-Eldin A., Vogl T.J. Transarterial chemoembolization of unresectable systemic chemotherapy-refractory liver metastases from colorectal cancer: Long-term results over a 10-year period. Int. J Cancer. 2013; 134: 1225-31. https://doi.org/10.1002/ijc.28443.
- Alexander H.R., Bartlett D.L., Libutti S.K., Pingpank J.F., Fraker D.L., Royal R., Steinberg S.M., Helsabeck C.B., Beresneva T.H. Analysis of factors associated with outcome in patients undergoing isolated hepatic perfusion for unresectable liver metastases from colorectal center.Ann Surg Oncol. 2009; 16(7): 1852-9. https://doi.org/10.1245/s10434-009-0482-9.
- Ben-Shabat I., Hansson C.,Eilard M., Cahlin C., Rizell M., Lindnér P., Mattsson J., Bagge R. Isolated hepatic perfusion as a treatment for liver metastases of uveal melanoma. J Vis Exp. 2015; (95): 52490. https://doi.org/10.3791/52490.
- van Iersel L.B.J., Koopman M., van de Velde C.J.H., Mol L., van Persijn van Meerten E.L., Hartgrink H.H., Kuppen P.J.K., Vahrmeijer A.L., Nortier J.W.R., Tollenaar R.A.E.M., Punt C., Gelderblom H. Management of isolated nonresectable liver metastases in colorectal cancer patients: a case-control study of isolated hepatic perfusion with melphalan versus systemic chemotherapy. Ann Oncol. 2010; 21(8): 1662-7. https://doi.org/10.1093/annonc/mdp589.
- Hafström L.R., Holmberg S.B., Naredi P.L., Lindnér P.G., Bengtsson A., Tidebrant G., Scherstén T.S. Isolated hyperthermic liver perfusion with chemotherapy for liver malignancy. Surg Oncol. 1994; 3(2): 103-8. https://doi.org/10.1016/0960-7404(94)90005-1.
- Rothbarth J., Pijl M.E., Vahrmeijer A.L., Hartgrink H.H., Tijl F.G., Kuppen P.J., Tollenaar R.A., van de Velde C.J. Isolated hepatic perfusion with high-dose melphalan for the treatment of colorectal metastasis confined to the liver. Br J Surg. 2003; 90(11): 1391-7. https://doi.org/10.1002/bjs.4308.
- Huibers A., DePalo D.K., Perez M.C., Zager J.S., Olofsson Bagge R. Isolated hyperthermic perfusions for cutaneous melanoma in-transit metastasis of the limb and uveal melanoma metastasis to the liver. Clin Exp Metastasis. 2023. https://doi.org/10.1007/s10585-023-10234-6.
- Olofsson Bagge R., Nelson A., Shafazand A., All-Eriksson C., Cahlin C., Elander N., Helgadottir H., Kiilgaard J.F., Kinhult S., Ljuslinder I., Mattsson J., Rizell M., Sternby Eilard M., Ullenhag G.J., Nilsson J.A., Ny L., Lindnér P. Isolated Hepatic Perfusion With Melphalan for Patients With Isolated Uveal Melanoma Liver Metastases: A Multicenter, Randomized, Open-Label, Phase III Trial (the SCANDIUM Trial). J Clin Oncol. 2023; 41(16): 3042-50. https://doi.org/10.1200/JCO.22.01705.
- De Matteo R.P, Ami Shah B.S., Fong Y., Jarnagin W.R., Blumgart L.H., Brennan M.F. Results of Hepatic Resection for Sarcoma Metastatic to Liver. Ann. Surg. 2001; 234(4): 540-8. https://doi.org/10.1097/00000658-200110000-00013.
- Dewald C.L.A., Becker L.S., Maschke S.K., Meine T.C., Alten T.A., Kirstein M.M., Vogel A., Wacker F.K., Meyer B.C., Hinrichs J.B. Percutaneous isolated hepatic perfusion (chemosaturation) with melphalan following right hemihepatectomy in patients with cholangiocarcinoma and metastatic uveal melanoma: peri- and post-interventional adverse events and therapy response compared to a matched group without prior liver surgery. Clin Exp Metastasis. 2020; 37(6): 683-92. https://doi.org/10.1007/s10585-020-10057-9.


