Изотопный анализ как метод таксономической идентификации археозоологического материала
Автор: Горлова Е.Н., Крылович О.А., Тиунов А.В., Хасанов Б.Ф., Васюков Д.Д., Савинецкий А.Б.
Журнал: Археология, этнография и антропология Евразии @journal-aeae-ru
Рубрика: Эпоха палеометалла
Статья в выпуске: 1 т.43, 2015 года.
Бесплатный доступ
В статье обсуждаются возможности использования изотопного состава углерода (соотношение 13С/ 12С) и азота (соотношение 15М 14 для таксономической диагностики костных остатков животных из археологических памятников и других древних отложений. Представлен обзор мировой литературы, раскрываются особенности изотопного анализа с точки зрения изучения экологии позвоночных животных и методологические трудности работы с ископаемым материалом. Приводятся также конкретные примеры успешного применения изотопного анализа для видовой идентификации археозоологических остатков, в частности, костей бурого и белого медведей, крупных морских млекопитающих и нескольких видов гусеобразных.
Стабильные изотопы, кости животных, таксономическая диагностика, археозоология
Короткий адрес: https://sciup.org/145145685
IDR: 145145685 | УДК: 571.471.3 | DOI: 10.17746/1563-0102.2015.43.1.110-121
Текст научной статьи Изотопный анализ как метод таксономической идентификации археозоологического материала
Археозоологическим материалом называют субфос-сильные остатки животных, живших в последние тысячелетия [Reitz, 2008]. В обычных условиях этими остатками чаще всего являются элементы внутреннего и внешнего скелета позвоночных и беспозвоночных животных. Они сохраняются в составе естест- венных отложений (в скальных нишах, береговых наносах, мерзлотных толщах, гудроновых озерах, норах млекопитающих и т.д.), но наиболее массовые и многочисленные захоронения фауны прошлого встречаются в культурных слоях археологических памятников [Динесман, 1979; Антипина, 2003; Reitz, Wing, 2008].
Изучение ко стных остатков археофауны важно по многим причинам. При воссоздании истории экосистем археозоологический анализ позволяет получить информацию о видовом составе, численности, пространственном распределении, возрастной и половой структуре отдельных видов, живших в прошлом, а также динамике этих показателей во времени. При реконструкции истории человеческих обществ изучение остатков животных помогает выявить особен-
Археология, этнография и антропология Евразии Том 43, № 1, 2015
ности экономики, торговых связей, основные стратегии прожиточного минимума, установить характер эксплуатации популяций животных, его формы, назначение, сезонность и т.д. Кроме того, важнейшей задачей, объединяющей оба этих направления исследований, является определение степени взаимного влияния популяций животных, человека и окружающей среды.
Для достижения вышеперечисленных целей необходима точная таксономическая диагностика изучаемого археозоологического материала. Определение остатков животных производится, как правило, на базе эталонных сравнительных коллекций скелетов современных животных с четкой видовой принадлежностью, известным полом, возрастом, местом сбора и т.д. Дополнительно привлекаются справочная литература, определители [Громова, 1950; 1960; Gilbert, Martin, Savage, 1985; Hillson, 1986; Gilbert, 1993; и др.] и электронные ресурсы с трехмерными изображениями скелетных элементов (например, . Однако нередко определение по внешним морфологическим признакам до вида невозможно. В таких случаях чаще всего приходится ограничиваться определением до семейства/отряда/ класса или прибегать к генетическому анализу ископаемого материала.
В данной статье рассматривается возможность использования изотопного анализа для идентификации видов животных, сходных по строению скелета, но сильно различающихся по экологии питания.
Общие принципы изотопного анализа
Многие биогенные элементы представлены несколькими стабильными, т.е. не подверженными радиоактивному распаду, изотопами (1Н и 2Н, 12С и 13С, 14N и 15N и т.д.). Различия в соотношении легкого и тяжелого изотопов в разных экологических средах, между видами или в разных тканях формируются в результате целого ряда физико-химических процессов. Связано это преимущественно с тем, что молекулы разной массы (например, 13CO2 и 12CO2) различаются по активности и силе внутренних связей и с разной вероятностью принимают участие в химических реакциях и фазовых переходах [Koch, 2007; Sulzman, 2007]. Изотопный состав элемента обычно измеряют в относительных единицах ( δ ), которые отражают отличия изотопного состава элемента в исследуемом веществе от международного стандарта. Поскольку изменения изотопного состава невелики, величину δ принято умножать на 1000 и выражать в промилле (‰).
В экологических исследованиях чаще всего используют изотопный состав азота (соотношение
15N/14N) и углерода (соотношение 13С/12С). Изотопный анализ широко применяется в экологии, однако в данной работе мы ограничимся рассмотрением его использования при изучении экологии питания животных и определении их трофических связей. Изотопный состав элементов в тканях консументов в целом соответствует изотопному составу потребляемой ими пищи [DeNiro, Epstein, 1978; 1981]. Однако в процессе перехода с одного трофического уровня на другой происходит небольшое изменение изотопного состава. Величина, на которую изменяется изотопный состав ( Δ 13С или Δ 15N), определяется как разница между изотопным составом тканей животного и изотопным составом его пищи ( δ консумента – δ диеты) и называется трофическим фракционированием или коэффициентом трофической дискриминации [Martínez del Rio et al., 2009; Bond, Hobson, 2012]. Таким образом, изотопный состав азота и углерода тканей животного зависит от его положения в трофической цепи и от изотопного состава первичных продуцентов, находящихся в основании пищевой пирамиды в данной экосистеме.
Различиями в величинах δ 13С и δ 15N первичных продуцентов определяются различия между всеми последующими консументами в разных пищевых цепях. Изменчивость изотопного состава продуцентов связана со способами фиксации биогенных элементов, с физическими и климатическими условиями среды, в которой этот процесс происходит, а также с региональной изменчивостью изотопного состава самих биогенных ресурсов [Heaton, 1999; Marshall, Brooks, Lajtha, 2007]. Поэтому в изотопном составе тканей животного помимо информации о его трофическом положении потенциально заложена информация об особенностях местообитаний, в которых оно питалось.
Углерод. Значительные различия δ 13С тканей животных (от –28 до –6 ‰) связаны главным образом с сильной изменчивостью δ 13С первичных продуцентов, находящихся в основании пищевых цепей [Kelly, 2000; Koch, 2007]. Определяется эта вариабельность особенностями фиксации СО2 разными типами растений в разных средах.
Все растения в процессе фотосинтеза дискриминируют 13С в пользу 12С, поэтому их ткани обеднены 13С по сравнению с углеродом СО2 атмосферного воздуха. Степень дискриминации различается у растений, использующих разные пути фотосинтеза [Park, Epstein, 1960; O’Leary, 1988]. Дискриминация против 13С наиболее сильно выражена у растений с циклом Кальвина (С3-растения: большинство наземных и водных продуцентов) и наименее сильно – у растений с циклом Хэтча-Слейка (С4-растения: некоторые злаки, осоки и представители других групп покрытосеменных растений, в основном из южных аридных местообитаний). Отбор изотопов углерода происходит как на стадии ферментативного карбоксилирования, так и в процессе устьичного дыхания. [Heaton, 1999; Marshall, Brooks, Lajtha, 2007].
Величина δ 13С С3-растений в среднем составляет –27 ‰ (от –35 до –21 ‰), а С4-растений равняется –13 ‰ (от –14 до –10 ‰) [Craig, 1953; Ehleringer, Rundel, 1989; Kelly, 2000; Marshall, Brooks, Lajtha, 2007].
Водные растения, как правило, имеют С3 тип фотосинтеза, однако по изотопному составу они обычно обогащены 13С по сравнению с наземными. В среднем значение δ 13С фитопланктона равно –22 ‰, бентосной растительности –18 ‰, а общий разброс значений δ 13С морских и пресноводных продуцентов очень широк: от –32 до –4 ‰ [Dienes, 1980; Keeley, Sandquist, 1992; France, 1995; Kelly, 2000]. Различия между морскими и наземными С3-растениями объясняются в первую очередь тем, что скорость диффузии углекислого газа в воде примерно в 10 000 раз меньше, чем в воздухе. Поэтому концентрация CO2 в прилегающем к фотосинтезирующему растению слое воды быстро уменьшается. В силу этого снижается избирательность карбоксилирующего фермента и падают темпы направленного отбора 12СО2 [O’Leary, 1988; Kelly, 2000]. Сходные процессы обеспечивают и высокую региональную изменчивость δ 13С растительности в океаническом бассейне. В районах с высокой плотностью растительного покрова или высокой продуктивностью (прибрежные или мелководные заросли макрофитов, подледные леса или апвеллинговые зоны) концентрация 13СО2, растворенного в воде, резко увеличивается, по сравнению с менее продуктивными районами, что приводит к повышению значения δ 13С фитопланктона или водорослей [France, 1995; Schell, Barnett, Vinette, 1998; McRoy et al., 2004; Newsome, Clementz, Koch, 2010]. Кроме того, высокая вариабельность величины δ 13С морских продуцентов может объясняться различиями в степени использования растворенного в воде бикарбоната, который обогащен 13С по сравнению с углекислым газом [Kelly, 2000; Szpack et al., 2012]. Размеры и вид водной растительности также влияют на изотопный состав углерода [Goericke, Fry, 1994].
Степень трофической дискриминации изотопов 13С/12С невелика. В среднем значение Δ13С небольшое (0,5–2,0 ‰) и подвержено значительным колебаниям на разных трофических уровнях [Peterson, Fry, 1987; Kelly, 2000; Post, 2002]. Для многих морских сообществ показано, что трофическое обогащение 13С происходит только в начале пищевой цепи, тогда как δ13С консументов второго, третьего порядков и выше соответствует значениям δ13С их диеты [Rau et al., 1983; Wada et al., 1987; Hobson, Welch, 1992; Dehn, 2005]. Поэтому соотношение стабиль- ных изотопов углерода в тканях обычно не используется для определения трофического уровня животного. Напротив, благодаря слабому изменению изотопного сигнала при продвижении по пищевой цепи, величина δ13С тканей животных хорошо отражает усредненный изотопный состав его жертв и первичных продуцентов.
Азот. Изменчивость значений δ 15N позвоночных животных заключена в интервале от –5 до +25 ‰ [Kelly, 2000; Koch, 2007] и зависит как от их положения в цепи питания, так и от изотопного состава азота первичных продуцентов. Значения δ 15N растений определяются в первую очередь доступностью и концентрацией ресурсов азота в окружающей среде и их изотопным составом [Marshall, Brooks, Lajtha, 2007]. Тип почвы, режим увлажненности, глубина корневой системы, наличие или отсутствие микоризы – все эти факторы оказывают большое влияние на величину δ 15N продуцентов [Hedges, Stevens, Koch, 2006].
Значения δ 15N тканей большинства наземных растений варьируют в пределах от –8 до +18 ‰ [Kelly, 2000]. Поскольку величина δ 15N атмосферного азота принята за 0, среднее значение δ 15N тканей азотфик-сирующих растений обычно колеблется в более узких пределах (от –7 до +7 ‰). Морской фитопланктон, как правило, содержит больше 15N по сравнению с наземными продуцентами ввиду более высоких значений δ 15N растворенных нитратов [Sigman, Kash, Casciotti, 2009]. В среднем его значение δ 15N составляет +7 ‰ (от +1 до +16 ‰), за исключением районов океана с преобладанием азотфиксирующих продуцентов [Kelly, 2000].
Величина δ 15N в тканях животных увеличивается в среднем на 2–5 ‰ с каждым трофическим уровнем [Minagawa, Wada, 1984; Hobson, Welch, 1992; Post, 2002]. Механизм трофического фракционирования изотопов азота у животных связан с образованием продуктов выделения. Аминогруппы, содержащие легкие атомы 14N, активнее участвуют в реакциях аминирования и дезаминирования и несколько быстрее выводятся из организма при формировании продуктов азотного обмена. Таким образом, продукты выделения животных обеднены 15N, по сравнению с тканями тела, которые, напротив, обогащены 15N, по сравнению с диетой [Minagawa, Wada, 1984; Fogel et al., 1997; Balter et al., 2006].
Благодаря трофическому фракционированию, величина δ 15N может служить показателем положения животного в трофической цепи или его трофического уровня. Так, ткани хищников более обогащены 15N, по сравнению с тканями травоядных [Bocherens et al., 1997; Kelly, 2000], а ткани высших консументов длинных трофических цепей обогащены, по сравнению с тканями высших консументов коротких трофических цепей [Chamberlain et al., 2005; Dehn, 2005].
Конкретная величина Δ 15N может колебаться в довольно широких пределах, в зависимости от таких факторов, как пол, класс, качество диеты, репродуктивный статус, стадия роста. Азот поступает в организм животного преимущественно из белков, поэтому количество белка в рационе может также влиять на интенсивность фракционирования изотопов азота [Pearson et al., 2003; Robbins, Felicetti, Sponheimer, 2005].
Ввиду особенностей выделительной системы разных групп позвоночных значения коэффициента трофической дискриминации для них могут различаться. Так, у птиц в отличие от млекопитающих основным продуктом выделения является не мочевина, а мочевая кислота, которой соответствует меньшая величина Δ 15N [Mizutani, Kabaya, Wada, 1991; Hobson, 1993].
Физиологическое состояние животных также может влиять на величину Δ 15N. Например, при длительном голодании начинают расходоваться собственные резервы организма, что обусловливает рост содержания 15N [Hedges, Stevens, Richards, 2006; Newsome, Clementz, Koch, 2010]. У самок млекопитающих в период лактации и беременности наблюдается снижение значений δ 15N быстровозобновимых тканей тела. Детеныши, питающиеся молоком матери, наоборот, обогащены 15N по сравнению со взрослыми, т.к. фактически стоят на один трофический уровень выше [Hobson, Sease, 1998; Newsome et al., 2006; Горлова и др., 2012]. Таким образом, при использовании δ 15N в качестве инструмента для оценки трофического положения животного следует учитывать целый ряд факторов и стараться использовать как можно более однородную выборку, в т.ч. по возрасту особей.
Особенности изотопного состава коллагена костей. Трофическое фракционирование, сохранность изотопного сигнала и специфика получаемой информации о питании в большой степени зависят от типа изучаемой ткани. Кость состоит из кристаллов биоапатита, встроенных в органический матрикс, главным образом в структурированный белок коллаген [Fratzl, 2008]. В изотопных исследованиях используют и минеральную, и органическую составляющие кости, однако для реконструкции диеты животных чаще всего измеряют изотопный состав коллагена [Hedges, Stevens, Koch, 2006].
Коллаген кости обладает относительно стабильной структурой и может о ставаться в неизменном виде длительное время. В умеренном климате изотопный сигнал коллагена костей сохраняется в течение 30–50 тыс. лет [Hedges, Stevens, Richards, 2006], а в условиях хорошей сохранности – 1 млн лет и более [Koch, 2007]. Это делает возможным изучение экологии животных, живших в далеком прошлом [Bocherens et al., 1997; Stevens et al., 2008; Misarti et al., 2009]. Степень сохранности коллагена принято оценивать по его элементному составу. В норме моле- кула коллагена, не подвергавшаяся диагенетическим изменениям, включает ок. 10 % азота (по массе), а атомарное соотношение C/N находится в интервале от 2,9 до 3,6 [DeNiro, 1985; Ambrose, 1990]. Отклонение от этих величин указывает на плохую сохранность коллагена.
Изотопный состав организма является отражением изотопного состава его пищи, усредненного за определенный интервал времени. Скорость обмена, т.е. время, за которое после перемены питания изменяется атомарный состав ткани, зависит от скорости ее возобновления [Kelly, 2000]. Быстровозобновимые ткани, такие как кровь и печень практически полностью обновляются в течение нескольких дней или недель [Tieszen et al., 1983; Hobson, Clarck, 1992]. Обновление мышечной и костной ткани происходит значительно медленнее. Как показали лабораторные исследования, у птиц коллаген кости после смены диеты обновляется в пределах года [Hobson, Clarck, 1992]. У млекопитающих скорости обмена в несколько раз ниже [Tieszen et al., 1983]. Наиболее быстро состав кости меняется в процессе интенсивного роста, но изменения продолжаются, даже после наступления половой зрелости: происходят резорбция старой костной ткани (как биоапатита, так и коллагена) и отложение новой [Ромер, Парсонс, 1992]. Однако доля таких метаболических и репарационных изменений составляет всего 0,1–0,2 % в год [Hesslein, Hallard, Ramlal, 1993]. Соответственно, полное изменение состава коллагена кости в ответ на изменения изотопного состава пищи занимает от нескольких месяцев в период интенсивного роста до нескольких лет у медленно растущих или окончивших свой рост животных.
Отдельные аминокислоты в составе белков несколько отличаются по величине δ 13С и δ 15N. В силу этого особенности аминокислотного состава разных тканей влияют на их изотопный состав и на степень трофической дискриминации. Ввиду высокого содержания глицина коллаген, как правило, обогащен 13С на 2–4 ‰ по сравнению с мышечными белками или кровью и примерно на 5 ‰ – по сравнению с углеродом диеты в целом [Hedges, Stevens, Koch, 2006]. При сопоставлении значений изотопного состава коллагена костей разных видов рекомендуют использовать коэффициенты трофической дискриминации 0–2 ‰ для углерода и 3–5 ‰ для азота [Bocherens, Drucker, 2003].
Изменения изотопного состава атмосферы во времени. Изотопный состав атмосферы существенно менялся на протяжении последних столетий и ранее. Доказано, что в последние 150 лет произошло антропогенное снижение δ13С CO2, называемое также эффектом Зюсса [Keeling, Moor, Tans, 1979; Francey et al., 1999; Marshall, Brooks, Lajtha, 2007]. Сжигание ископаемого топлива и изменения в землепользовании в индустриальный период привели к росту поступления в атмосферу обедненного 13С углекислого газа, тогда как его концентрация возросла примерно на 30 %, что обеспечило снижение δ13С атмосферного углекислого газа примерно на 1,5 ‰ [Francey et al., 1999; IPCC, 2001; Marshall, Brooks, Lajtha, 2007]. Изотопный состав углерода на всех уровнях трофической цепи отражает изотопный состав исходного ресурса, поэтому снижение δ13С на протяжении последних 150 лет наблюдается в тканях растений [Feng, 1999; Bale et al., 2011; Yakir, 2011] и животных [Hirons, Schell, Finney, 2001; Bump et al., 2007; Newsome et al., 2007]. Существенное увеличение концентрации CO2 в плейстоцене, после окончания последнего оледенения 12–15 тыс. л.н. [Idermühle et al., 1999], также вызвало снижение δ13С на всех уровнях пищевой цепи [Bump et al., 2007]. Таким образом, при сравнении изотопного состава в разные периоды необходимо использовать поправку, учитывающую изменения δ13С атмосферного углекислого газа во времени.
Материал и методы
В данном исследовании для изотопного анализа использованы кости современных и древних животных. Современные образцы были отобраны из скелетов 12 бурых медведей ( Ursus arctos ), 10 белых медведей ( U. maritimus ), 2 белолобых гусей ( Anser albifrons ), 1 гуменника ( A. fabalis ), 2 белых гусей ( A. caerulescens ), 4 гусей-белошеев ( A. canagica ) и 1 малой канадской казарки ( Branta hutchinsii ). Они взяты из сравнительной эталонной остеологической коллекции лаборатории биогеоценологии и исторической экологии (ИПЭЭ РАН) им. В.Н. Сукачева и материалов полевых сборов.
Древние образцы получены в результате раскопок археологического памятника Канискак (побережье Берингова прол., Чукотка) и нескольких береговых отложений Командорско-Алеутской гряды. Из древнего поселения Канискак, формирование культурных слоев которого датируется 2500±200 л.н., проанализировано 28 субфоссильных костных фрагментов представителей медвежьих. Из береговых отложений на Командорских и Алеутских о-вах получено 50 фрагментов костей морской коровы ( Hydrodamalis gigas ), из каждого был взят образец для изотопного анализа. Кости млекопитающих для изотопного анализа отбирались таким образом, чтобы исключить из рассмотрения остатки молодых животных, питавшихся или недавно переставших питаться молоком матери.
Из каждой кости были выделены образцы коллагена модифицированным методом, рекомендуемым для подготовки радиоуглеродных образцов [Longin, 1971; Jørkov, Heinemeier, Lynnerup, 2007]. При по- мощи электрического гравера с поверхности ко сти срезали верхний загрязненный слой, затем вырезали фрагмент компактной части кости весом примерно 0,2–0,5 г. Минеральную составляющую кости удаляли в 1M растворе соляной кислоты в течение 48 ч при температуре 2–4 ºС, после чего образец тщательно отмыли от солей дистиллированной водой. Далее при температуре 90 ºС в течение 24 ч коллаген растворяли в соляной кислоте (pH=2,5), высушивали в сушильном шкафу и измельчали. Современные образцы перед декальцинацией обезжиривали 10 %-м раствором бутанола [Nagai, Suzuki, 2000].
Навески сухого коллагена по 450–550 мкг упаковали в оловянные капсулы. Определение изотопного состава проводили на элементном анализаторе (Thermo Flash 1112) и изотопном масс-спектрометре Thermo DeltaV Plus в Центре коллективного пользования при ИПЭЭ им. А.Н. Северцова РАН.
Изотопный состав азота и углерода выражали в тысячных долях отклонения от международного стандарта, δ , ‰:
δX = [(Rобразца / Rстандарта) - 1] × 1000, где X – это 15N или 13C, а R – соответствующие соотношения 15N/14N или 13C/12C.
Для азота в качестве международного стандарта был принят N2 атмосферного воздуха, для углерода – «венский» эквивалент белемнита PeeDee формации (VPDB). Оборудование было откалибровано относительно стандартных материалов, предоставленных МАГАТЭ (глутаминовая кислота USGS 40 ( δ 15N = –4,5 ‰; δ 13C = –26,4 ‰), USGS 41 ( δ 15N = = +47,6 ‰; δ 13C = +37,6 ‰) и целлюлоза IAEA-CH3 ( δ 13C = –24,7 ‰)). В качестве рабочего лабораторного стандарта использовали ацетанилид ( δ 15N = –4,7 ‰; δ 13C = –26,8 ‰). Аналитическая погрешность измерения была в пределах < 0,2 ‰ для δ 15N и < 0,15 ‰ для δ 13C.
Вместе с определением изотопного состава во всех пробах устанавливались общее содержание углерода и азота (% N, % C) и атомарное соотношение C/N, служащих индикаторами сохранности белка. Образцы коллагена, в которых общее содержание азота составляло менее 10 % или атомарное соотношение C/N не укладывалось в интервал 2,9–3,6, были исключены из рассмотрения [DeNiro, 1985; Ambrose, 1990].
При сравнении величин δ 13C современных и древних образцов была введена поправка на эффект Зюсса. Для современных животных из наземных экосистем мы использовали величину, равную изменению δ 13C атмосферного CO2 в индустриальный период, что составило +1,5 ‰ [Francey et al., 1999; Yakir, 2011], для современных животных из морских экосистем – поправку +1,2 ‰, рассчитанную для северной части Тихого океана [Misarti et al., 2009].
Использование анализа стабильных изотопов для таксономической диагностики
Медвежьи в добыче древних зверобоев Чукотки. В последние тысячелетия в прибрежных районах Чукотского п-ова была распространена культура морских зверобоев [Диков, 1979; Крупник, 1989; Бронштейн, Днепровский, 2001, 2012]. Остеологические спектры из культурных слоев древних поселений показывают, что основой жизнеобеспечения населения являлась охота на морских млекопитающих и птиц; тундровый промысел был второстепенным, но постоянным занятием [Динесман и др., 1996; Динесман, Савинецкий, 2003; Горлова, Васюков, 2013].
Помимо охоты на тюленей, моржей, китообразных, песца и северного оленя традиционным занятием в жизни берегового населения был промысел медвежьих [Арутюнов, Сергеев, 1975; Динесман и др., 1996]. В количественном отношении доля медведей в общей добыче была невелика (менее 1 % от всех млекопитающих) и не могла конкурировать с объемами промысла основных промысловых видов – тюленей и моржей. Однако ко сти медвежьих встречаются в культурных слоях разных периодов бытования зверобойной культуры, т.е. охота на медведей, по-видимому, была регулярным занятием аборигенного населения на протяжении тысячелетий.
Определяя остеологический материал из древних поселений зверобойной культуры, мы столкнулись с проблемой таксономической диагностики медвежьих. В современных экосистемах Чукотского п-ова обитает два вида медведей – бурый и белый. Из обнаруженных при раскопках древнего поселения Канискак (66°02′ с.ш., 169°56′ з.д.) 28 фрагментов костей медвежьих 5 ед. визуальным способом были определены как принадлежавшие белому медведю и 1 ед. – бурому. Остальные 22 фрагмента до вида определить не удалось, т.к. они представляли собой плохо определимые элементы скелета (преимущественно фаланги пальцев).
Для точной видовой диагностики костных остатков и выявления соотношения двух видов медведей в добыче древних охотников использовался изотопный анализ. Как уже отмечалось, содержание тяжелых изотопов азота и углерода в морских экосистемах значительно выше, чем в наземных [Kelly, 2000; Chamberlain et al., 2005; Dehn, 2005]. Белый медведь – морской хищник, основной добычей которого являются морские млекопитающие [Hobson, Welch, 1992]. Бурый медведь всеяден, но в его рационе, даже в примор- ских экосистемах, преобладают наземные ресурсы [Барышников, 2007]. Изотопный состав тканей этих двух видов различается и поэтому служит хорошим индикатором видовой принадлежности.
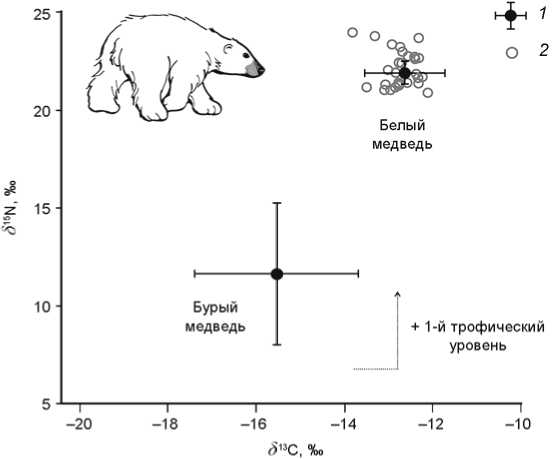
Результаты изотопного анализа коллагена костей современных медвежьих из прибрежных экосистем Чукотского п-ова наглядно продемонстрировали различия в питании между видами (рис. 1). По изотопному сигналу белый медведь – высший консумент в морской трофической сети, тогда как изотопный состав бурого медведя отражает смешанное питание. Изотопный анализ субфоссильных образцов позволил с точностью установить, что все обнаруженные в культурном слое остатки медвежьих, в т.ч. образец, первоначально идентифицированный по морфологическим признакам как кость бурого медведя, принадлежали белому медведю.
Полное отсутствие остатков бурого медведя на поселении довольно неожиданно, поскольку в современных экосистемах Чукотки бурый медведь является видом, постоянно присутствующим в безледный период, тогда как белый медведь – лишь эпизодически [Туманов, 2003; Барышников, 2007]. Одной из причин, объясняющих отсутствие бурого медведя в о статках добычи древних морских зверобоев, может быть относительно недавнее изменение распространения этого хищника. Возможно, 2500±200 л.н. граница ареала бурого медведя проходила южнее и не включала приморские районы полуострова. Натуралисты братья Краузе, работавшие летом 1881 г. в
Белый медведь
^,3С. %«
Бурый медведь
+ 1-й трофический уровень
Рис. 1 Изотопный состав коллагена костей современных бурого (n = 12) и белого (n = 10) медведей Чукотки и медведей из древнего поселения Канискак (n = 28). Величины δ 13С современных животных скорректированы с учетом изменения состава атмосферы. 1 – современные (среднее ± стандартное отклонение); 2 – древние.
приморских районах Северо-Восточной Чукотки, в своих путевых заметках отмечали отсутствие бурого медведя [To the Chukchi peninsula…, 1993]. Сегодня бурый медведь в прибрежных районах полуострова встречается повсеместно.
Расширение ареала бурого медведя могло быть следствием культурно-экономических изменений в регионе. Широкое применение современным местным населением огнестрельного оружия и промышленные выловы морских млекопитающих обусловили увеличение отходов промысла. На протяжении тысячелетий традиционным оружием морского зверобоя был гарпун, который прочно заякоривается в теле жертвы, не давая ей уйти от охотника. В XIX в. среди населения стало распространяться огнестрельное оружие. При охоте с ружьем или винтовкой вероятность того, что раненое животное уйдет от преследователя или утонет до того, как охотник успеет подплыть к нему на каяке, гораздо выше [Файнберг, 1991]. Бурых медведей могли привлечь береговые свалки, появившиеся в связи с возросшими объемами промысла, а также увеличившиеся выбросы раненых и погибших морских млекопитающих. По своему изотопному сигналу измеренные нами бурые медведи полуострова занимают промежуточное положение между морскими и наземными хищниками, что свидетельствует об активном питании морскими выбросами и не противоречит нашей гипотезе.
Определение остатков морской коровы. До середины XVIII в. на Командорских о-вах обитала ныне вымершая морская, или Стеллерова, корова. По описанию Георга Стеллера – первого и единственного натуралиста, видевшего этих животных живьем, – морские коровы были крупными морскими млекопитающими, по размерам превосходящими всех современных сиреновых. В длину они достигали более 7 м и весили несколько тонн. Это были медлительные животные, питавшиеся только морскими водорос- лями в прибрежной зоне [Гептнер и др., 1967]. Считается, что причиной их полного исчезновения стал интенсивный промысел. Вид был открыт экспедицией Беринга в 1741 г. По приблизительным оценкам на тот момент командорская популяция насчитывала 1,5–2,0 тыс. особей. В последний раз коров видели на о-ве Медном в 1754 г., на о-ве Беринга – в 1768 г. [Там же]. Морская корова в голоцене обитала также на Алеутских о-вах, но время ее исчезновения неизвестно [Corbett et al., 2008]. Наиболее поздний образец морской коровы (один фрагмент ребра) был обнаружен в 1998 г. в ходе археологических раскопок на о-ве Кыска. Его радиоуглеродная дата 910 л.н.
Представители рода Hydrodamalis в плейстоцене были распространены от Калифорнии до Японии [Whitmore, Gard, 1977], но большое количество костей H . gigas голоценового времени встречается только в береговых отложениях на Командорских о-вах [Савинецкий, 1992], несколько фрагментов было найдено при археологических раскопках на Алеутских о-вах [Corbett et al., 2008]. Остеологические о статки морской коровы включают в основном фрагменты ребер, которые хорошо определяются по следам пахиостоза (сильное разрастание компактной части кости) [Гептнер и др., 1967]. Однако пахиостоз характерен и для некоторых китообразных, в связи с чем определение небольших фрагментов ребер плохой сохранности визуальным способом может быть ошибочным.
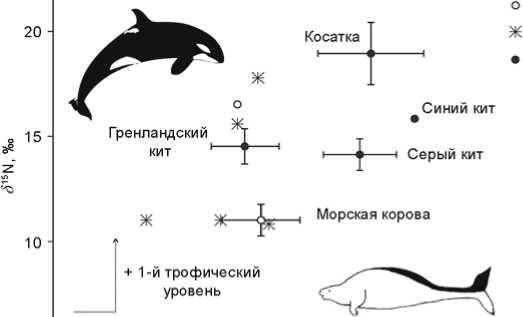
Применение изотопного анализа для идентификации ко стей морской коровы было предложено Д. Корбет с соавторами [Corbett et al . , 2008]. Морская корова – единственное травоядное морское млекопитающее в этом районе и поэтому хорошо отличается от китообразных по изотопному составу коллагена (рис. 2). Гренландский ( Balaena mysticetus ), серый ( Eschrichtius robustus ) и синий ( Balaenoptera musculus ) киты, питающиеся зоопланктоном, а также хищные
-18 -16 —14 -12 -10
<>‘UC, %O
Рис. 2. Изотопный состав (среднее ± стандартное отклонение) коллагена костей из голоценовых отложений Командорско-Алеутской гряды: «морских коров» (n = 49 – наши данные ( 1 ), n=3 – по: [Corbett et al., 2008] ( 2 )) и современных китообразных Берингова моря ( 3 ): гренландский кит (n = 3) [Schoeninger, DeNiro, 1984], серый кит (n = 3) [Newsome et al., 2009], синий кит (n = 1) [Schoeninger, DeNiro, 1984], а также зубного дентина косатки (n > 200) [Newsome et al., 2009]. Значения δ 13С современных животных скорректированы с учетом изменений состава атмосферы. Три образца, первоначально отнесенные к морской корове, принадлежали китообразным.
косатки ( Orca orca ) относятся к более высоким трофическим уровням, им соответствуют большие значения δ 15N [Sсhoeninger, DeNiro, 1984; Newsome et al., 2009].
В работе Корбет с соавторами [Corbett et al., 2008] приводятся данные измерений обнаруженных в голоценовых отложениях пяти ребер, которые были определены как принадлежавшие морской корове. На основании изотопного состава подтверждена видовая принадлежность только трех ребер; определения для двух ребер оказались ошибочными, ребра отно си-лись к другим видам морских млекопитающих, занимающим более высокий трофический уровень.
Нами измерен изотопный состав коллагена 50 фрагментов ребер из голоценовых отложений на Командорских и Алеутских о-вах; визуально они были определены как принадлежавшие морской корове. Было установлено, что 49 обломков принадлежали травоядному млекопитающему и хорошо отличались по изотопному составу от костей остальных морских животных региона. Только один фрагмент кости из материала с о-ва Булдырь не соответствовал диапазону, характерному для морской коровы и, видимо, относился к киту.
Определение костей гусиных. Изотопный анализ проводился только на современных образцах, однако он также продемонстрировал возможности таксономической идентификации на основании различий величин δ 13С и δ 15N.
При определении остатков авифауны с поселений древних жителей Берингоморья было невозможно разделить некоторые виды гусиных. Например, гусь-белошей и малая канадская казарка имеют большое сходство по морфологии костей. Однако эти два вида четко различаются по поведению и питанию. Если казарка, как большинство гусиных этого региона, в течение всего года предпочитает держаться тундровых районов, то белошей во время пролета и на зимовке кормится в основном в прибрежной зоне морской растительностью и беспозвоночными [Petersen, 1983; Eichholz, Sedinger, 2006; Hupp, Schmutz, Ely, 2008].
Изотопный состав коллагена костей этих птиц отражает различия в питании (рис. 3). В нашем распоряжении имелся, к сожалению, только один скелет малой канадской казарки, поэтому мы измерили изотопный состав некоторых других гусиных, которые, как и казарка, бóльшую часть года придерживаются внутренних районов и питаются тундровой растительностью [Портенко, 1972]. Значения δ 13С и δ 15N большинства гусеобразных соответствуют первичным консументам наземной трофической сети, тогда
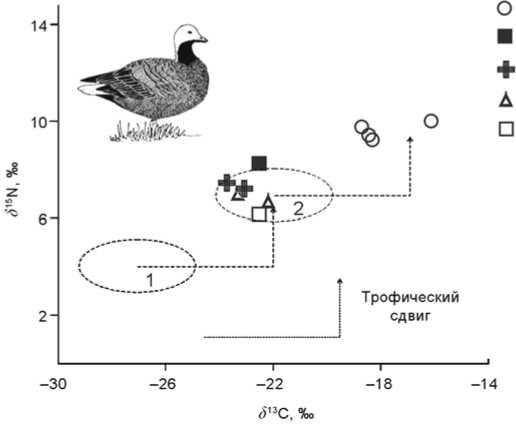
Рис. 3. Изотопный состав коллагена костей современных гусеобразных Берингоморского региона. Трофический сдвиг показывает значения Δ диета–коллаген для птиц.
Примерные средние значения δ 13С и δ 15N растительности: 1 – наземной;
2 – морской.
1 – белошей; 2 – малая канадская казарка; 3 – белый гусь; 4 – белолобый гусь; 5 – гуменник.
как белошеи отличаются от них и отвечают морским консументам. Эти различия могут быть использованы при определении костей гусеобразных из археологических памятников.
Заключение
Изотопный анализ может служить инструментом таксономической диагностики и быть доступной альтернативой палеогенетическому методу в тех случаях, когда рассматриваются виды, занимающие резко отличные местообитания и/или имеющие большие различия в питании. Например, морские и наземные животные настолько хорошо отличаются от травоядных и хищных по изотопному составу, что эти различия не перекрывает внутривидовая вариабельность изотопного состава. Применение данного метода к видам, имеющим не столь радикальные различия в экологии, зависит от соотношения диапазона внутри- и межвидовой изменчивости, а также требует подробного исследования изотопного состава современных представителей видов.
Список литературы Изотопный анализ как метод таксономической идентификации археозоологического материала
- Антипина Е.Е. Археозоологические исследования: задачи, потенциальные возможности и реальные результаты //Новейшие археозоологические исследования в России: к столетию со дня рождения В.И. Цалкина. -М.: Языки славян. культуры, 2003. -С. 7-33.
- Арутюнов С.А., Сергеев Д.А. Проблемы этнической истории Берингоморья: (Эквенский могильник). -М.: Наука, 1975. -240 с.
- Барышников Г.Ф. Медвежьи (Carnivora, Ursidae). -СПб.: Наука, 2007. -541 с. -(Фауна России и сопредельных стран. Нов. сер., № 147; т. 1: Млекопитающие, вып. 5).
- Бронштейн М.М., Днепровский К.А. Жилище морских зверобоев древней Чукотки//Памятники культуры. Новые открытия: письменность, искусство, археология. -М.: Наука, 2001. -С. 587-619.
- Бронштейн М.М., Днепровский К.А. Эквен: история изучения (1961-2011)//Вехи на мысах: к 80-летию чл.-кор. РАН С.А. Арутюнова. -М.: Изд-во Гос. музея Востока, 2012. -С. 20-31.


