Изучение антиаритмических свойств некоторых производных b-цитизина
Автор: Юсупов А.Р.
Журнал: Экономика и социум @ekonomika-socium
Рубрика: Современные науки и образование
Статья в выпуске: 8 (27), 2016 года.
Бесплатный доступ
В статье рассматривается влияние вновь синтезированных производных (b)-цитизина на течение аконитиновой модели аритмии.
(b)-цитизин, аритмия, аконитин
Короткий адрес: https://sciup.org/140121302
IDR: 140121302
Текст научной статьи Изучение антиаритмических свойств некоторых производных b-цитизина
The article discusses the impact of the newly synthesized derivatives ( β ) -tsitizina for a akonitin model arrhythmias.
Предупреждение и лечение сердечнососудистых заболеваний - это одна из наиболее актуальных проблем в современной медицине, приобретающая с ростом социального благосостояния и технического прогресса все большее социально - экономическое значение. Ежегодно в России от сердечнососудистых заболеваний умирает 1 млн. человек, при этом наблюдается продолжающийся рост заболеваемости. Одними из наиболее частых и тяжелых осложнений в кардиологии являются нарушения сердечного ритма – аритмии.
Алкалоид (β)-цитизин является одним из наиболее доступных в ряду хинолизидиновых алкалоидов. Он содержится в растениях семейства бобовых (leguminosae), родов: люпин (lupunus), ракитник (cytisus), софора(sophora), термопсис (thermopsis), песчаная акация (ammodendron), а также в некоторых растениях семейства маревых(chenopodiaceae), маковых (papaveraceae), кувшинковых (nymphaeaceae). Цитизин и его производные привлекают внимание исследователей благодаря широкому спектру биологической активности (спазмалитической, инсектицидной, ноотропной, анальгетической), которая обусловлена его высоким сродством к никотинацетилхолиновым нейрорецепторам. В последние два десятилетия (β)-цитизин стал популярной исходной матрицей для синтеза веществ с потенциальными фармакологическими свойствами [1].
Материалы и методы исследования
Ранее в лаборатории биоорганической химии УНЦ РАН было установлено, что хинолизидиновые алкалоиды обладают антиаритмическими свойствами. Некоторые производные 12-N-β-гидроксиэтилцитизина, проявляют высокую антиаритмическую активность, на аконитиновой модели аритмии in vivo, сравнимую с активностью препарата аллапинин (гидробромид дитерпенового алкалоида лаппаконитина) [2].
Поэтому, с целью поиска новых антиаритмических агентов среди производных ( β ) - цитизина, в лаборатории биоорганической химии
Института органической химии УНЦ РАН был синтезирован ряд производных соединения с заместителями в 2-пиридоновом ядре и проведен скрининг их антиаритмической активности:
3-Нитро-12- N -β-гидроксиэтилцитизин ( 1 ), 3-Бром-12- N -β-гидроксиэтилцитизин ( 2 ) 3,5-Дибром-12- N -β-гидроксиоксиэтилцитизин( 3 ) 5-Хлор-12- N -β-гидроксиэтилцитизин ( 4 ) 3,5-Дихлор-12- N -β-гидроксиэтилцитизин ( 5 )
Введенные дозы ислледуемых соединений:
-
1. 0,1 мг/кг
-
2. 0,15 мг/кг
-
3. 0,2 мг/кг
-
4. 0.25 мг/кг
В эксперименте использовали крыс линии Wistar обоего пола массой 180-200 гр. Животных распределяли на контрольныую и опытные группы. В каждой экспериментальной группе было по 6 голов. Всего в опыте было использовано 120 животных.
Исследуемые соединение вводили профилактически внутривенно за 3 -5 минуты до введения аритмогена аконитина. Электрокардиограмму (ЭКГ) регистрировали во II стандартном отведении на 3, 5, 10, 15, 20 и т.д. минутах. Продолжительность аритмий в контрольной группе в среднем составляла 1,5 - 2 часа. Активность соединений оценивали по их способности предотвращать развитие нарушений сердечного ритма под влиянием аритмогенов и/или пролонгации латентного периода возникновения аритмии, уменьшению продолжительности аритмии.
Эффективность данных соединений также была оценена на хлоридкальцевой (CaCl2) модели аритмии.
Исследуемые соединения вводили внутривенно за 2 минуты до введения кальция хлорида. Электрокардиограмму регистрировали во II стандартном отведении. За критерий антиаритмического эффекта принимали уменьшение в процентах случаев летальной фибрилляции и процент предотвращения изучаемым соединением гибели животных.
Математико-статистическую обработку данных проводили с использованием лицензионного пакета прикладных программ «STATISTICA» v.7.0 (StatSoft Inc., США).
Результаты исследований и их анализ
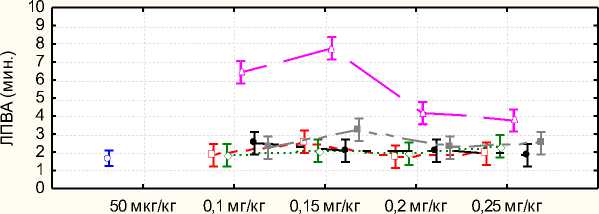
График 1 иллюстрирует зависимость латентного периода возникновения
Доза (мг/кг)
Контроль
Нитро-12-N -p-гидроксиэтилцитизин
ЗЕ 3-брOM-12-N- p-гидроксиэтилцитизин ~4~ 3,5-дибром-12-N- гидроксиэтилцитизин
5 5-ХЛ ор-12- N- р-гидроксиэтилцитизин ~j~ 3,5-ДИXЛOр-12-N-p-гидроксиэтилцитизин аритмия возникала на 1 – 2 минутах после введения аритмогена.
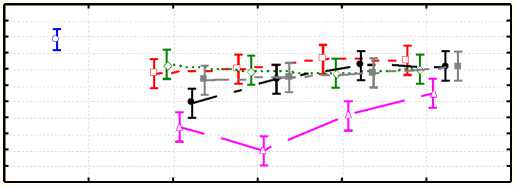
График 2 иллюстрирует зависимость продолжительности аритмии (ПА, мин) от типа введенного соединения и его дозировки
I
Доза (мг/кг)
50 мкг/кг 0,1 мг/кг 0,15 мг/кг 0,2 мг/кг 0,25 мг/кг
Контроль
ЗЕ Нитро-12-N -p-гидрокс иэт илцит изин
ЗЕ 3- б ром -12- N- p-гидрокс иэт илцит изин ~4~ 3,5-дибром-12-N- гидроксиэтилцитизин
Н" 5-XЛOр-12-N- p-гидроксиэтилцитизин
-j~ 3,5-ДИXЛOр-12-N- p-гидроксиэтилцитизин
мин. 3,5-дибром -12-N- β -гидроксиэтилцитизин в дозе 0,15 мг/кг способствовала более раннему востановлению нормального ритма.
Профилактическое внутривенное введение крысам 3,5-дибром-12- N -β-гидроксиэтилцитизина в дозе 0,15 мг/кг предотвращало смертельную фибрилляцию желудочков у 33,3% животных, тогда как в контрольной группе смертность составила 100%.
В результате проведенного исследования установлено, что из всех изученных соединений антиаритмическую активность проявляет соединение - 3,5-дибром-12-N- β -гидроксиэтилцитизин (рис. 2) в дозе 0,15мг/кг.
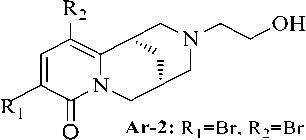
Рис. 1. 3,5-дибром-12-N- β -гидроксиэтилцитизин
Список литературы Изучение антиаритмических свойств некоторых производных b-цитизина
- Кушаковский М.С. Аритмии сердца. Руководство для врачей СПб.: Гиппократ, 1992. -стр. 6-7 (465с)
- R. Yu. Khisamutdinova, N.N. Yarmukhamedov, S.F. Gabdrakhmanova, L.T. Karachurina, T.A. Sapozhnikova, N.Z. Baibulatova, N. Zh. Baschenko, F.S. Zarudii. Synthesis and Antiarrhitmic Activity of N-(2-hydroxyethyl) cytisine hydrochloride and 3-(2-hydroxyethyl)-1,5-dinitro-3-azabicyclonon-6-ene hydrochloride. Pharm Chem J. -2004. -V. 38. -P. 311-313.


