Изучение ассоциации однонуклеотидных полиморфных замен в генах ферментов антиоксидантной системы с риском развития рака предстательной железы в Сибирском регионе России
Автор: Оськина Н.А., Ермоленко Н.А., Боярских У.А., Лазарев А.Ф., Петрова В.Д., Ганов Д.И., Кунин И.С., Тоначева О.Г., Лифшиц Г.И., Филипенко М.Л.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (57), 2013 года.
Бесплатный доступ
Изучено влияние ряда полиморфных замен в генах антиоксидантной системы (SNPsrs1050450 гена GPX1, rs1695 и rs1138272 гена GSTP1 и rs4880 гена MnSOD) на риск развития рака предстательной железы у мужчин, проживающих в Сибирском регионе России. Проведен анализ взаимосвязи исследуемых генотипов с клиническими параметрами (стадией заболевания и уровнем ПСА). С этой целью сравнили частоту встречаемости исследуемых аллельных вариантов у 392 пациентов с раком простаты и у 344 мужчин без онкологических заболеваний в анамнезе. Генотипирование выполнялось при помощи ПЦР в режиме реального времени. Ни для одного из исследуемых SNPs не было получено статистически значимой ассоциации с риском развития рака предстательной железы (p>0,05). Для SNPrs1695 гена GSTP1 получена корреляция со стадией заболевания: генотип GG статистически значимо чаще встречается у больных раком простаты III–IV стадий (OR[C.I.]=2,66 [1,15–6,18], p=0,02). Оба исследуемых SNPs гена GSTP1 ассоциированы с уровнем простат-специфического антигена (ПСА) в крови: генотип GG rs1695 и генотип TT rs1138272 ассоциированы с более высокими показателями ПСА (p=1,5×10 -3).
Рак предстательной железы, одиночные полиморфизмы нуклеотидов (snps)
Короткий адрес: https://sciup.org/14056330
IDR: 14056330 | УДК: 616.65-006.6-036:577.21(571.1/.5)
Текст научной статьи Изучение ассоциации однонуклеотидных полиморфных замен в генах ферментов антиоксидантной системы с риском развития рака предстательной железы в Сибирском регионе России
В последнее время наблюдается общемировая тенденция увеличения заболеваемости мужского населения раком предстательной железы (РПЖ). К доказанным факторам риска относят возраст, этническую принадлежность и генетические факторы. Считается, что порядка 30 % всех опухолей человека индуцировано воспалением [5]. Что касается РПЖ, то хронический простатит относят к вероятным факторам риска, поскольку его роль в малигнизации подтверждена не всеми исследованиями. Одним из ведущих механизмов, обусловливающих малигнизацию при воспалении, является окислительное повреждение. Имеется множество работ, указывающих на роль в канцерогенезе повреждений ДНК, вызванных активными формами кислорода (АФК) [8, 11]. Увеличение АФК может быть результатом или повышения их образования и/или снижения антиоксидантных механизмов защиты. Полиморфные варианты в генах ферментов антиоксидантной защиты могут быть ассоциированы с риском развития онкопатологии [13, 16, 20].
MnSOD (марганец-супероксиддисмутаза) является митохондриальным ферментом. Поскольку митохондрии являются основным источником АФК, вероятно, MnSOD играет ключевую роль в защите клетки от окислительного повреждения. SNP rs4880 гена MnSOD приводит к замене аминокислоты валин (Val) на аланин (Ala) [24], что изменяет вторичную структуру белка, затрудняет транспорт фермента в митохондрии и формирование активного тетрамера MnSOD в митохондриальном матриксе [25]. Для злокачественно трансформированных клеток предстательной железы характерно снижение экспрессии гена MnSOD [6]. В опубликованном в 2009 г. метаанализе подтверждена ассоциация SNP rs4880 гена MnSOD с риском развития РПЖ (OR=1,3; 95 % CI: 1,0–1,6) [26].
GPX1 является селен-зависимым ферментом детоксикации активных форм кислорода [15]. Замена нуклеотидов rs1050450 приводит к замене аминокислоты пролина на лейцин. Ранее опубликованные работы об ассоциации данного SNP с риском развития РПЖ весьма противоречивы: имеются данные о корреляции Pro/Leu или Leu/Leu генотипа с риском развития и с высокой стадией РПЖ [17], в ряде работ получен протективный эффект [13] или отсутствие ассоциации [7].
Ген GSTP1 кодирует глутатион-S-трансферазу Р1, рассматриваемые нами полиморфные замены ведут к замене аминокислот в составе белка. В злокачественно трансформированных клетках простаты были выявлены соматические мутации в гене GSTP1, приводящие к его инактивации [22], а также гиперметилирование регуляторных последовательностей гена GSTP1, не обнаруживаемое в нормальной ткани предстательной железы или при доброкачественной гиперплазии [18, 19]. Таким образом, более чем в 90 % аденокарцином GSTP1 не экспрессируется [18].
Цель исследования – изучить влияние ряда полиморфных замен в генах ферментов антиоксидантной системы (rs1050450 GPX1, rs1695 и rs1138272 GSTP и rs4880 MnSOD) на риск развития рака предстательной железы у мужчин, проживающих в Сибирском регионе России.
Материал и методы
В исследование включено 736 мужчин, принадлежащих русской этнической группе, проживающих на территории Алтайского и Красноярского краев РФ. Образцы венозной крови для выделения ДНК были предоставлены сотрудниками Алтайского филиала Российского онкологического научного центра им. Н.Н. Блохина РАМН и Красноярского краевого онкологического диспансера им. А.И. Кры-жановского. ДНК выделяли из венозной крови с использованием стандартной процедуры, включающей выделение и лизис клеток крови, гидролиз белков протеиназой К, очистку ДНК экстракцией примесей фенол-хлороформом и осаждение ДНК этанолом [3]. Для проведения исследования было сформировано две группы мужчин: основная (n=392) и контрольная (n=344). В основную группу вошли мужчины с гистологически верифицированным РПЖ, отягощенный семейный анамнез отмечен лишь у 6 (1,5 %) больных. Критерии отбора в контрольную группу: мужской пол; возраст старше 40 лет; отсутствие доброкачественных и злокачественных образований в предстательной железе, а также любых онкологических заболеваний в анамнезе. Средний возраст в основной выборке составил 69,2 ± 8,4 года, в контрольной – 64,3 ± 14,7 года. Распределение больных РПЖ с учетом основных клинических параметров представлено в табл. 1.
Определение генотипов исследуемых аллельных вариантов выполнялось при помощи ПЦР с использованием TaqMan зондов комплементарных полиморфной последовательности ДНК. Структуры олигонуклеотидных праймеров и зондов, а также условия амплификации опубликованы ранее [1, 2].
Соответствие частот генотипов исследуемых SNPs равновесию Харди–Вайнберга определяли отдельно для контрольной группы и группы пациентов с РПЖ при помощи точного критерия Фишера [28]. Для определения вклада исследуемого SNP в изменение риска развития рака предстательной железы рассчитывали отношение шансов (OR) и его доверительный интервал (C.I. 95 %). Сравнение частот встречаемости аллелей и генотипов проводили с использованием логистической регрессии, статистически значимыми считались различия при р<0,05. Вычисления производились с помощью программы R 2.13.2 (библиотека GenABEL). Поскольку сравниваемые группы статистически значимо различались по возрасту (p<0,05), OR и 95 % C.I. рассчитывали с поправкой на возраст.
Результаты и обсуждение
В результате настоящего исследования были определены частоты встречаемости аллелей и генотипов исследуемых полиморфных локусов в контрольной группе и группе пациентов с РПЖ. В обеих группах частоты генотипов соответствовали распределению Харди–Вайнберга. При этом не было выявлено статистически значимой ассоциации исследуемых полиморфных замен с риском развития РПЖ. Результаты сравнения частот встречаемости аллелей и генотипов исследуемых SNPs в анализируемых группах представлены в табл. 2. Однако была обнаружена корреляция двух исследуемых SNPs с клиническими параметрами. Для
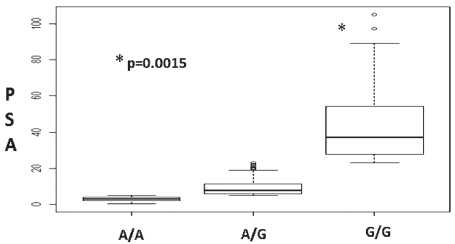
Рис. 1. Зависимость уровня ПСА от генотипа rs1695 гена GSTP1
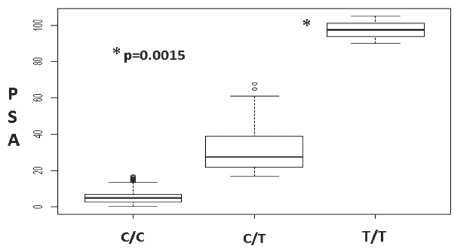
Рис. 2. Зависимость уровня ПСА от генотипа rs1138272 гена GSTP1
SNP rs1695 гена GSTP1 получена ассоциация со стадией заболевания: генотип GG ассоциирован с распространенными формами заболевания – РПЖ III–IV стадий (OR (C.I.)=2,66 (1,15–6,18), p=0,02). Для обоих исследуемых SNPs гена GSTP1 получена ассоциация с уровнем простат-специфического антигена (ПСА) в крови: генотип GG rs1695 и генотип TT rs1138272 ассоциированы с более высокими показателями ПСА (рис. 1, 2).
Таблица 1
распределение больных рПж по уровню ПСа и стадии заболевания
|
Стадия заболевания |
Число больных |
Средний возраст, лет |
|
I |
18 (6,7 %) |
69,8 ± 8,48 |
|
II |
144 (52,7 %) |
|
|
III |
94 (34,4 %) |
69,7 ± 8,57 |
|
IV |
17 (6,2 %) |
|
|
Уровень ПСА на момент установки диагноза, нг/мл %* |
||
|
≤4 |
135 (35,3 %) |
69,2 ± 8,43 |
|
5–10 |
141 (36,8 %) |
69,2 ± 8,47 |
|
11–20 |
45 (11,7 %) |
69,1 ± 8,49 |
|
>20 |
62 (16,2 %) |
69,1 ± 8,58 |
На сегодняшний день недостаточно знаний о специфическом воспалительном ответе в ткани предстательной железы. Эпидемиологические исследования роли воспаления в развитии РПЖ затруднены в связи с отсутствием реальных данных о распространенности хронического простатита среди мужского населения ввиду часто бессимптомного течения заболевания. Кроме того, мужчины с симптомами простатита чаще обращаются к урологу, следовательно, они чаще подвергаются урологиче- скому обследованию, а значит, у них чаще диагностируется РПЖ. Это может приводить к смещению результатов эпидемиологического исследования, а именно, ложной корреляции хронического воспаления с развитием РПЖ. Экспериментальные данные, подтверждающие вклад воспалительных цитокинов в канцерогенез в предстательной железе, получены преимущественно на клеточных линиях и не могут напрямую экстраполироваться на процессы, протекающие в человеческом организме. Если анализ ассоциации SNpsrs1050450 гена Gpx1, rs1695 и rs1138272 генаGSTp1 и rs4880 гена MnSO с риском развития рПж
Таблица 2
|
dbSNP_rs1 |
Контроль (n) |
РПЖ (n) |
OR (95 % CI) |
p |
Х-В p(exact)2 контрольная группа |
Х-В p(exact)2 больные РПЖ |
|
|
rs1138272 GSTP1 Call Rate3 97 % |
Генотип |
0,24 |
1,0 |
||||
|
CC |
277 |
305 |
Референтный генотип |
||||
|
CT |
60 |
66 |
1,03 (0,69–1,54) |
0,87 |
|||
|
TT |
6 |
3 |
0,47 (0,11–1,94) |
0,29 |
|||
|
Аллель |
|||||||
|
C |
614 (89,5 %) |
676 (90,4 %) |
Референтный аллель |
||||
|
T |
72 (10,5 %) |
72 (9,6 %) |
0,94 (0,66–1,33) |
0,72 |
|||
|
rs1695 GSTP1 Call Rate3 95 % |
Генотип |
1,0 |
0,49 |
||||
|
AA |
151 |
158 |
Референтный генотип |
||||
|
AG |
149 |
157 |
0,94 (0,68–1,31) |
0,73 |
|||
|
GG |
36 |
46 |
1,24 (0,80–2,06) |
0,41 |
|||
|
Аллель |
|||||||
|
A |
451 (67,1 %) |
473 (65,5 %) |
Референтный аллель |
||||
|
G |
221 (32,9 %) |
249 (34,5 %) |
1,05 (0,84–1,33) |
0,64 |
|||
|
rs1050450 GPX1 Call Rate3 93 % |
Генотип |
0,13 |
0,7 |
||||
|
CC |
153 |
183 |
Референтный генотип |
||||
|
CT |
132 |
146 |
0,94 (0,68–1,31) |
0,73 |
|||
|
TT |
41 |
32 |
0,68 (0,40–1,16) |
0,16 |
|||
|
Аллель |
|||||||
|
C |
438 (67,2 %) |
512 (70,9 %) |
Референтный аллель |
||||
|
T |
214 (32,8 %) |
210 (29,1 %) |
0,87 (0,69–1,09) |
0,22 |
|||
|
rs4880 MnSOD Call Rate3 97 % |
Генотип |
0,08 |
0,76 |
||||
|
CC |
99 |
94 |
Референтный генотип |
||||
|
CT |
152 |
194 |
1,43 (0,97–2,07) |
0,05 |
|||
|
TT |
86 |
92 |
1,17 (0,77–1,78) |
0,47 |
|||
|
Аллель |
|||||||
|
C |
350 (51,9 %) |
382 (50,3 %) |
Референтный аллель |
||||
|
T |
324 (48,1 %) |
378 (49,7 %) |
1,09 (0,88–1,34) |
0,45 |
|||
Примечание: 1 – идентификационный номер SNP в международной базе данных NCBI dbSNP http://www,ncbi,nlm,nih,gov/snp/; 2– Х-В p(exact) – уровень статистической значимости отклонения частот генотипов от равновесия Харди–Вайнберга; 3 – CallRate – эффективность амплификации. СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 3 (57)
воспаление способствует развитию рака простаты, то полиморфные варианты в генах, ответственных за воспалительный ответ, могут вносить вклад в наследственную предрасположенность к развитию данной патологии.
АФК являются продуктами нормального клеточного метаболизма и играют важную роль в стимуляции различных сигнальных путей при изменениях внутри- и внеклеточных условий среды. Однако хроническое повышение уровня АФК в течение длительного времени приводит к повреждению ДНК, а также к перекисному окислению липидов, модификации белков, повреждению мембран и митохондрий [9, 29]. Роль окислительного стресса в развитии РПЖ согласуется со свободнорадикальной теорией старения, поскольку возраст является доказанным фактором риска развития данной патологии. Снижение с возрастом внутриклеточной антиоксидантной защиты может являться одним из факторов преимущественного развития РПЖ у мужчин старше 55 лет. Положительная корреляция между потреблением большого количества животных жиров и риском развития РПЖ [10, 23] также может быть обусловлена окислительным стрессом и повышенным перекисным окислением липидов [12]. АФК вызывают окислительное повреждение ДНК, приводя к мутациям и изменению функции генов, а также могут индуцировать экспрессию множества транскрипционных факторов, участвующих в неопластической трансформации клеток [27]. Антиоксидантная система является важным компонентом противоопухолевой защиты, и, следовательно, полиморфные варианты в генах антиоксидантной системы могут определять индивидуальную восприимчивость к развитию РПЖ.
Важной, не типичной для злокачественных новообразований, особенностью РПЖ является значительное преобладание субклинических и локализованных форм заболевания, зачастую не прогрессирующих и не требующих медицинского вмешательства. У половины мужчин в возрасте 50 лет уже можно обнаружить в простате микроскопические очаги злокачественной трансформации. Критической проблемой онкоурологии на сегодняшний день является сложность выделения той небольшой группы мужчин, у которых присутствие островков малигнизации в ткани предстательной железы является угрозой для здоровья и которые нуждаются в соответствующих лечебных мероприятиях. Несо- мненно, что разработка предикторов агрессивного течения РПЖ является актуальной задачей.
АФК способны изменять конформационную структуру белка p53, ингибируя тем самым его связывание с ДНК [14]. Дисфункция белка p53 связана с прогрессией множества опухолей, в том числе и РПЖ [21]. Было показано, что прогрессирование рака простаты связано с высоким уровнем окислительного стресса и повышенным перекисным окислением липидов, не наблюдаемым при локализованных формах РПЖ [30]. Таким образом, длительное хроническое воспаление и/или недостаточность антиоксидантной системы могут обусловливать прогрессирование заболевания.
В выполненном нами ассоциативном исследовании не получено статистически значимой ассоциации исследуемых SNPs в генах антиоксидантной системы с риском развития РПЖ, однако выявлена корреляция со стадией заболевания: генотип GGrs1695 гена GSTP1 ассоциирован с распространенными формами РПЖ (III–IV стадии). Общепризнанным опухолевым маркером в диагностике РПЖ является простатический специфический антиген (ПСА), который используется в качестве скринингового теста [4]. Следует подчеркнуть, что ПСА не является специфичным маркером опухолевого процесса, а его уровень скорее отражает общий объем ткани предстательной железы. Не существует значения ПСА, при котором можно со 100 % вероятностью утверждать, что у пациента есть или, напротив, отсутствует рак простаты. Если обратиться к нашей выборке, то у 35 % больных РПЖ на момент постановки диагноза уровень ПСА был ниже дискриминационного значения – 4 нг/мл (табл. 1). В нашем исследовании для обоих исследуемых SNPs гена GSTP1 была получена ассоциация с уровнем ПСА в крови: генотип GG rs1695 и генотип TT rs1138272 оказались ассоциированы с более высокими показателями ПСА (p=1,5×10-3) (рис. 1, 2). Это еще раз подтверждает неспецифичность ПСА как опухолевого маркера, поскольку его уровень, кроме воспалительных и доброкачественных гиперпластических процессов в ткани железы, возможно, генетически детерминирован. Кроме того, полученный результат может быть обусловлен более выраженным воспалительным процессом в ткани железы ввиду недостаточности антиоксидантной системы у носителей минорных аллелей исследуемых SNPs.
Заключение
Ни для одного из исследуемых SNPs в нашей работе не было получено статистически значимой ассоциации с риском развития рака предстательной железы (p>0,05). Для SNP rs1695 гена GSTP1 получена корреляция со стадией заболевания: генотип GG статистически значимо чаще встречается у пациентов с раком простаты III–IV стадий (OR (C.I.)=2,66 (1,15–6,18), p=0,02). Для обоих исследуемых SNPs гена GSTP1 получена ассоциация с уровнем простат-специфического антигена (ПСА) в крови: генотип GG rs1695 и генотип TT rs1138272 ассоциированы с более высокими показателями ПСА (p=1,5×10-3). Важно отметить, что при заявленном объеме выборки нашего исследования с 80%-ным уровнем статистической мощности можно детектировать значения OR не ниже 1.48 для rs1138272 гена GSTP1; 1.32 для rs1695 гена GSTP1; 1.32 для rs1050450 гена GPX1 и 1.3 для rs4880 гена MnSOD. Другими словами, на примере rs1138272 гена GSTP1, если предположить, что данный SNP изменяет риск РПЖ в 1,48 раза или менее, то с вероятностью более 20 % мы не обнаруживаем статистически значимой ассоциации на нашей выборке. Следовательно, если влияние исследуемых в данной работе SNPs на риск РПЖ все же есть, но оно меньше указанных выше значений OR, то детектировать его можно только при исследовании выборок большего размера.


