Изучение биологических свойств антибиотикорезистентных бактерий Staphylococcus epidermidis 33 и их чувствительности к варнерину
Автор: Коробов В.П., Полюдова Т.В., Лемкина Л.М.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2015 года.
Бесплатный доступ
Выявлена динамика формирования резистентности бактерий Staphylococcus epidermidis ГИСК 33 к бактерицидным антибиотикам ципрофлоксацину и ванкомицину. Установлены изменения липидного состава клеточных мембран резистентных к этим антибиотикам бактерий, а также значительное увеличение на поверхности бактерий ванкомицинрезистентного штамма стафилококков положительно заряженных группировок. Показаны антибактериальные эффекты низкомолекулярного катионного пептида варнерина и их синергизм с лизоци-мом при действии на клетки штамма S.epidermidis 33 и его антибиотикорезистентных вариантов.
Антибиотикорезистентность, катионные пептиды, варнерин
Короткий адрес: https://sciup.org/147204708
IDR: 147204708 | УДК: 579.234
Текст научной статьи Изучение биологических свойств антибиотикорезистентных бактерий Staphylococcus epidermidis 33 и их чувствительности к варнерину
Выделение А. Флемингом в 1940 г. пенициллина явилось началом новой эры развития медицины, эффективно использующей для лечения инфекционных заболеваний большую группу низкомолекулярных соединений с различными механизмами действия и спектром антибактериальной и противогрибковой активности. Практически одновременно возникли и проблемы формирования резистентности к ним микроорганизмов, обусловленные развитием разнообразных механизмов устойчивости бактерий к данной группе терапевтических препаратов. Интенсивные исследования природы этого явления позволили детально охарактеризовать различные генетические и молекулярные механизмы антибиотикорезистентности, которая
может быть детерминирована плазмидами, хромосомными генами и сочетанием этих генетических элементов [Moreillon, 1995].
Широкое внедрение антибиотиков в ветеринарную и медицинскую практику привело к тому, что резистентность к антибактериальным препаратам формируется практически у всех патогенных и условно патогенных бактерий, в том числе у бактерий рода Staphylococcus [Hidron et al . , 2008]. Применение антибиотиков как в условиях стационаров, так и при амбулаторном лечении постоянно формирует новые штаммы стафилококков, отличающиеся повышенной устойчивостью к используемым и вводимым в практику новым антибактериальным химиопрепаратам. Особую опасность представляют стафилококки, обладающие резистентностью к нескольким антибиотикам, так как обусловленные ими заболевания требуют использования новых, часто более токсичных, антибиотических препаратов [Сидоренко, 2003].
В связи с представленным является чрезвычайно актуальной проблема поиска новых эффективных как синтетических, так и природных противо-микробных агентов, функционирующих в живых системах. В частности, особое внимание привлекают низкомолекулярные катионные пептиды [Hancock, Lehrer, 1998], которые являются важнейшим компонентом природной защиты всех живых организмов. Они обладают антибактериальными, противогрибковыми, а также иммунорегулирующими свойствами [Коробов, 2011]. Кроме того, антибиотические пептиды способны усиливать действие традиционно используемых антибиотиков [Choi, Lee, 2012].
Цель данной работы - изучение антибактериального действия низкомолекулярного поликати-онного пептида варнерина, синтезируемого бактериями Staphylococcus warneri IEGM KL - 1 [Коробов и др., 2010] в отношении антибиотикорезистентных штаммов Staphylococcus epidermidis .
Материалы и методы
В качестве объекта исследования использовали штамм Staphylococcus epidermidis 33 ГИСК, полученный из Государственной коллекции патогенных микроорганизмов Государственного научно-исследовательского института стандартизации и контроля медицинских и биологических препаратов (г. Москва). Селекционным путем были получены антибиотикоустойчивые варианты штамма S. epidermidis 33: S. epidermidis 33-Vanc r - штамм, устойчивый к ванкомицину и S. epidermidis 33-Cf r - штамм, устойчивый к ципрофлоксацину. Антибиотикоустойчивые штаммы S. epidermidis получали путем многократных пересевов клеток штамма S. epidermidis 33 в жидкой среде LB с возрастающими концентрациями соответствующего антибиотика.
Культивирование бактерий проводили на модифицированной жидкой и агаризованной богатой питательной среде Luria-Bertani (LB), содержащей (г/л): триптон ("Oxoid"), - 10.0 дрожжевой экстракт ("Oxoid") - 5.0, KCl - 6.4. Для получения агаризо-ванной среды к жидкой среде добавляли агар ной среды к жидкой среде добавляли агар ("Difco") до конечной концентрации 1.4%.
При определении антибиотикочувствительности бактерий методом диффузии с диска использовали специальную агаризованную среду Antibiotic Medium 2 ("Difco"), которую готовили, согласно рекомендациям фирмы-изготовителя, из расчета 25.5 г/л.
Бактерии всех использованных в работе штаммов стафилококков выращивали в колбах на 100 мл с объемом среды 20 мл при 37 ° C на ротационном шейкере "Certomat®IS" ("Sartorius AG", Германия) при перемешивании 150 об/мин.
Для определения чувствительности клеток к антибиотикам использовали дискодиффузионный метод. Интерпретацию результатов осуществляли в соответствии с принятыми рекомендациями [Методические …, 2004].
Для определения минимальной подавляющей концентрации (МПК) варнерина использовали метод двукратных разведений в иммунологических планшетах ("Медполимер", Санкт-Петербург). В лунки планшета вносили по 100 мкл среды LB. В первую лунку ряда вносили 100 мкл раствора варнерина. Путем последовательного переноса 100 мкл содержимого первой лунки в последующие готовили серию двукратных разведений. Затем в каждую лунку вносили 10 мкл тест-культуры S. epidermidis 33 . В качестве инокулята использовали клетки логарифмической фазы роста, суспендированные в свежей среде до количества 2 х 106 КОЕ/мл. Результаты оценивали через 16-18 ч. культивирования при 37 ° С. За единицу активности (ЕА) варнерина принимали обратную величину максимального разведения, при которой наблюдалось полное подавление роста тест-бактерий. В качестве МПК обозначали самую низкую концентрацию пептида, которая вызывала видимую задержку роста микроорганизмов.
В опытах с периодическим культивированием на среде LB интенсивность роста бактериальных культур оценивали по изменению оптической плотности (ОП) при длине волны 600 нм на спектрофотометре PD 303 "Apel" (Япония) в кюветах с длиной оптического пути 1 см.
Антибактериальный пептид варнерин выделяли из среды культивирования бактерий Staphylococcus warneri IEGM KL-1 [Коробов и др., 2010].
Для изучения кинетики бактерицидного действия варнерина использовали клетки логарифмической фазы роста, которые осаждали центрифугированием при 13000 об/мин в течение 5 мин., отмывали и суспендировали в 10 мМ буфере Трис-HCl (pH 7.2) до конечной плотности бактериальной культуры ОП600=0.6. К полученным суспензиям добавляли раствор варнерина (v/v, 1:1) с активностью 2048 ЕА/мл, инкубировали на шейкере "Certomat®IS", отбирая через определенные интервалы времени по 100 мкл бактериальной суспензии для определения количества колониеобразующих единиц (КОЕ). Количество жизнеспособных клеток определяли посевом десятичных разведений аликвот культур на чашки Петри, содержащих агаризованную среду LB. Чашки инкубировали в термостате в течение 1-2 сут. при 37°С, а затем производили подсчет количества выросших колоний.
Выделение плазмидной ДНК проводили модифицированным методом щелочного лизиса [Birnboim, Doly, 1979]. Клетки ночной культуры осаждали центрифугированием при 12000 об/мин в течение 15 мин., после чего отмывали раствором, содержащим 10 мМ NaCl (pH 8.0). Осадок ресуспендировали в 200 мкл раствора, содержащего 25 мМ ЭДТА, 30% сахарозы, 300 мкг/мл лизостафина ("Sigma"), pH 8.0. После инкубации в течение 60 мин. при 37 ° С для окончательного лизиса клеток и гидролиза хромосомной ДНК добавляли 200 мкл 0.2 М NaOH, затем 200 мкл 1% SDS, выдерживали при комнатной температуре в течение 30 мин. Осаждение клеточного дебриса и фрагментов бактериальной хромосомы проводили внесением 200 мкл 3 М CH 3 COONa pH 4.8. Пробы помещали на лед на 60 мин. до образования творожистого осадка, который отделяли центрифугированием в течение 15 мин. (12000g) при 4 ° С. Супернатант смешивали с изопропанолом в соотношении 3:2 (v/v) и выдерживали в течение 20 мин. при комнатной температуре. После центрифугирования (12000g, 10 мин. при 4 ° С) осадок высушивали и растворяли в 200 мкл ТЕ-буфера (50 мМ ЭДТА, 50 мМ Трис, pH 8.0). Для получения более чистого препарата выделенную плазмидную ДНК переосаждали раствором 10 М LiCl, pH 8.0 в течение 15 мин. Полученный творожистый осадок отделяли центрифугированием при комнатной температуре при 12000g 15 мин. К супернатанту добавляли равный объем 70%-ного этанола и выдерживали 20 мин. при комнатной температуре. Плазмидную ДНК осаждали 15 мин. при 12000g, а затем растворяли в ТЕ буфере.
Выделенную плазмидную ДНК исследовали методом горизонтального электрофореза в 0.9%-ном агарозном геле [Маниатис, Фрич, Сэмбрук, 1984]. Электрофорез проводили в ТВЕ-буфере (89 мМ Трис, 89 мМ борная к-та, 2 мМ ЭДТА, pH 8.0) при напряжении 80 В/см в течение 4–5 час. при комнатной температуре. В качестве метчика использовали 1 Kb ДНК маркер ("СибЭнзим"). После завершения электрофореза гель окрашивали водным раствором бромистого этидия (5 мкг/мл), просматривали в проходящем ультрафиолетовом свете и фотографировали с помощью прибора "Bio Doc Analyze" ("Biometra").
Экстракцию липидов из клеток проводили по методу Блайя и Дайера (Bligh, Dyer, 1959). Полученные экстракты упаривали, перерастворяли в смеси хлороформ - метанол (50:50, об/об). Разделение липидных компонентов проводили высокоэффективной тонкослойной хроматографией на пластинах "Sorbfil" ("Сорбполимер", Россия), с размером зерен сорбента 8 - 12 мкм.
Для обнаружения всех липидов пластины после хроматографии опрыскивали раствором 3%-ного ацетата меди в 8%-ной фосфорной кислоте и прогревали при 180 ° С в течение 30 мин.; фосфолипиды проявляли с помощью реактива Цинцаде; липиды, содержащие остатки аминокислот, – нингидриновым реактивом [Кейтс, 1975].
Количественное определение фосфолипидов осуществляли путем сканирования пластин и расчета площадей отдельных пятен с помощью компьютерной программы "ДенситоАнализ".
Для изучения поверхностного заряда бактериальные клетки логарифмической фазы роста осаждали центрифугированием при 13000 об/мин в течение 5 мин., после чего отмывали 10 мM фосфатным буфером с pH 7.2. Готовили растворы цитохрома С ("Sigma" США) в 10 мМ буферных растворах с различными значениями pH (4.6; 5.6; 6.6; 7.2), с конечной концентрацией цитохрома С 0.5 мкг/мл. Полученные растворы добавляли к равным осадкам клеток (по количеству КОЕ/мл). Инкубировали 15 мин. при комнатной температуре. По истечении указанного времени клетки осаждали центрифугированием и спектрофотометрировали надосадочную жидкость (PD 303 "Apel"), при длине волны 530 нм в кюветах с длиной оптического пути 1 см.
Повторность всех экспериментов 3 - 7-кратная. Статистическую обработку экспериментальных данных проводили с помощью компьютерных программ Exel 2000 (Microsoft Inc., 1999), рассчитывая среднее арифметическое, доверительные интервалы, стандартное отклонение. Статистическую значимость результатов определяли при помощи t- критерия Стьюдента.
Результаты и их обсуждение
Для решения поставленных в работе задач использовали традиционные методы селекции. Из исходного штамма Staphylococcus epidermidis ГИСК 33 были получены его варианты, характеризующиеся устойчивостью к антибиотикам с различным механизмом действия: штамм, устойчивый к ванкомицину – ингибитору синтеза пептидогликана клеточной стенки и штамм, устойчивый к ципрофлоксацину - ингибитору синтеза ДНК. Динамика появления антибиоти-коустойчивости у cелекционированных штаммов представлена в табл. 1 и 2.
Формирование устойчивости штамма S. epider-midis 33 к ципрофлоксацину происходило в течение десяти пассажей. Как видно из табл. 1, уже с 4 - го пассажа культивирования с ципрофлоксацином бактерии становились значительно менее чувствительными к данному антибиотику. Полученный штамм S. epidermidis 33 - CI ' на 10 - м пассаже был устойчив к концентрации ципрофлоксацина в среде, равной 50 мкг/мл. По данным литературы [Walsh, 2000], резистентными являются бактерии, способные расти на среде с концентрацией ципрофлоксацина более 45 мкг/мл.
Следует отметить, что повышение устойчивости бактерий к ципрофлоксацину сопровождалось также увеличением чувствительности к цефалексину и рифампицину.
Резистентность клеток S. epidermidis 33 к ванкомицину формировалась более медленно: требовалось 18 пассажей культивирования в присутствии этого антибиотика. Полученный штамм S. epidermidis 33-Vanсr обладал устойчивостью к концентрации ванкомицина в среде, равной 40 мкг/мл. Согласно рекомендациям National Committee for Clinical Laboratory Standards (NCCLS, США), штаммы стафилокок- ков, развивающиеся на среде, содержащей ванкомицин в концентрации более 32 мкг/мл, должны рассматриваться как резистентные к этому антибиотику [Srinivasan, Dick, Perl, 2002]. Помимо устойчивости к ванкомицину, бактерии полученного штамма становились более чувствительными к другим антибиоти- кам - линкомицину и рифампицину. Но с другой стороны, появление резистентности к ванкомицину сопровождалось также увеличением устойчивости к таким антибиотикам как цефалексин и гентамицин (табл. 2).
Таблица 1
Изменение антибиотикочувствительности штамма S. epidermidis 33 при формировании резистентности к ципрофлоксацину (диаметр зоны подавления роста, мм)
Таблица 2
Изменение антибиотикочувствительности штамма S. epidermidis 33 при формировании резистентности к ванкомицину (диаметр зоны подавления роста, мм)
Полученные антибиотикорезистентные штаммы сохраняли признаки устойчивости при многократном (10 раз, срок наблюдения) пассировании на среде LB, не содержащей соответствующего антибиотика.
Согласно имеющимся данным, антибиотикорезистентные мутанты бактерий, как правило, обладают меньшей скоростью роста по сравнению с исходным антибиотико-чувствительным штаммом [Lipsitch, 2001]. Следует отметить, что и в наших экспериментах формирование резистентности к антибиотикам сопровождалось увеличением лаг-фазы и небольшим снижением скорости роста по сравнению с исходным штаммом. Как видно из рис. 1, в наибольшей степени появление антибио-тикорезистентности сказалось на характеристике роста на жидкой среде штамма, устойчивого к ванкомицину. Однако переход развития бактерий в стационарную фазу происходил при относительно одинаковом уровне плотности популяций.
Известно, что формирование резистентности бактерий к лекарственным препаратам обусловлено приобретением новой генетической информации или изменением уровня экспрессии собственных генов [Gill et al., 2005]. В связи с этим, были изучены плазмидные спектры S. epidermidis 33, S. epidermidis 33-Vancr и S. epidermidis 33-Cf r.
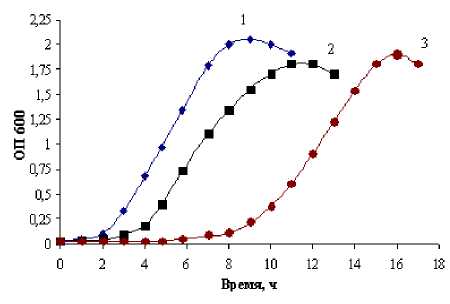
Рис. 1 . Кривые роста S. epidermidis- 33 (1), S. epidermidis 33-Cf r (2), S. epidermidis 33-Vancr (3)
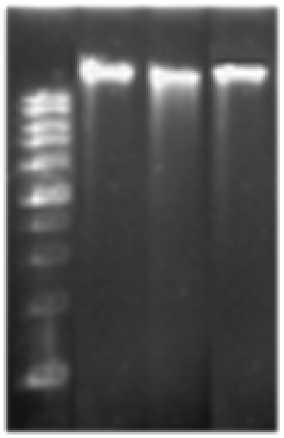
Сопоставлением плазмидных спектров исходного и антибиотикоустойчивых штаммов обнаружено, что детерминанты устойчивости, по-видимому, не связаны с появлением или наличием каких-либо плазмид, и, вероятно, могут быть локализованы на бактериальной хромосоме (рис. 2).
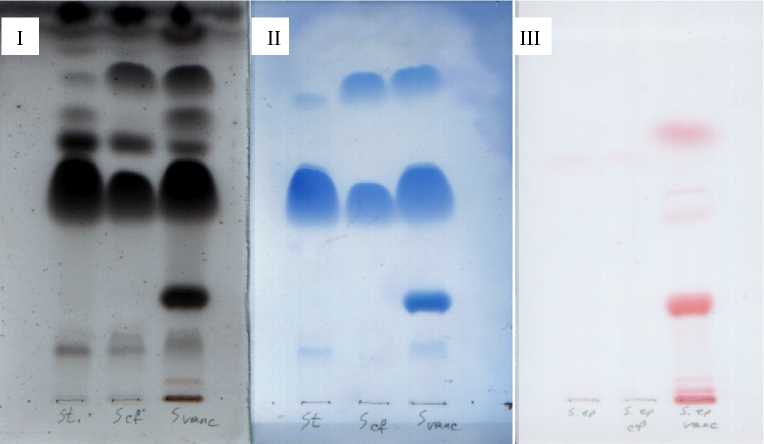
Анализ липидного состава мембран штаммов S. epidermidis 33, S. epidermidis 33-Cf r и S. epider-midis 33-Vancr (рис. 3) показал, что развитие резистентности к антибиотикам сопровождается увеличением в мембранах относительного количества кардиолипина, свободных жирных кислот и лизоформ фосфолипидов, по сравнению с исходным штаммом. В мембранах бактерий S. epidermidis
33-Vancr особенно выражено возрастание количества кардиолипина с 5 до 17% (рис. 4).
1 2 3 4
Рис. 2 . Плазмидный спектр бактерий изученных штаммов S. epidermidis :
1 - ДНК-маркеры; 2 - S. epidermidis -33; 3 -
S. epidermidis 33-Cf r; 4 - S. epidermidis 33-Vancr
S Scf Sv
S Scf Sv
S Scf Sv
Рис. 3 . Хроматографическая характеристика полярных липидов бактерий S. epidermidis -33 (S), S. epidermidis 33-Cf r (Scf) и S. epidermidis 33-Vancr (Sv):
I - все липиды, II - фосфолипиды, III - липиды, содержащие аминогруппу. 1 - кардиолипин, 2 - свободные жирные кислоты, 3 - диглюкозилдиглицерид, 4 - фосфатидилглицерол, 5 - лизилфосфатидилглицерол, 6 - 8 - лизоформы
Важно также отметить появление в них лизил-фосфатидилглицерола, отсутствующего в мембранах клеток как исходного, так и ципрофлоксацин-резистентного штаммов: доля этого липида составляет около 13%. Приобретение устойчивости к ципрофлоксацину сопровождается также пятикратным увеличением количества кардиолипина (с 5 до 25%). В это же время оба антибиотикорезистентных штамма отличались меньшим содержанием фосфатидилглицерола по сравнению с ис- ходным штаммом, а также снижением содержания гликолипидной фракции, представленной диглюкозилдиглицеридом.
Содержание фосфатидилглицерола в мембранах бакте штамма S. epidermidis 33-Vancr уменьшается с 64 до 48%, в случае штамма S. epider-midis 33-Cf r с 64 до 52%.
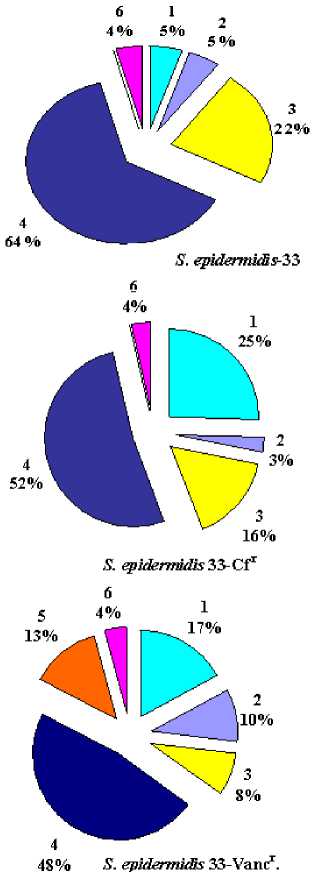
Рис. 4 . Липидный состав мембран клеток штаммов S. epidermidis -33,
S. epidermidis 33-Cf r и S. epidermidis 33-Vancr:
-
1 - кардиолипин, 2 - свободные жирные кислоты, 3 - диглюкозилдиглицерид, 4 -
- фосфатидилглицерол, 5 -
- лизилфосфатидилглицерол, 6 - лизоформы
Увеличение относительного содержания кардиолипина в клетках антибиотикорезисентных штаммов может рассматриваться как адаптационная реакция, направленная на предотвращение лизиса, так как известно, что кардиолипин играет важную роль в компенсации изменений жесткости клеточной стенки и накапливается в бактериаль- ных мембранах в условиях стрессовых воздействий [Kariyama, 1982].
Появление в мембранах клеток лизилфосфати-дилглицерола может лежать в основе повышения устойчивости штамма S. epidermidis 33 - Vanсr к катионным антибиотикам, поскольку известно, что накопление этого липида приводит к снижению проницаемости мембран для катионных соединений благодаря возрастанию сети положительных зарядов на мембране [Fischer, Leopold, 1999].
Для анализа поверхностного заряда бактериальных мембран клеток исходного и антибиотикоустойчивых штаммов S. epidermidis были проведены специальные эксперименты по изучению связывания молекул цитохрома С с бактериальными клетками. Как видно из рис. 5, приобретение устойчивости к ванкомицину с появлением в мембранах клеток лизилфосфатидилглицерола приводит к значительному снижению связывания положительно заряженных молекул цитохрома C с бактериальными клетками по сравнению с клетками исходного штамма.
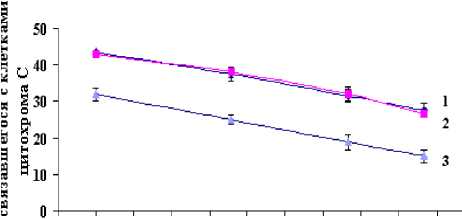
S' 43 4,6 4,9 53 5,5 5,8 6,1 64 6,7 7 73
Значения pH
Рис. 5 . Связывание цитохрома С с клетками
S. epidermidis 33 (1), S. epidermidis 33-Cf r
-
(2) и S. epidermidis 33-Vanсr (3), при различных значения pH среды инкубации
В то же время, приобретение устойчивости к ципрофлоксацину не влияло на поверхностный заряд бактерий S. epidermidis 33-Cf r.
Изучение антибактериального действия поли-катионного пептида варнерина показало, что он обладает выраженным антибиотическим эффектом как в отношении антибиотикочувствительного исходного штамма, так и в отношении исследуемых антибиотикоустойчивых штаммов S. epidermidis (табл. 3). Вместе с тем, следует отметить некоторое снижение чувствительности к бактерицидному действию варнерина штамма, устойчивого к ванкомицину, минимальная подавляющая концентрация пептида для которого составляла 8 мкг/мл.
Таблица 3
Минимальная подавляющая концентрация варнерина в отношении исследованных штаммов S. epidermidis 33
|
Штамм |
МПК варнерина (мкг/мл) |
|
33 |
0.5 |
|
33-Cfr |
0.5 |
|
33-Vancr |
8 |
Изучение кинетики антибактериальной активности пептида проводили путем инкубирования клеток исходного и антибиотикорезистентных штаммов в среде, содержащей одинаковые концентрации пептида с активностью 1024 ЕА/мл. При действии пептида на клетки исходного штамма, как и в случае устойчивого к ципрофлоксацину, бактерицидный эффект проявлялся сравнительно быстро. Так, уже через 10 мин. после внесения варнерина в среду инкубирования происходило снижение количества живых клеток - практически в 2 раза, а через 4 ч. культивирования живых клеток оставалось менее 1% (рис. 6).
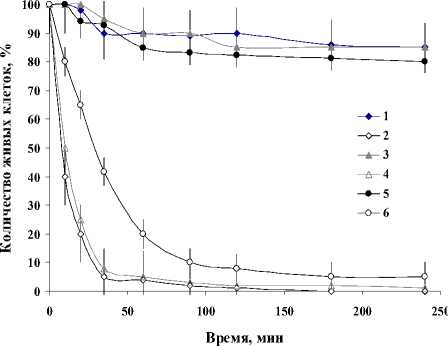
Рис. 6 . Кинетика бактерицидного действия варнерина на штаммы S. epidermidis 33, S. epidermidis 33-Cf r и S. epidermidis 33-Vanсr. Инкубация:
1 – S. epidermidis 33 без варнерина; 2 – S. epidermidis 33 в присутствии варнерина; 3 – S. epidermidis 33-Cf r без варнерина; 4 – S. epidermidis 33-Cf r в присутствии варнерина; 5 – S. epidermidis 33-Vanсr без варнерина; 6
– S. epidermidis 33-Vanсr в присутствии варнерина
Действие пептида на клетки S. epidermidis 33-Vanсr было более медленным, и через 4 ч. культивирования живых клеток оставалось около 6%.
Согласно данным литературы, некоторые по-ликатионные пептиды могут потенцировать действие друг друга, а также действие других компонентов внутренней защиты организма [Jeong et al., 2010]. Синергизм действия обнаружен также при комбинированном применении лизоцима и ланти-биотика низина [Mastromatteo et al., 2010]. Установлено, что эти антибактериальные агенты способны усиливать действие друг друга, что проявляется в более быстрой пермеабилизации и деполяризации клеточной мембраны чувствительных клеток. Поскольку лизоцим является одним из наиболее широко распространенных среди живых организмов низкомолекулярных белков внутренней защиты [Бухарин, Васильев, 1974], представляло интерес изучить взаимодействие варнерина с этим ферментом при совместной атаке бактериальных клеток.
Для этой цели были проведены эксперименты по изучению комбинированного действия варне-рина и лизоцима на бактерии штаммов S. epider-midis . Варнерин и лизоцим в различных соотношениях концентраций одновременно вносили в среду культивирования. Концентрации варнерина варьировали в диапазоне от 0,25 до 24 мкг/мл, лизоцима - от 0,5 до 200 мкг/мл. Наличие синергидного эффекта констатировалось в том случае, когда значение индекса фракционной подавляющей концентрации (ФПК) было ≤ 0,5. Значение индекса вычислялось по следующей формуле: ФПК индекс = ФПК В + ФПК Л ; ФПК В = [В]/МПК В , ФПК Л = [Л]/МПК Л , где: [В] - минимальная подавляющая концентрация варнерина в комбинации с лизоцимом, МПК В - минимальная подавляющая концентрация варнерина, [Л] - минимальная подавляющая концентрация лизоцима в комбинации с вар-нерином, МПК Л - минимальная подавляющая концентрация лизоцима [Amsterdam, 1996].
Результаты проведенных опытов показали, что варнерин и лизоцим при комбинированном применении обладают выраженным синергидным эффектом в отношении бактерий всех исследованных штаммов S. epidermidis . Значения индекса ФПК показаны в табл. 4.
Таблица 4
Синергизм действия варнерина в сочетании с лизоцимом в отношении бактерий исследованных штаммов S. epidermidis
|
Штамм |
33 |
33-Cf r |
33-Vanсr |
|
МПК В , мкг/мп |
0.5 |
0.5 |
8 |
|
[В], мкг/мп |
0.06 |
0.06 |
2 |
|
МПК Л , мкг/мп |
0.09 |
0.09 |
3 |
|
[Л], мкг/мп |
0.0225 |
0.0225 |
0.75 |
|
Индекс ФПК |
0.37 |
0.37 |
0.48 |
Представленные данные свидетельствуют о том, что антибактериальное действие варнерина и лизоцима на клетки штамма S. epidermidis 33 и штамм S. epidermidis 33-Cfr выражено практически одинаково. В меньшей степени синергизм действия варнерина и лизоцима проявлялся в отношении бактерий штамма, устойчивого к ванкомицину, что, очевидно, связано с его относительно большей, по сравнению с бактериями других штаммов, устойчивостью к действию этих факторов в отдельности. Однако, в данном случае, антибактериальный эффект варнерина проявлялся при значительно меньшей концентрации [В]=2мкг/мл.
Заключение
Изучение природных поликатионных пептидов приобретает все большее внимание исследователей. Это обусловлено тем, что на фоне постоянно возрастающего количества антибиотикорезистентных штаммов микроорганизмов эти соединения могут стать эффективной альтернативой традиционным антибиотикам. Помимо того, что поликати-онные пептиды способны выступать в роли само- стоятельных антибактериальных агентов, перспективным является также использование их в качестве факторов, повышающих чувствительность бактериальных клеток к другим антибиотикам [Vives, Schmidt, Pelegrin, 2008]. Представленные результаты экспериментальных исследований позволяют констатировать:
-
1. Приобретение устойчивости бактерий к фторхинолону ципрофлоксацину и гликопептидному антибиотику ванкомицину приводит к изменению чувствительности резистентных штаммов S. epidermidis 33 к некоторым другим антибиотикам. Детерминанты устойчивости к антибиотикам, по-видимому, имеют хромосомную локализацию.
-
2. Развитие резистентности бактерий S. epider-midis 33 к исследованным антибиотикам сопровождается увеличением в мембранах клеток относительного количества кардиолипина, свободных жирных кислот и лизоформ, но уменьшением содержания фосфатидилглицерола и гликолипидной фракции, представленной диглюкозилдиглицеридом. В мембранах бактерий S. epidermidis 33-Vancr обнаружено появление лизилфосфатидилглицеро-ла, отсутствующего в исходном и ципрофлокса-цинрезистентном штаммах, что может быть одним из факторов, способствующим повышению устойчивости штамма S. epidermidis 33 - Vanсr к варне-рину за счет обогащения мембранных структур группировками, несущими положительный заряд.
-
3. Низкомолекулярный поликатионный пептид варнерин, продуцируемый бактериями S. warneri IEGM KL - 1, обладает бактерицидным эффектом в отношении штаммов S. epidermidis , различающихся чувствительностью к антибиотикам: устойчивый к ципрофлоксацину штамм S. epidermidis 33-Cf r сохраняет чувствительность к варнерину, характерную для исходного штамма; ванкомицинрези-стентный штамм S. epidermidis 33-Vancr обладает чувствительностью к варнерину, но при более высокой МПК. Совместное использование варнерина с лизоцимом проявляет выраженный синергизм антибактериального действия в отношении штаммов S. epidermidis , с различным уровнем устойчивости к антибиотикам.
Работа выполнена при поддержке грантов: РФФИ № 14-04-00687, Программ фундаментальных исследований УрО РАН и Министерства образования и науки Пермского края – «Международные исследовательские группы», № С-26/632.
Список литературы Изучение биологических свойств антибиотикорезистентных бактерий Staphylococcus epidermidis 33 и их чувствительности к варнерину
- Бухарин О.Б., Васильев Н.В. Лизоцим и его роль в биологии и медицине. Томск: Изд-во Томск, ун-та, 1974. 208 с
- Кейтс М. Техника липидологии. М.: Мир, 1975. 322 с
- Коробов В.П. и др. Выделение и характеристика нового низкомолекулярного антибактериального пептида семейства лантибиотиков//Микробиология. 2010. T. 79. № 2. С. 228-238
- Коробов В.П. Лантибиотики -природные антибиотики широкого спектра действия//Вестник уральской медицинской академической науки. 2011. №4/1. С. 10-11
- Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование/пер. с англ. М.: Мир, 1984. 480 с
- Методические указания. Определение чувствительности микроорганизмов к антибактериальным препаратам/Федеральный центр госсанэпиднадзора Минздрава России. М., 2004. 91 с
- Сидоренко С.В. Перспективы в области создания препаратов для лечения инфекций, вызываемых грамположительными микроорганизмами//Антибиотики и химиотерапия. 2003. № 10. С. 3-4
- Amsterdam D. Susceptibility testing of antimicrobials in liquid media//Antibiotics in laboratory medicine/Ed. V. Lorian. Baltimor: Wil-liams&Wilkins, 1996. P. 52-111
- Birnboim H.C., Doly J. A rapid alkaline extraction procedure for screening recombinant plasmid DNA//Nucleic Acids Res. 1979. Vol. 7. P. 151153
- Bligh E.G., Dyer W.J. A rapid method of total lipid extraction and purification//Can. J. Biochem. Physiol. 1959. Vol. 37. P. 911-917
- Choi H, Lee D.G. Antimicrobial peptide pleurocidin synergizes with antibiotics through hydroxyl radical formation and membrane damage, and exerts antibiofilm activity//Biochim. Biophys. Acta. 2012. № 12. Р. 1831-1838
- Fischer W., Leopold K. Polar lipids of four Listeria species containing L-lysylcardiolipin, a novel lipid structure, and other unique phospholipids//Int. J. Syst. Bacteriol. 1999. Vol. 49. P. 653-662
- Gill S. et al. Insights on evolution of virulence and resistance from the complete genome analysis of an early methicillin-resistant Staphylococcus aureus strain and a biofilm-producing methicillin-resistant Staphylococcus epidermidis strain//Bacteriol. 2002. Vol. 187. P. 2426-2438
- Hancock R.E., Lehrer R. Cationic peptides: a new source of antibiotics//Trends Biotechnol. 1998. Vol. 16. P. 82-88
- Hidron A.I. et al. Annual update: antimicrobial-resistant pathogens associated with healthcare-associated infections: annual summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2006-2007//Infect. Control Hosp. Epidemiol. 2008. Vol. 29, № 11. P. 996-1011
- Jeong N. et al. Antibiotic and synergistic effect of Leu-Lys rich peptide against antibiotic resistant microorganisms isolated from patients with cholelithiasis//Biochem. Biophys. Research. 2010. Vol. 399. Р. 581-586
- Kariyama R. Increase of cardiolipin content in Staphylococcus aureus by the use of antibiotics affecting the cell wall//J. Antibiotics. 1982. Vol. 35. P. 1700-1704
- Lipsitch M. The rise and fall of antimicrobial resistance//Trends Microbiology. 2001. Vol.9. P. 438-444
- Mastromatteo M. et al. Synergic antimicrobial activity of lysozyme, nisin, and EDTA against Listeria monocytogenes in ostrich meat patties//J. Food. Sci. 2010. Vol. 75. P. 422-429
- Moreillon P. Bacterial resistance to antibiotics//Switzerland Med Wochenschr. 1995. Vol. 125, № 23. P. 1151-1161
- Srinivasan A., Dick J.D., Perl T.M. Vancomycin resistance in staphylococci//Clinical Microbiol. Rev. 2002. Vol. 15. P. 430-438
- Vives E., Schmidt J., Pelegrin A. Cell-penetrating and cell-targeting peptides in drug delivery//Biochim. Biophys. Acta. 2008. Vol. 1786. P. 126138
- Walsh K. Molecular mechanisms that confer antibacterial drug resistance//Nature. 2000. Vol. 406. P. 775-781


