Изучение биологической активности металлохелатов на лабораторных животных при постгеморрагической анемии
Автор: Логинов Г.П., Щитковская Т.Р., Гайсина Л.А., Павлова О.Н.
Статья в выпуске: 4 т.224, 2015 года.
Бесплатный доступ
Введение в рацион белых крыс с экспериментально моделированной у них постгеморрагической анемией хелатных комплексов железа, меди и кобальта с белковыми аминокислотами - с метионином и триптофаном способствует повышению в крови количества глутатиона, церулоплазмина, тиоловых соединений, лизоцимной активности и положительно влияет на нормализацию физиолого-биохимического статуса организма животных.
Хелатные комплексы биогенных металлов, белые крысы, постгеморрагическая анемия, каталаза, глутатион, церулоплазмин, тиоловые соединения, лизоцим
Короткий адрес: https://sciup.org/14288673
IDR: 14288673 | УДК: 619:616.155.194.569.324.4.001.5
Текст научной статьи Изучение биологической активности металлохелатов на лабораторных животных при постгеморрагической анемии
Обеспечение животных необходимыми макро- и микроэлементами в определенных количествах и соотношениях является одним из важнейших условий рационального кормления животных и птицы. Многочисленными исследованиями доказано, металлохелаты как при пероральном, так и парентеральном введении проявляют более эффективную биологическую активность и лучше усваиваются, чем соли микроэлементов в ионной форме [1,3,4,8] и др.
Хелатные соединения биогенных металлов с аминокислотами представляют особый интерес для использования в животноводстве, они менее токсичны по сравнению с неорганическими формами, обладают высокой биологической активностью, могут катализировать различные биохимические процессы и их можно использовать в качестве кормовой добавки в кормлении сельскохозяйственных животных и птицы.
Были синтезированы хелатные комплексы железа с метионином, меди и кобальта с триптофаном. Их хелатная структура была подтверждена установлением характеристических (или групповых) частот в области спектра 35001200 см–1. ИК-спектры показывают, что ионы металлов в этих комплексах координированы через амино- и карбоксильную группу.
Содержание железа в комплексе с метионином составляет 15,7%, меди в комплексе с триптофаном – 13,6%, кобальта в комплексе с триптофаном – 12,7%. Метионин и триптофан по отношению к ионам железа и меди ведут себя как бидентатный лиганд.
Метионин и триптофан относятся к числу незаменимых аминокислот. Метионин необходим для поддержания роста организма, обладает липотропным эффектом. Триптофан регулирует функцию эндокринного аппарата, предупреждающего анемию, регулирующего кровяное давление, отвечающего за синтез гемоглобина.
Целью нашей работы явилось сравнительное изучение влияния ферроглюкина-75 и хелатных комплексов на биохимические показатели крови белых крыс при постгеморрагической анемии.
Материалы и методы. Для изучения биологической активности металлокомплексов хелатной структуры были сформированы 3 группы белых крыс живой массой 100-130 г по 15 голов в каждой. Предварительно у всех животных двукратным кровопусканием из хвостовой вены вызывалась постгеморрагическая анемия. Крысы получали обильное питье, комбикорм, свеклу, морковь и хлеб. Животные первой группы служили контролем, второй группе – инъецировали подкожно двукратно ферроглюкин-75 с интервалом 10 дней в дозе по 0,5 мл. Третья группа с кормом ежедневно в течение двух недель получала хелатные комплексы железа с метионином, меди и кобальта с триптофаном, в суточной дозе которых содержалось 1,8 мг Fe, 0,26 мг Сu и 0,1 мг Со.
Кровь для анализа брали на 5, 10 и 25-е сутки опыта декапитацией от 5 голов животных каждой группы.
Определяли в крови каталазную активность (по Баху и Зубковой, 1937), в сыворотке крови – содержание глутатиона и его восстановленной формы (по методу Вудворда и Фрея в модификации М.С.Чулковой,1967), церулоплазмина (по Раввину), тиоловых соединений (по Фоломееву,1981) [6].
Результаты исследований . Как известно, в организме процессы перекисного окисления липидов сдерживаются антиоксидантными системами, включая и фермент каталазу, характерной функцией которой является разрушение токсической перекиси водорода, образующейся в ходе различных окислительных процессов в организме, на воду и кислород.
В результате кровопускания у крыс в крови происходит снижение каталазной активности. Введение подкормки животным комплексов металлохелатов способствует увеличению активности каталазы на 5-е сутки на 10,8% (Р<0,05), на 10-е – 16,2% (Р<0,05), на 25-е – 18,6% (Р <0,01), активность фермента также возрастала после введения ферроглюкина
(на 12,7-14,2%, Р<0,05).
Нами отмечалось положительное влияние хелатных комплексов на содержание глутатиона и его восстановленной формы (G-SH), играющей важную роль в детоксикационных механизмах (рис.1). Глутатион, как и эрготонеин, цистеин, гомоцистеин и липоевая кислота, относится к числу ответственных за неспецифическую резистентность соединений [2,7]. В гепатоцитах G-SH защищает структуру клетки от самых различных прооксидантов[ 10].
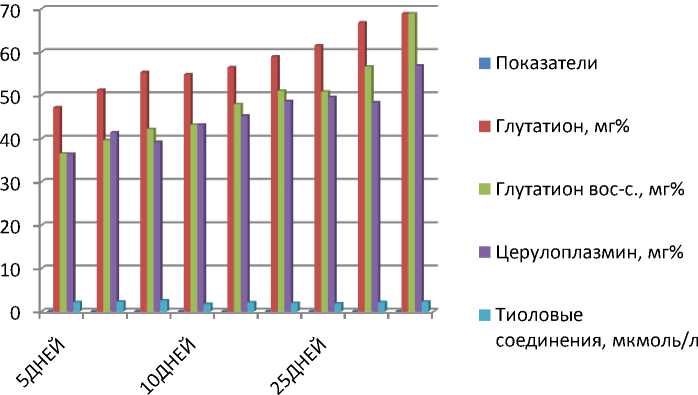
Рис. 1. Биохимические показатели крови белых крыс
Исследования показали, что в крови животных контрольной группы количество общего глутатиона на 5-е сутки составляло 47,2±2,6 мг%, на 10-е - 54,8±2,3 мг%, на 25е - 61,5±2,8 мг%, концентрация восстановленного глутатиона - 36,5±1,6, 43,2±1,6 и 50,8±1,7 мг%. Введение ферроглюкина сопровождалось увеличением содержания восстановленного глутатиона на 8,5-11,4%, под воздействием металлохелатов - на 12,4-18,1%.
Церулоплазмин, гликопротеид сыворотки крови, образующийся в печени, участвует в регуляции баланса меди в организме, является антиоксидантом, предотвращающим образование активных промежуточных форм О2; включается в обмен железа путем мобилизации его из железозапасающих органов, таких как печень и селезенка. Окисление Fe2+ до Fe3+ с помощью церулоплазмина в 10-20 раз продуктивнее неэнзиматических реакций, и поэтому церулоплазмин является как бы основным поставщиком Fe3+, которое затем соединяется с апотрансферрином и в форме трансферрина транспортируется в костный мозг, где происходит синтез гемоглобина, принимая, таким образом, участие в кроветворении[9].
В наших исследованиях отмечалось увеличение в сыворотке крови животных третьей группы концентрации церулоплазмина на 10-е сутки на 12,5% (Р<0,05) и 25-е- на 14,7% (Р<0,05) и составила 48,6±1,50 мг%, 56,8±1,62 мг% соответственно (контрольные показатели в эти сроки исследования равнялись 36,4 ±1,38 мг %, 43,2±1,62 и 49,5±1,39 мг%).
Тиоловые соединения, как белковые, так и низкомолекулярные, принимают самое непосредственное и широкое участие в механизме функционирования ферментативного звена антиоксидантной системы. Гидрофильность тиолов обусловливает их высокое содержание в водной фазе клетки, где они могут защищать от окислительного повреждения биологически важные гидрофильные молекулы, в том числе гемоглобин. Этим обстоятельством обусловливается способность низкомолекулярных тиолов проявлять не только антирадикальное, но и антиперекисное действие [7].
На состояние тиолдисульфидного звена организма могут влиять и другие серосодержащие соединения и, в частности, метионин. Взаимодействуя с радикалами и перекисями, тиолы окисляются с образованием дисульфидов и могут вновь регенерировать при восстановительном расщеплении дисульфидной (-S-S-) связи, что в определенных условиях обеспечивает возможность сохранения антиоксидантного гомеостаза. Метионин применяется для регуляции белкового и липидного обмена, способствует снижению содержания холестерина в крови, уменьшению отложения жира в печени и улучшению функции печени, может оказывать умеренное антидепрессивное действие.
Как видно из рисунка 1, в последний срок исследования количество тиоловых соединений в сыворотке крови второй группы животных равнялось 2,14±0,1 ммоль/л и на 15,7% выше контрольных показателей. У животных третьей группы концентрация тиоловых соединений повышалось по сравнению с контрольными данными на 13,8-22,7%.
Лизоцим – низкомолекулярный белок, синтезируется макрофагами, нейтрофилами и моноцитами, является важным фактором антимикробной защиты в крови и внешних секретах, а также обладает многообразной иммунорегуляторной и гомеостатической функциями. Он катализирует гидролиз стенок клеток бактерий путем разрыва N-ацетилглюкозаминовых связей [5].
При сравнении параметров лизоцимной активности сыворотки крови в динамике опыта отмечалось повышение уровня лизоцима у всех животных, в опытных группах этот процесс был более выраженным.
Лизоцимная активность на 5-е сутки у животных первой группы составляла 32,3±0,1%, второй – 35,1±0,1%, третьей – 34,8±0,1%. В последующие сроки отмечалось повышение этого показателя по второй группе на 8,6-12,3%, по третьей – на 9,6-14,2%. (рис. 2).
Заключение. Таким образом, на основании результатов наших исследований введение в рацион белых крыс при моделированной у них постгеморрагической анемии хелатных комплексов железа, меди и кобальта с белковыми аминокислотами – с метионином и триптофаном способствовало повышению в крови количества глутатиона, церулоплазмина, тиоловых соединений, лизоцимной активности и оказывало положительное влияние на нормализацию физиолого-биохимического статуса организма животных.
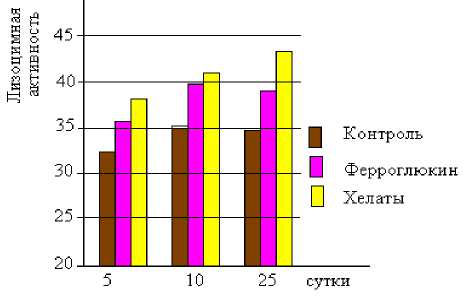
Рис. 2- Динамика изменения лизоцимной активности в сыворотке крови белых крыс, мг%
Резюме
Введение в рацион белых крыс с экспериментально моделированной у них постгеморрагической анемией хелатных комплексов железа, меди и кобальта с белковыми аминокислотами – с метионином и триптофаном способствует повышению в крови количества глутатиона, церулоплазмина, тиоловых соединений, лизоцимной активности и положительно влияет на нормализацию физиолого-биохимического статуса организма животных.
Список литературы Изучение биологической активности металлохелатов на лабораторных животных при постгеморрагической анемии
- Бушов А.В., Тен Э.В., Логинов Г.П. Влияние ферроглюкина в сочетании с хелаткомплексным соединением глицината цинка, меди и йодида калия на функции кроветворения и рост поросят-сосунов с клинической железодефицитной анемией/Учёные записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана-Казань, 2005.-Т.180.-С.21-36.
- Галочкин В.А. Система глутатиона как критерий антиоксидантного статуса животных/В.А. Галочкин, П.Е. Малиненко, В.И.Майстров//Сб. науч. тр. ВНИИФБиП с.-х. животных, 2005, 24: 97-113.
- Казаков Х.Ш. Хелаты экзогенных металлов с биогенными соединениями как стимуляторы иммунодинамических функций живого организма/Х.Ш. Казаков//Профилактика и лечение заболеваний сельскохозяйственных животных. Одесса, 1972. -С. 379-383.
- Лызлова С.Н. Лизосомальные белки нейтрофилов факторы антимикробной защиты клеток/Вопр. мед.химии. -1987. -Т.ЗЗ, вып.5. -С.43-48.
- Методы ветеринарной клинической лабораторной диагностики: Справочник/Под ред. проф. И.П. Кондрахина. -М.: КолосС, 2004. -520 с.
- Соколовский В.В. Тиоловые антиоксиданты в молекулярных механизмах неспецифической реакции организма на экстремальное воздействие/Вопросы медицинской химии. 1988. № 34 (6). С. 2-11.
- Чепелев Н.А. Минеральный обмен у коров при использовании хелатных соединений микроэлементов/Вестник Курской ГСХА, 2013, № 9. -С. 64-66.
- Щитковская Т.Р., Логинов Г.П., Павлова О.Н. Влияние хелатных комплексов меди и кобальта с метионатом в сочетании с L-карнитином на обмен липидов сыворотке крови цыплят-бройлеров//Учёные записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана-Казань, 2012.-Т. 212.-С. 217-221.
- Ярополов А.Н. Механизмы антиоксидантного действия церулоплазмина/А.Н. Ярополов//Доклады академии наук СССР. 1986. -Т. 291, № 1. -С. 237-241.
- Droge W. Glutathione and immune function/W. Droge, R. Breitkreutz//Proceedings of the Nutrition Society, 2000, 59. -Р. 595-600.


