Изучение фенольных соединений кожуры (перидермы) картофеля обыкновенного с целью получения лекарственной формы, обладающей антимикробной активностью
Автор: Андреева Ольга Андреевна, Жилина Оксана Михайловна, Куличенко Евгения Олеговна, Лукашук Светлана Павловна, Мазурина Майя Викторовна, Оганесян Эдуард Тоникович, Степанова Элеонора Федоровна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Коррекция экологического неблагополучия
Статья в выпуске: 5-2 т.17, 2015 года.
Бесплатный доступ
В статье приведены результаты исследования наличия фенольных соединений в перидерме клубней картофеля обыкновенного (Solanum tuberosum L., сем. Solanaceae) сорта «Невский». Исследования проводились методом высокоэффективной жидкостной хроматографии. В извлечении, полученном экстракцией сырья 40% спиртом этиловым, идентифицировано 13 веществ фенольной природы, относящихся к флавоноидам, фенолкарбоновым кислотам, дубильным веществам. Установлено, что в сумме всех фенольных соединений наибольшая доля (54,81%) принадлежит фенолкарбоновым кислотам, основными из которых являются кислоты феруловая и галловая. Спиртовое извлечение было использовано для приготовления мази на основе олеогеля (масло подсолнечное, аэросил) с добавлением экстракта ореха чёрного, показавшую выраженную антимикробную активность по отношению к Staphylococcus aureus (209); Staphylococcus aureus (Макаров); Staphylococcus aureus (Type); Staphylococcus epidermidis Wood-46; Bacillus subtilis L2; Bacillus anthracoides - 96; Proteus vulgaris.
Экзодерма, клубень картофеля, фенольные соединения, флавоноиды, фенолкарбоновые кислоты, дубильные вещества катехины, мазь, антимикробная активность
Короткий адрес: https://sciup.org/148204096
IDR: 148204096 | УДК: 582.926.2:615.454.1:543.544.5.068.7
Текст научной статьи Изучение фенольных соединений кожуры (перидермы) картофеля обыкновенного с целью получения лекарственной формы, обладающей антимикробной активностью
источников получения этих веществ. Особый интерес представляют отходы промышленного производства, в том числе пищевой промышленности. В процессе переработки наиболее распространённого продукта питания – картофеля образуется от 20 до 50% отходов, основная часть которых приходится на кожуру (перидерму) [5]. В то же время исследования, проведённые за рубежом, показали, что водные и водно-спиртовые извлечения из кожуры клубней некоторых сортов картофеля содержат значительное количество фенольных соединений [6] и обладают антиоксидантной [5, 7, 8] и антидепрессивной [9] видами активности.
Цель работы: исследование фенольных соединений кожуры картофеля, разработка технологии получения лекарственной формы и определение ее антимикробной активности.
Материалы и методы. Сырье заготавливали от картофеля сорта «Невский», выращенного на территории Краснодарского края. Сырьё собирали осенью 2013 года.
Предварительную оценку растительного материала на наличие в нём фенольных соединений проводили методами одно- и двумерной хроматографии на бумаге (ТХ) и тонкослойной (ТХ) на силикагеле. Использовали хроматографическую бумагу марки «Ленинградская С» и пластины «Сорбфил» (ПТСХ-П-А-УФ», производитель ЗАО «Сорбполимер», размером 10Ч10 и 10Ч15). Хроматограммы развивали в восходящем и нисходящем токах растворителей. В качестве элюирующих систем применяли:
для БХ: уксусная кислота - муравьиная кислота - вода (10 : 2 : 3); н-бутанол - уксусная кислота - вода (4 : 1 : 2) и (4 : 1 : 5); 15% и 30% уксусная кислота [3];
для ТХ: хлороформ; хлороформ - петролей-ный эфир (1 : 2); хлороформ - этанол (9 : 1) и (9 : 3); хлороформ - этанол - вода (10 : 2 : 0,1); толуол - этилацетат - уксусная кислота (5 : 4: 1) [2].
Отдельные порции (по 10 г) высушенного до постоянной массы и измельчённого растительного сырья (кожура светло жёлтого цвета толщиной не более 1 мм) трёхкратно экстрагировали 96%, 70%, 40% спиртом этиловым и водой. Экстракцию проводили в колбе с обратным холодильником. Время каждой экстракции - 60 минут. Полученные извлечения упаривали в выпарительной чашке до 3 мл. Для хроматографирования брали 0,02-0,05 мл экстракта. После разделения веществ хроматограммы просматривали в видимом и УФ-свете, затем обрабатывали парами аммиака, 5% спиртовым раствором алюминия хлорида; 10% спиртовым раствором калия гидроксида, свежеприготовленным диазореактивом - диазотированной сульфаниловой кислотой, 2% спиртовым раствором железа хлорида (III), 1% раствором ванилина в хлористоводородной кислоте.
На основании испытаний, проведенных методами БХ и ТСХ, был сделан вывод, что наибольшее число пятен на хроматограммах, принадлежащих фенольным соединениям, содержатся в извлечении, полученном экстракцией сырья 40% спиртом этанолом. Поведение веществ на хроматограммах, цвет зон адсорбции, наблюдаемый в видимом и УФ-свете до и после обработки детектирующими реактивами позволило отнести эти вещества к флавонам, катехинам, фенолокислотам, кумаринам [2,3].
Подтверждение качественного состава фенольных соединений проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Для исследования использовали хроматограф фирмы “GILSTON” (модель 305, Франция); инжектор ручной, модель RHEODYNE 7125 USA. Компьютерную обработку результатов осуществляли с помощью программы Мультихром для Windows. Неподвижной фазой являлась металлическая колонка размером 4,6х250 мм KROMASIL C18 ,размер частиц 5 микрон, подвижной фазой -система метанол-вода-фосфорная кислота концентрированная, в соотношении (400:600:5). Анализ проводили при комнатной температуре в течение 60 минут. Скорость подачи элюента 0,8 мл/мин. Детектирование осуществляли с помощью УФ-детектора “GILSTON” UV/VIS модель 151 при длине волны 254 нм.
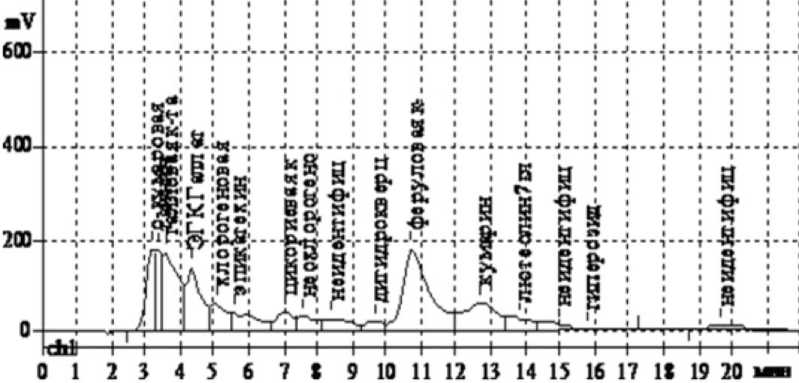
Рис. 1. Хроматограма водно-спиртового извлечения из кожуры клубней картофеля сорта «Невский»
Для подготовки пробы 10 г сырья экстрагировали 40% этанолом вышеописанным способом. Извлечение выпаривали досуха в выпарительной чашке на водяной бане и сушили до постоянной массы в сушильном шкафу при температуре не превышающей 600С. Навеску экстракта (0,9272 г) помещали в колбу вместимостью 100
мл, прибавляли 20 мл 70% спирта этилового и нагревали в течение 1 часа с момента закипания растворителя на кипящей водяной бане. Смесь охлаждали, фильтровали через бумажный фильтр в мерную колбу объёмом 25 мл и доводили 70% спиртом этиловым до метки. Параллельно в 70% спирте этиловом готовили серию 0,05% растворов сравнения следующих веществ: рутина, кверцетина, лютеолина, лютеолин-7-гликозида, кемпферола, гиперозида, геспередина, апигенина, нарингенина, дигидрокверцетина, катехина, эпикатехина; эпигалокатехингаллата (ЭГКгал-лат), танина; кумарина, дикумарина, а также кислот: галловой, кофейной, хлорогеновой, неохлорогеновой, коричной, цикориевой, феруловой. По 20 мкл исследуемого раствора и растворов сравнения вводили в хроматограф и хроматографировали в выше приведенных условиях. Вещества идентифицировали путём сопоставлением времени удерживания компонентов исследуемого раствора и растворов сравнения. Результаты исследования извлечения полученного экстракцией сырья спиртом этиловым 40% метода ВЭЖХ представлены на рисунке (рис. 1) и в табл. 1.
Таблица 1. Результаты исследования фенольных веществ кожуры клубней картофеля сорта «Невский» методом ВЭЖХ
|
Наименование РСО |
Время удер-жива-ния, мин |
Количественное соотношение в смеси,% от суммы |
|
о-кумаровая кислота |
3.112 |
6.57 |
|
танин |
3.289 |
6.51 |
|
галловая кислота |
3.548 |
13.73 |
|
ЭГКгаллат |
4.297 |
9.62 |
|
хлорогеновая кислота |
4.972 |
4.83 |
|
эпикатехин |
5.536 |
5.15 |
|
цикориевая кислота |
6.951 |
3.60 |
|
неохлорогеновая кислота |
7.504 |
2.84 |
|
дигидрокверцетин |
9.56 |
1.76 |
|
феруловая кислота |
10.68 |
23.24 |
|
кумарин |
12.66 |
9.55 |
|
лютеолин-7-глюкозид |
13.83 |
3.49 |
|
гиперозид |
15.76 |
0.60 |
|
неидентифицировано |
8.339 |
4.04 |
|
неидентифицировано |
14.94 |
2.26 |
|
неидентифицировано |
19.65 |
2.21 |
Таким образом, методом ВЭЖХ в 40%-ном извлечении из кожуры клубней исследуемого сорта картофеля было зафиксировано шестнадцать пиков, тринадцать из которых принадлежат веществам фенольной природы. Прежде всего, это фенолокислоты. Доля этих веществ в сумме всех фенольных соединений составляет 54,81%. Основными фенолокислотами являются феруловая и галловая. В извлечении также обнаружены флавоноиды. На долю лютеолин-7-глюкозида, гиперозида, дигидрокверцетина приходится только 5,85%. Несколько больше содержится катехинов – 14,77%. В изучаемом извлечении кроме выше перечисленных соединений идентифицированы танин и кумарин. Все вещества в исследуемом объекте установлены впервые, однако полученная закономерность о соотношении фенольных соединений соответствует данным, полученным для кожуры клубней других сортов картофеля [6].
Так как ранее проведенными исследованиями [4] установлено, что извлечение из кожуры картофеля обладает антимикробной активностью, авторами была поставлена задача – разработать на его основе 40% спиртового извлечения мазь косметического направления и изучить её антимикробную активность. Сырьё экстрагировали спиртом этиловым 40% методом перколяции. Спиртовую вытяжку очищали отстаиванием при пониженной температуре, затем сушили в вакууме при температуре, не превышающей 600С до получения густого экстракта [1]. В качестве мазевых основ использовали следующие вспомогательные компоненты: классическая мазевая основа вазелин с ланолином в равных соотношениях, карбопол-940 и олеогель (масло подсолнечное, аэросил). При проведении предварительных биофармацевтических исследований in vitro с помощью диффузии в 3% желатиновый гель (реактив: трехвалентное железо) установили, что максимальное высвобождение обеспечивает основа олеогель, которая сама по себе обладает противоожоговым действием (рис.2).
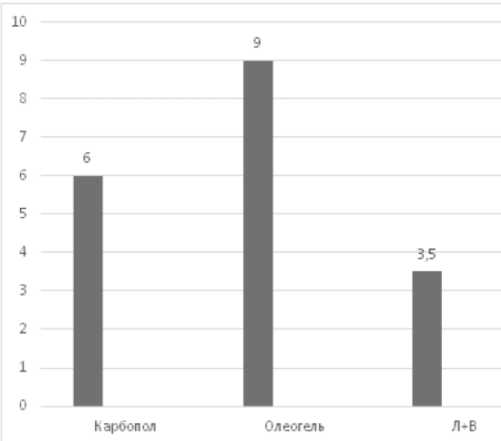
Рис. 2. Результаты биофармацевтических исследований высвобождаемости мазей
С учетом приведенных на рис.2 результатов были приготовлены две 5% мази на разных основах. Кроме действующего вещества в состав первой входили глицерин, аэросил, масло подсолнечное, экстракт чёрного ореха в качестве консерванта и пропиленгликоль (как пенетрант), в состав второй прописи - те же компоненты, но без экстракта чёрного ореха. Микробиологические исследования разработанных мазевых композиций определяли методом диффузии в агар (способ «колодцев») по отношению к 11 тест-культурам. Вводили по 0,1 г мази. Оценку результатов проводили путем измерения диаметра зон задержки роста вокруг «колодца», включая диаметр самого «колодца». Отсутствие зоны задержки роста свидетельствует о том, что испытуемая культура не чувствительна к данной концентрации препарата; диаметр зоны задержки роста на 10 мм показывает на умеренную чувствительность культуры к данной концентрации препарата, а диаметр зоны задержки роста более 10 мм на высокую чувствительность испытуемой культуры к данной концентрации препарата. В качестве объектов сравнения использовали мази, полученные на основе 40% жидких экстрактов из цветков арники и бессмертника, которые сгущали до консистенции густых экстрактов. Результаты определения антимикробной активности исследуемых образцов представлены в табл. 2.
Таблица 2. Антимикробная активность исследуемых мазей
|
Объекты исследования (компоненты мази) |
Диаметр зоны задержки роста тест-культур микроорганизмов, мм |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
|
40% экстракт из кожуры картофеля, глицерин, аэросил, масло подсолнечное, экстракт чёрного ореха, пропиленгликоль |
21 |
23 |
15 |
23 |
- |
- |
22 |
- |
13 |
- |
24 |
|
40% экстракт из кожуры картофеля, глицерин, аэросил, масло подсолнечное, пропиленгликоль |
12 |
13 |
- |
11 |
12 |
- |
20 |
11 |
13 |
- |
23 |
|
40% экстракт из арники, глицерин, аэросил, масло подсолнечное, пропи-ленгликоль, эмульгатор цестопал |
- |
10 |
- |
11 |
13 |
18 |
12 |
- |
13 |
22 |
|
|
40% экстракт из бессмертника, глицерин, аэросил, масло подсолнечное, пропиленгли-коль, эмульгатор цесто-пал |
- |
- |
- |
16 |
- |
- |
20 |
- |
11 |
- |
20 |
Примечание: используемые тест-культуры: 1. Staphylococcus aureus (209); 2. Staphylococcus aureus (Макаров) ; 3. Staphylococcus aureus (Type) ; 4. Staphylococcus epidermidis Wood-46 ; 5. Escherichia coli 675 ; 6. Salmonella galenarum ; 7. Bacillus subtilis L 2 ; 8. Bacillus anthracoides – 1 ; 9. Bacillus anthracoides - 96 ; 10. Pseudomonas aeruginosa ; 11. Proteus vulgaris
Из приведенных в табл. 2 данных следует, что мази, полученные на основе экстрактов из кожуры картофеля, обладают выраженной антимикробной активностью. По величине эта активность не уступает образцам сравнения по отношению к Staphylococcus epidermidis Wood-46 ; Bacillus subtilis L 2 ; Bacillus anthracoides - 96; Proteus vulgaris , и превосходит их по отношению к Staphylococcus aureus (209); Staphylococcus aureus (Макаров) и Staphylococcus aureus (Type). При введении в состав мази экстракта грецкого ореха её антимикробная активность по отношению к ряду тест-культур усиливается.
Выводы:
-
1. В результате проведенных исследований методами бумажной и тонкослойной хроматографии установлено, что извлечение из кожуры (перидермы) клубней картофеля сорта
-
2. Методом ВЭЖХ идентифицированы 6 фе-нолокислот, 5 веществ флавоноидной природы относящихся к флаванонолам, катехинам, гликозидам флавонов и флавонолов, одно вещество, относящееся к кумаринам и танин. Содержание фенолокислот составило 54,81%, флавоноидов 5,85%, танина 14,77%.
-
3. На основе 40% спиртового извлечения разработана технология получения лекарственной формы - 5% мази на различных мазевых основах, показавшая выраженную микробиологическую активность, которая в ряде случаев усиливается при добавлении в её состав экстракта из грецкого ореха.
-
4. Результаты исследований подтверждают 5.
Schieber, A. Potato Peels: A Source of Nutritionally and Pharmacologically Interesting Compounds – A Review/ A. Schieber, M.A. Saldaňa // Food Global Science Books. 2009. P. 23-29.
Lewis, C.E. Anthocyanins and Related Compounds in Potatoes (Solanum tuberosum L.): A thesis submitted of Doctor of Philosophy in Biochemistry University of Canterbury Christchurch, New Zealand, 1996. 367 p.
Ezekiel, R. Beneficial phytochemicals in potato — a review / N. Singh, S. Sharma, A. Kaur // Food Research International. 2013. V.50. P. 487-496.
Ah-Hen, K. Antioxidant capacity and total phenolic compounds of twelve selected potato landrace clones grown in Southernchile / K. Ah-Hen, C. Fuenzalida, S. Hess et al. // Chilean journal of agricultural research. 2012. V. 72 (1). P. 3-9.
Keerthi, V. Evaluation of antidepressant activity of ethanolic and aqueous extract of Solanum tuberosum peel / V. Keerthi, M. Sriramoju, D. Alumdri, S. Akula // J. Compr. Phar. 2014. V. 1 №5. P. 164-167
«Невский», полученное экстракцией 40% спиртом этиловым, содержит разнообразный комплекс фенольных соединений.
перспективность дальнейшего изучения отходов клубней картофеля с целью создания на их основе биологически активных субстанций и лекарственных форм. .
Список литературы Изучение фенольных соединений кожуры (перидермы) картофеля обыкновенного с целью получения лекарственной формы, обладающей антимикробной активностью
- Европейская фармакопея. Вып. 7.0. -Страсбург., 2011. 1812 с.
- Кирхнер, Ю. Тонкослойная хроматография. В двух томах. -М.: Мир, 1981. 616 с.
- Клышев, Л.К. Флавоноиды растений (распространение, физико-химические свойства, методы исследования)/Л.К. Клышев, В.А. Бандюкова, Л.С. Алюкина. Алма-Ата, 1978. 220 с.
- Куличенко, Е.О. Исследование химического состава и антимикробной активности перидермы клубней картофеля/Е.О. Куличенко, О.А. Андреева, С.П Лукашук, М.В. Мазурина//Фармация и фармакология. 2014. №4 (11). С. 4-6.
- Schieber, A. Potato Peels: A Source of Nutritionally and Pharmacologically Interesting Compounds -A Review/A. Schieber, M.A. Saldaňa//Food Global Science Books. 2009. P. 23-29.
- Lewis, C.E. Anthocyanins and Related Compounds in Potatoes (Solanum tuberosum L.): A thesis submitted of Doctor of Philosophy in Biochemistry University of Canterbury Christchurch, New Zealand, 1996. 367 p.
- Ezekiel, R. Beneficial phytochemicals in potato -a review/N. Singh, S. Sharma, A. Kaur//Food Research International. 2013. V.50. P. 487-496.
- Ah-Hen, K. Antioxidant capacity and total phenolic compounds of twelve selected potato landrace clones grown in Southernchile/K. Ah-Hen, C. Fuenzalida, S. Hess et al.//Chilean journal of agricultural research. 2012. V. 72 (1). P. 3-9.
- Keerthi, V. Evaluation of antidepressant activity of ethanolic and aqueous extract of Solanum tuberosum peel/V. Keerthi, M. Sriramoju, D. Alumdri, S. Akula//J. Compr. Phar. 2014. V. 1 №5. P. 164-167


