Изучение физиолого-биохимических свойств дрожжей-сахаромицетов в зависимости от приуроченности к растительному субстрату
Автор: Абдуллабекова Д.А., Магомедова Е.С., Магомедов Г.Г.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биологические ресурсы: фауна
Статья в выпуске: 1-5 т.13, 2011 года.
Бесплатный доступ
Показано, что физиолого-биохимические особенности дрожжей-сахаромицетов, изолированных с различных видов растений - винограда и плодов абрикоса, могут быть обусловлены первичной адаптацией к растению. Отмечена возможность использования штаммов, независимо от их приуроченности к субстрату обитания, для получения качественных спиртосодержащих напитков из этих видов сырья.
Дрожжи, плоды, виноград, адаптация, среда культивирования, метаболизм
Короткий адрес: https://sciup.org/148199790
IDR: 148199790 | УДК: 663.252.41;
Текст научной статьи Изучение физиолого-биохимических свойств дрожжей-сахаромицетов в зависимости от приуроченности к растительному субстрату
Современная технология отечественных вин основана на использовании чистых культур дрожжей Saccharomyces cerevisiae с известными свойствами, которые способствуют соблюдению режимов производства и обеспечивают качество продукции. Для получения виноградных и плодово-ягодных вин обычно применяются дрожжи, выделенные с одноименных растительных субстратов. Дифференцированный подход к выбору культур обусловлен особенностями обмена клетки, которые, возможно, являются результатом их адаптации к первоначальному источнику обитания в природе. Исследования физиолого-биохимических признаков сахаромицетов в зависимости от приуроченности к виду растения, дополняя сведения о метаболизме эукариотической клетки, способствуют скринингу ценных для производства штаммов. Изучение жизнедеятельности дрожжей в этом аспекте составило цель наших исследований .
Известно, что специфической средой обитания дрожжей, применяемых в виноделии, являются виноград и плодово-ягодные растения. В работе использовали штаммы, изолированные с ягод винограда и плодов абрикоса, которые собирали и раздавливали с соблюдением необходимых мер стерильности, предусмотренных в
Магомедов Гаджи Гасайникадиевич, научный сотрудник микробиологии [1, 2]. Спонтанно забродившее сусло рассеивали на агаризованную среду в чашках Петри, которые инкубировали при температуре 18-200С. Выросшие изолированно колонии после предварительного микроскопирования выделяли в культуры и для идентификации вида проводили диагностическое тестирование по культурально-морфологическим признакам, согласно определителям и пособиям [14]. Выделенные культуры хранили в холодильнике на скошенной агаризованной среде и пересеивали каждые 4-6 месяцев.
О метаболизме дрожжей, культивируемых на абрикосовой и виноградной среде, судили по значению показателей, во многом определяющих эффективность технологического процесса – энергии брожения, количеству образовавшегося этилового спирта, несброженных сахаров, титруемых кислот и компонентов летучего комплекса. В работе использовали двухсуточные дрожжевые разводки, которые вводили из расчёта 3 млн. клеток/см3. При определении скорости разложения сахаров опыты ставили в склянках объёмом 100 см3, закрытых пробками с отверстием, куда вставлялась трубка с тонко оттянутым концом в несколько сантиметров для выхода углекислоты и предотвращения испарения бродящего сока. По ежедневной убыли в массе, соответствующей количеству выделившегося углекислого газа, судили о скорости сбраживания сахаров. Температура брожения колебалась в пределах 22-250С. Количество этанола, остаточных сахаров, титруемых кислот, средних эфиров в сброженных средах определяли в соответствии с действующими ГОСТами [5]. Комплекс летучих компонентов исследовали на газовом хроматографе
«Кристалл-200М» с пламенно-ионизационном детектором на капиллярной колонке НР-FFAР (50 м х0,32 мм) с 10%-ным диэтилленгликоль-сукцинатом, газ-носитель азот (1,8-2,7 дм3 /ч).
Результаты изучения скорости сбраживания сахаров, являющейся одной из важных характеристик углеводного обмена дрожжей показали, что при культивировании на родственной среде они проявляли большую активность. На рис. 1 и 2 представлена энергия брожения двух штаммов, на примере которых очевидно преимущество каждого на одноименном субстрате. Так, плодовому штамму для утилизации 90% сахаров, содержащихся в абрикосовом соке, потребовалось 7-8 дней, а виноградному – более 25 (рис. 1). При жизнедеятельности этих культур в виноградном сусле более энергичным оказался виноградный штамм (рис. 2). Результаты данного эксперимента свидетельствуют о влиянии адаптированности дрожжей к определенному растительному субстрату на их энергию брожения. При анаэробной диссимиляции углеводов наряду с образованием основных продуктов жизнедеятельности дрожжей – спирта и диоксида углерода, синтезируются вторичные и побочные продукты брожения, обусловливающие букет и вкус вина.
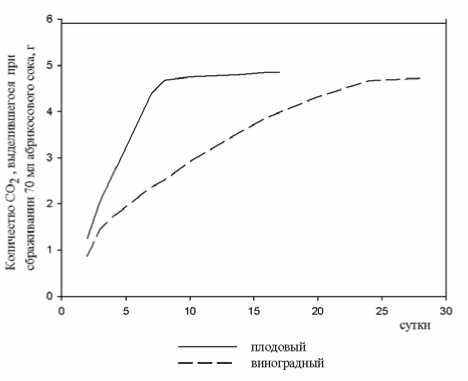
Рис.1. Энергия брожения штаммов на абрикосовом соке
Научный и практический интерес вызывало исследование влияния приуроченности дрожжей к определенному субстрату, на способность к продуцированию этих соединений при их культивировании в средах, полученных из различных видов растительного сырья. В качестве объекта изучения были выбраны штаммы (1-А; 2-А), изолированные с абрикосов, которые инокулировали в абрикосовый (варианты 1, 2) и виноградный (варианты 3, 4) соки, сахаристостью, г/100 см3 - 13,7; 20,6 и титруемой кислотностью, г/дм3 - 3,6; 8,0, соответственно. Дрожжи вводили в количестве 3 млн. кле-ток/см3, брожение проводили до его естественной остановки.
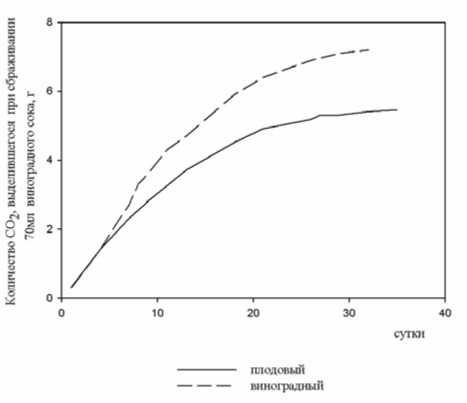
Рис. 2. Энергия брожения штаммов на виноградном соке
Согласно полученным данным, приведенным в таблице, при культивировании плодовых дрожжей на обеих средах состав сброженных субстратов колебался в зависимости от индивидуальных особенностей штамма. Жизнедеятельность плодовых культур в вариантах 1, 2 сопровождалась полным выбраживанием сахаров, в отличие от вариантов 3, 4, где питательной средой служил виноградный сок. В последних отмечали значительно большее количество остаточных сахаров, что может быть связано с тем, что дрожжи при культивировании на виноградном соке отличались меньшей интенсивностью брожения, чем в абрикосовом. Во всех вариантах наблюдали повышение уровня титруемых кислот.
Способность к образованию компонентов летучего комплекса – летучих кислот, ацетальдегида, эфиров, высших спиртов (ВС), количество которых колебалось в пределах – 0,2-1,1 г/дм3, 12,9-63,5 мг/дм3, 39,4-99,9 мг/дм3, 169,2232,4 мг/дм3, соответственно, зависела от особенностей штамма и среды культивирования. При этом жизнедеятельность плодовых культур на виноградном соке сопровождалась меньшим продуцированием ацетальдегида и высших спиртов, в том числе изобутанола, изоамилола и усилением синтеза пропанола-1, бутанола-1, гексанола, фенилалэтанола, а также летучих кислот. Одинаковая направленность в количественном изменении вышеперечисленных соединений при инокулировании штаммов с различными индивидуальными свойствами в инородную среду, по-видимому, является проявлением метаболических особенностей, характерных для всех дрожжевых клеток, возникающих в результате приуроченности их к определённому растительному субстрату, и не зависит от штаммовой принадлежности. В связи с отмеченными тенденциями, о специфичности метаболизма плодовых дрожжей в этой среде, на наш взгляд, можно судить, сравнивая данные субстрате, сброженном на штаммах, выделенных об уровне образования летучих кислот, аце- с винограда и результаты вариантов 3, 4, при-тальдегида и высших спиртов в виноградном ведённых в таблице.
Таблица. Поведение штаммов в различных субстратах
|
Показатели |
штаммы |
|||||
|
абрикосовые |
виноградные |
|||||
|
штамм/вариант |
вариант |
|||||
|
1-А/1 |
2-А/2 |
1-А/3 |
2-А/4 |
5 |
6 |
|
|
спирт, %об. |
8,1 |
7,8 |
10,7 |
11,2 |
11,5 |
12,3 |
|
остаточные сахара, г/100 см3 |
0,2 |
0,3 |
2,5 |
0,7 |
0,2 |
0,3 |
|
титруемые кислоты, г/дм 3 |
4,3 |
4,1 |
8,6 |
8,5 |
7,3 |
9,0 |
|
летучие кислоты, г/дм 3 |
0,2 |
0,2 |
1,1 |
0,6 |
0,3 |
0,5 |
|
ацетальдегид, мг/дм3 |
62,0 |
63,5 |
12,9 |
25,4 |
22,4 |
45,6 |
|
средние эфиры, мг/дм3 высшие спирты, мг/дм3: |
99,9 |
54,1 |
39,4 |
94,2 |
54,1 |
71,5 |
|
пропанол-1 |
10,9 |
15,2 |
21,5 |
22,9 |
9,7 |
15,5 |
|
изобутанол |
31,9 |
27,3 |
14,9 |
19,7 |
20,1 |
38,1 |
|
бутанол-1 |
0,6 |
0,6 |
4,4 |
3,9 |
0,8 |
2,2 |
|
изоамилол |
166,3 |
120,3 |
137,2 |
101,2 |
152,4 |
172,3 |
|
гексанол |
0,2 |
- |
0,6 |
0,7 |
0,7 |
1,7 |
|
фенилэтанол |
22,5 |
18,7 |
28,7 |
20,8 |
32,3 |
48,8 |
|
Сумма ВС |
232,4 |
182,1 |
207,3 |
169,2 |
211,0 |
277,9 |
Для получения сведений о способности дрожжей, изолированных с винограда, к синтезу этих летучих соединений, поставили серию опытов, где использовали виноградный сок из различных микрорайонов с сахаристостью, г/100 см3 - 20,1; 21,0 и титруемой кислотностью, г/дм3 – 5,8; 7,7, который сбраживали на трёх природных и двух коллекционных штаммах по методике, изложенной выше. Согласно экспериментальным данным, во всех опытах, независимо от состава питательной среды и свойств штамма, отмечали полное выбражива-ние сахаров и возрастание количества титруемых кислот, которое как и продуцирование дрожжами этанола и соединений летучего комплекса – летучих кислот, ацетальдегида и высших спиртов варьировало в зависимости от штамма. Минимальная и максимальная концентрация этих компонентов, полученная в наших исследованиях, приведена в таблице – варианты 5 и 6, соответственно.
Сравнение результатов по продуцированию плодовыми и виноградными дрожжами летучих соединений показало, что максимальное количество летучих кислот, бутанола-1 и пропанола-1, было в вариантах 3, 4, а ацетальдегида, гексанола, фенилэтанола приближалось к значениям, характерным для виноградных дрожжей. Образование изоамилола, как известно обладающего неприятным сивушным оттенком и являющегося наиболее токсичным из спиртов, у плодовых штаммов отмечали в меньших количествах, чем у последних. В целом, биосинтезирующая способность плодовых культур в виноградном сусле сравнима со штаммами, приуроченными к винограду, что, по-видимому, обусловлено влиянием состава этой питательной среды на метаболизм дрожжей-сахаромицетов.
В литературе имеются сведения об эффективном использовании штаммов, изолированных с определённых растительных субстратов, в средах, не характерных для их жизнедеятельности. Так, например, показана способность дрожжей, выделенных с ягод черной смородины, к активному сбраживанию не только чёрносмородинового, но и яблочного сусла. Большинство из них на родственном соке образуют больше углекислого газа, этанола, биомассы, меньше вторичных метаболитов, в том числе ацетальдегида [6]. Известно, что ацетальдегид, являющийся важным продуктом обмена клетки, имеет большое технологическое значение, так как участвуя в синтезе многих соединений, влияет на формирование качества виноматериалов. В связи с этим полученные нами сведения о продуцировании природными дрожжами уксусного альдегида в разных плодово-ягодных соках, могут быть полезны при подборе штаммов. Дегустация опытных виноградных и абрикосовых напитков показала, что независимо от приуроченности использованного штамма к растительному субстрату, их цвет, вкус и аромат соответствовали требованиям, предъявляемым при производстве натуральных спиртосодержащих напитков из этого сырья.
Выводы: проявление отдельных физиолого-биохимических признаков природных штаммов, изолированных с винограда и плодов абрикоса, может быть обусловлено их первичной адаптацией к растительным субстратам. Метаболические особенности, отмечаемые при культивировании этих дрожжей на инородных средах, не исключают возможности использования их для приготовления из последних качественных спиртосодержащих напитков. Получение сведений о характере связи между приуроченностью дрожжей-сахаромицетов к субстрату обитания и их жизнедеятельностью на плодово-ягодных соках различного вида, сделает поиск штаммов в интересах биотехнологии более целенаправленным.
Список литературы Изучение физиолого-биохимических свойств дрожжей-сахаромицетов в зависимости от приуроченности к растительному субстрату
- Бабьева, И.П. Методы выделения и идентификации дрожжей/И.П. Бабьева, В.И. Голубев. -М.: Пищевая пром-сть, 1979. 116 с.
- Бурьян, Н.И. Микробиология виноделия. 2-е изд. доп. -Симферополь: Таврия, 2002. 403 с.
- Кудрявцев, В.И. Систематика дрожжей -М.: Изд-во АН СССР, 1954. 427 с.
- Риберо-Гайон, Ж. Теория и практика виноделия/Ж. Риберо-Гайон, Э. Пейно, П. Риберо-Гайон, П. Сюдро. -М.: Пищевая пром-сть, 1980. Т. 2. 352 с.
- Государственный контроль качества винодельческой продукции. -М.: Издательство стандартов, 2003. 872 с.
- Колесник, И.М. Новые штаммы для плодово-ягодного виноделия/И.М. Колесник, М.М. Жолудев, Н.Н. Мартыненко, И.М. Грачева//Виноделие и виноградарство. 2004. №3. С. 15-17.


