Изучение генетического разнообразия генотипов дикого граната (Punica granatum L.) Азербайджана с использованием маркеров ISSR
Автор: Гаджиева С.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 3, 2020 года.
Бесплатный доступ
Цель исследования - изучение генотипов дикого граната Азербайджана из 6 географических районов. Исследование проводилось в лаборатории биотехнологии Института генетических ресурсов Национальной Академии Наук Азербайджана в 2015-2018 гг. Объектом для исследования явились 90 образцов граната, фрагменты листьев которых были собраны из 6 районов Азербайджана. Было идентифицировано 110 ПЦР-фрагмента, из них 86 оказались полиморфными. Число амплифицированных фрагментов на локус варьировало от 5 до 10, а диапазон длин полученных фрагментов находился в пределах 100-1100 п.н. В среднем один праймер инициировал синтез 7,8 фрагментов. Количество полиморфных фрагментов ДНК варьировало от 3 до 9. Минимальное число полиморфных фрагментов идентифицировалось праймерами UBC 827 и UBC 857, среднее число которых составило 6,1. В зависимости от праймера количество полиморфных локусов колебалось в пределах 57-100 %, уровень полиформизма в среднем составил 78 %. Был вычислен индекс генетического разнообразия (ИГР) по каждому ISSR локусу, среднее значение которого составило 0,77...
Дикий гранат (punica granatum l.), молекулярные маркеры, issr-праймеры, генетический полиморфизм, кластерный анализ
Короткий адрес: https://sciup.org/140248923
IDR: 140248923 | УДК: 634.6 | DOI: 10.36718/1819-4036-2020-3-20-28
Текст научной статьи Изучение генетического разнообразия генотипов дикого граната (Punica granatum L.) Азербайджана с использованием маркеров ISSR
Введение. Дикий гранат ( Punica granatum L.) хорошо адаптирован к широкому спектру климатических условий и поэтому имеет широкое географическое распространение. Естественный рост диких гранатовых деревьев наблюдается в Центральной Азии, включая Иран, Афганистан и Южный Кавказ, а также в северо-западной Индии [1]. Растения граната характеризуются высокой адаптивностью к абиотическому стрессу, благодаря чему он широко возделывается в тропических и субтропических районах Средиземноморья (Египет, Марокко, Испания, Турция и Тунис) [2].
Географическое расположение и разнообразие почвенно-климатических условий Азербайджана, являющегося центром образования некоторых видов растений, способствовало богатому разнообразию культурных растений. История страны неразрывно связана с культурой возделывания граната, имеющего большой ареал распространения и богатое биологическое разнообразие из-за благоприятных условий выращивания. Гранат – один из широко культивируемых плодовых растений. Не удивительно, что гранат считается одним из национальных символов Азербайджана. Поэтому изучение генетического разнообразия растений граната, идентификация генотипов представляет большой научный интерес. Растения граната в основном изучались по морфологическим признакам [3]. Эти показатели, являясь важными при идентификации образцов, не позволяют оценить большое количество растений, подвергнутых действию окружающей среды [4]. Для оценки этой культуры и во избежание дублирования помимо морфологических признаков необходимо охарактеризовать каждый генотип, изучив его генетический профиль с помощью методов, основанных на ДНК-маркерном анализе [5, 6].
Цель исследования : изучение генотипов дикого граната Азербайджана из 6 географических районов.
Результаты исследований позволят проводить селекционные работы в различных направлениях.
Материал и методы исследования . Исследование проводилось в лаборатории биотехнологии Института генетических ресурсов Национальной Академии Наук Азербайджана в 2015–2018 гг. Объектом для исследования явились 90 образцов граната, фрагменты листьев которых были собраны из 6 районов Азербайджана (табл. 1).
Молекулярный анализ. При выделении геномной ДНК брали навески по 0,1 г из свежесобранных листьев, согласно ЦТАБ (цетилтриме-тиламмониум бромид) протоколу, предложенному Doyle et Doyle с некоторыми модификациями [7]. Концентрацию и степень чистоты молекулы ДНК определяли с помощью НаноДропа (Thermo, NANO DROP, 2000). Конеч-ный объем реакционной смеси образца для ПЦР составлял 20 мкл, содержащей 2 мкл 10×ПЦР буфера; 2 мкл смеси dNTP (5 мM); 1,5 мкл MgCl2 (50 мM); 2 мкл каждого праймера (15 пмоль/мкл); 0,1 мкл фермента Taq полимеразы (1 U/мкл) и 2 мкл выделенной ДНК (50 нг/мкл). Для мультилокусного межмикро-сателлитного анализа были использованы 14 полиморфных ISSR праймеров длиной 11–18 нуклеотидов. В результате проведенной оптимизации были выбраны следующие условия амплификации: предварительная денатурация при температуре 94 °C в течение 5 мин, последующие 35 циклов – денатурация 94 °С (1 мин), температура отжига в зависимости от использованного праймера (45 с), синтез – 5 мин при 72 °C, финальный цикл элонгации при температуре 72 °C в течение 10 мин. Амплификацию проводили в программируемом термоциклере T100 (Applied Biosystems, USA). Электрофорез ПЦР-продуктов проводили в 2 %-м агарозном геле с добавлением этидиум бромида и визуализировали под ультрафиолетовым светом с использованием гель-документирую-щей системы BioRad.
Таблица 1
|
Номер |
Место сбора |
Код |
Номер |
Место сбора |
Код |
Номер |
Место сбора |
Код |
|
1 |
Агсу |
A1 |
31 |
Исмаиллы |
И1 |
61 |
Самух |
Ca1 |
|
2 |
A2 |
32 |
И2 |
62 |
Ca2 |
|||
|
3 |
A3 |
33 |
И3 |
63 |
Ca3 |
|||
|
4 |
A4 |
34 |
И4 |
64 |
Ca4 |
|||
|
5 |
A5 |
35 |
И5 |
65 |
Ca5 |
|||
|
6 |
A6 |
36 |
И6 |
66 |
Ca6 |
|||
|
7 |
A7 |
37 |
И7 |
67 |
Ca7 |
|||
|
8 |
A8 |
38 |
И8 |
68 |
Ca8 |
|||
|
9 |
A9 |
39 |
И9 |
69 |
Ca9 |
|||
|
10 |
A10 |
40 |
И10 |
70 |
Ca10 |
|||
|
11 |
A11 |
41 |
И11 |
71 |
Ca11 |
|||
|
12 |
A12 |
42 |
И12 |
72 |
Ca12 |
|||
|
13 |
A13 |
43 |
И13 |
73 |
Ca13 |
|||
|
14 |
A14 |
44 |
И14 |
74 |
Ca14 |
|||
|
15 |
A15 |
45 |
И15 |
75 |
Ca15 |
|||
|
16 |
Габала |
Га1 |
46 |
Гёйчай |
Гё1 |
76 |
Сабирабад |
C1 |
|
17 |
Га2 |
47 |
Гё2 |
77 |
C2 |
|||
|
18 |
Га3 |
48 |
Гё3 |
78 |
C3 |
|||
|
19 |
Га4 |
49 |
Гё4 |
79 |
C4 |
|||
|
20 |
Га5 |
50 |
Гё5 |
80 |
C5 |
|||
|
21 |
Га6 |
51 |
Гё6 |
81 |
C6 |
|||
|
22 |
Га7 |
52 |
Гё7 |
82 |
C7 |
|||
|
23 |
Га8 |
53 |
Гё8 |
83 |
C8 |
|||
|
24 |
Га9 |
54 |
Гё9 |
84 |
C9 |
|||
|
25 |
Га10 |
55 |
Гё10 |
85 |
C10 |
|||
|
26 |
Га11 |
56 |
Гё11 |
86 |
C11 |
|||
|
27 |
Га12 |
57 |
Гё12 |
87 |
C12 |
|||
|
28 |
Га13 |
58 |
Гё13 |
88 |
C13 |
|||
|
29 |
Га14 |
59 |
Гё14 |
89 |
C14 |
|||
|
30 |
Га15 |
60 |
Гё15 |
90 |
C15 |
Генотипы дикого граната, собранные в разных регионах Азербайджана
Статистическая обработка полученных данных. Анализ амплифицированных фрагментов был проведен с помощью компьютерной программы PAST [8]. Построение дендрограммы и оценка генетической близости между об- разцами проводили на основе индекса генетического сходства Жаккарда, кластеризация осуществлялась с помощью метода UPGMA.
Коэффициент генетического разнообразия вычислялся согласно формуле Вейра [9]:
ИГР=1-∑^pi2 , где ИГР – индекс генетического разнообразия; Pi – частота встречаемости аллелей.
Для анализа информационного полиморфизма были использованы некоторые статистические параметры: PIC [10].
Значение PIC для каждого локуса вычислялось согласно формуле, предложенной Roldan-Ruiz [11]:
PICi=2fi(1 – fi), где PICi – PIC для локуса i; fi – частотавстречае-мости амплифицированных фрагментов (присутствующие спектры); (1 – fi) – частота встречаемости не амплифицированных фрагментов (отсутствующие спектры). Среднее значение PICi по всем изученным локусам для каждого праймера дает нам величину PIC.
Результаты исследования и их обсуждение
ISSR полиморфизм
Тестирование 20 праймеров позволило выявить 14 наиболее эффективных для дальнейшего анализа, с использованием которых было идентифицировано 110 фрагментов, из которых 86 (78 %) оказались полиморфными, 24 (22 %) – мономорфными.
В среднем один праймер инициировал синтез 7,8 фрагментов. Наибольшее количество ампликонов было детектировано для праймера UBC 811. Количество полиморфных фрагментов ДНК варьировало от 3 до 9. Минимальное число идентифицировалось праймерами UBC 827 и UBC 857, максимальное – при амплификации ДНК с праймерами UBC 811 и UBC 840.
Среднее число полиморфных фрагментов на праймер составило 6,1. Определено варьирование количества полиморфных локусов в зависимости от праймера: от 57 до 100 %. В среднем уровень полиморфизма, выявленный ISSR-анализом, составил 78 %. Для праймера UBC 811 и IS15 определен 100 % уровень полиморфизма (табл. 2). В данном исследовании по каждому ISSR-локусу был вычислен индекс генетического разнообразия (ИГР). Среднее значение ИГР для всей изученной коллекции равнялось 0,77. Высокие значения индекса были выявлены праймерами IS 15, UBC 811 и HB 14 (0,92; 0,90 и 0,90 соответственно).
ISSR-праймеры и их статистические параметры
Таблица 2
|
Праймеры |
Тип повторяющейся последовательности |
КАФ |
КПФ |
PIC |
Полиморфизм, % |
ИГР |
|
UBC 808 |
(AG) 8 C |
8 |
7 |
0,39 |
88 |
0,70 |
|
UBC 810 |
(GA) 8 T |
7 |
4 |
0,28 |
57 |
0,67 |
|
UBC 811 |
(GA) 8 C |
10 |
9 |
0,44 |
90 |
0,90 |
|
UBC 812 |
(GA) 8 A |
7 |
5 |
0,36 |
71 |
0,83 |
|
UBC 827 |
(AC) 8 G |
5 |
3 |
0,28 |
60 |
0,33 |
|
UBC 834 |
(AG) 8 YT |
8 |
6 |
0,36 |
75 |
0,80 |
|
UBC 840 |
(GA) 8 TT |
10 |
6 |
0,32 |
60 |
0,81 |
|
UBC 857 |
(AC) 8 TT |
5 |
3 |
0,34 |
60 |
0,70 |
|
UBC 868 |
(GAA) 6 |
9 |
7 |
0,41 |
78 |
0,85 |
|
HB 14 |
(CTC) 3 GC |
8 |
7 |
0,43 |
88 |
0,90 |
|
ISSR 3 |
TGT (AC) 7 A |
7 |
5 |
0,40 |
71 |
0,70 |
|
ISSR 16 |
CGT(CA) 7 C |
8 |
8 |
0,48 |
100 |
0,90 |
|
IS 11 |
(AGC) 6 G |
9 |
7 |
0,25 |
78 |
0,84 |
|
IS 15 |
(GA) 8 CG |
9 |
9 |
0,43 |
100 |
0,92 |
|
Всего |
- |
110 |
86 |
- |
- |
- |
|
Среднее значение |
- |
7,8 |
6,1 |
0,39 |
78 |
0,77 |
Изучение генетического разнообразия сортов и популяций дикого граната исследователи разных стран проводили с использованием различных молекулярных маркеров. Так, генетическое разнообразие популяций граната из Китая и культурных сортов Туниса было оценено с использованием AFLP, являющегося одним из наиболее широко используемых в исследованиях [12, 13]. M. Talebi и др., используя 13 RAPD-праймеров для характеристики 28 генотипов граната из коллекции Йезд Ирана, выявили низкий уровень полиморфизма, объяснив это тем, что исследованные сорта были либо клонированы, либо вегетативно размножены [14]. Такие же результаты были получены Sarkhosh и др. [15], изучившими с использованием RAPD-анализа генотипы граната из Ирана. Эффективность исследования молекулярными маркерами оценивается выявленным им уровнем полиморфизма. ISSR относится к классу молекулярных маркеров, основанных на межтандемных повторах коротких ДНК последовательностей. Эти межмикросателлитные повторы выявляют высокий полиморфизм даже среди близкородственных генотипов, благодаря отсутствию функциональных ограничений в этих не кодирующих регионах [16]. ISSR – эффективный молекулярный маркер, характеризующий генетическую изменчивость в популяциях дикого граната [17].
В наших исследованиях все 14 ISSR-праймеров, апробированных нами, проявили себя полиморфными, т. е. эффективными для генотипирования образцов граната. В результате инициирования синтеза 110 фрагментов выявлен высокий уровень полиморфизма, составивший 78 %. Полученные данные согласуются с результатами исследований Narzary и др., установивших с применением 17 ISSR-праймеров полиморфизм на уровне 76,5 % [18]. Причина высокого полиморфизма межмикросателлитных маркеров может быть обусловлена их мульти-аллельной природой и гипервариабельностью. Наибольшая частота встречаемости полиморфных локусов отмечена при использовании праймеров с динуклеотидным повтором (AG)8, использование которого позволило выявить 100 % полиморфизм, что согласуется с исследованиями Carvalho и др., установившими эффективность применения праймеров ISSR, включаю- щих повторы (AG)n [19]. Эффективность использования ISSR-маркеров с целью определения полиморфизма ДНК отмечалась ранее и в других исследованиях. El Amine Ajal с сотрудниками [20], оценивая генетическое разнообразие 27 сортов граната из Марокко с помощью 8 ISSR-праймеров, выявили 70 фрагментов, 61 из которых были полиморфными. Индекс генетического расстояния Нея варьировал от 0,12 до 1 и в среднем был равен 0,67, что позволило сделать вывод об эффективности использования ISSR-маркеров для оценки полиморфизма и генетического разнообразия генотипов граната. В нашем исследовании по всем ISSR-локусам был вычислен индекс генетического разнообразия, среднее значение которого составило 0,67. Высокий показатель генетического разнообразия был выявлен праймерами UBC 812 и UBC 811 (0,83 и 0,90 соответственно). На информативность этих праймеров указывал и Z. Noormo-hammadi [21]. Полученные нами данные о высоком уровне ИГР свидетельствуют о богатом генетическом разнообразии коллекции граната, собранной из различных регионов Азербайджана.
Для оценки информационного полиморфизма был применен ряд статистических подходов. Маркерные системы различают по мере их информативности, что, в свою очередь, зависит от степени их полиморфизма. Одним из основных параметров, определяющих меру информативности маркеров, является величина информационного полиморфизма (PIC). Как известно, для доминантных маркеров значение PIC изменяется от 0 до 0,5, поскольку для такого типа маркеров допускается только два аллеля на локус и обе величины подвержены влиянию числа и частоты аллелей [22]. Из исследованных нами 86 полиморфных локусов наиболее информативными проявили себя 40 (PIC i > 0,40). Наиболее высокий показатель PIC (0,48) отмечен с применением праймера ISSR 16 с динуклеотидным повтором (CA) 7 (см. табл. 2). Для большинства изученных локусов выявлены средние значения PIC, которые колебались в пределах 0,25–0,44, средние и высокие показатели которых достаточны для идентификации и оптимальны для дифференциации изученных групп генотипов.
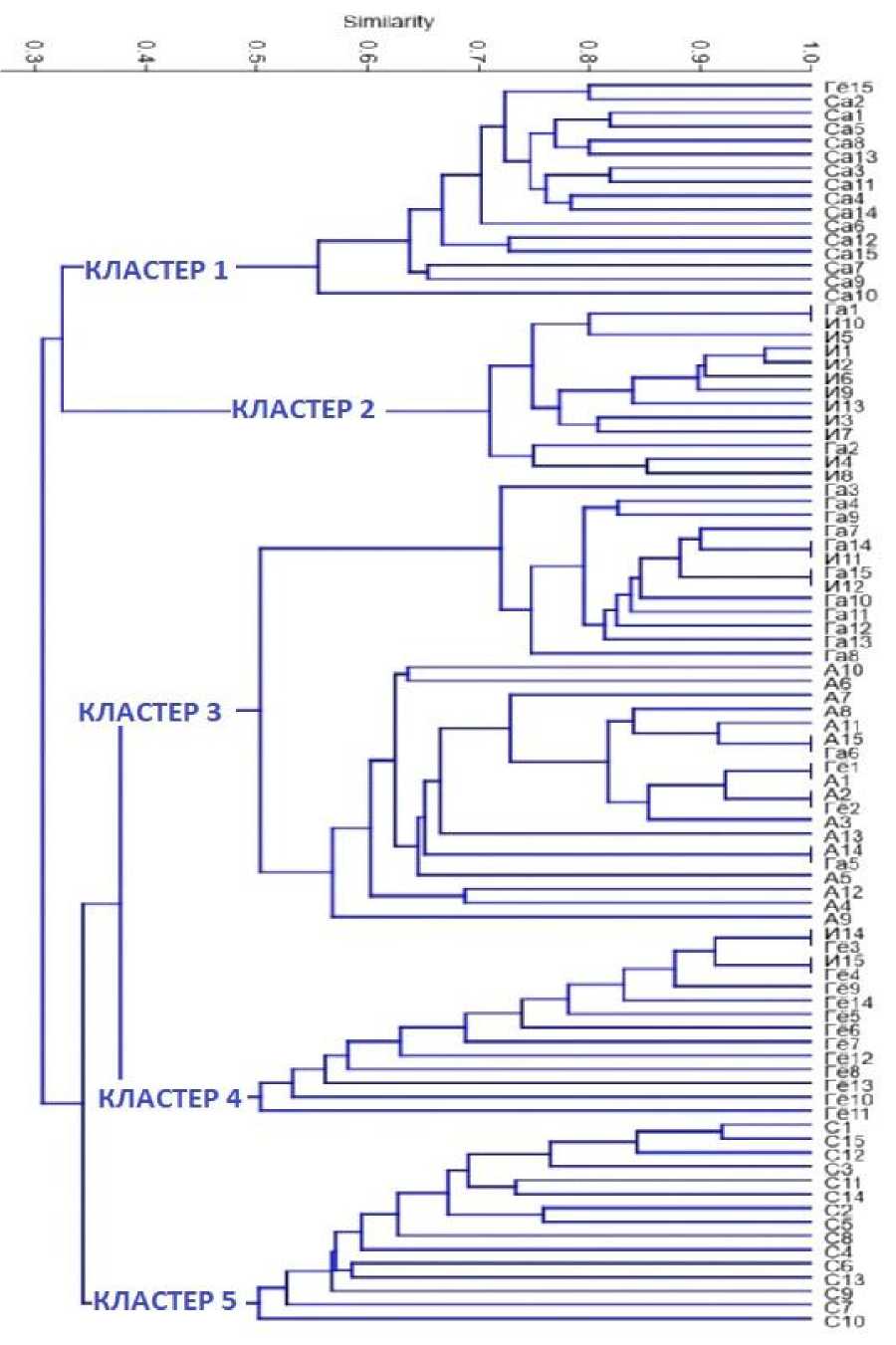
Дендрограмма, построенная по результатам ISSR-анализа на основе индекса генетического сходства Жаккарда
Высокое значение PIC для ISSR-праймеров может быть объяснено высокой информативностью маркеров [23]. Полученные нами значения PIC значительно превышают подобные данные в исследованиях M. Talebi и др. [14], у которых среднее значение PIC было равно 0,163, находилось в пределах 0,099–0,257, а также D. Narzary и др. [18], у которых среднее значение было равно 0,15, находясь в пределах 0,12– 0,21. В исследованиях Z. Noormohammadi при изучении с помощью 6 ISSR-праймеров 36 генотипов граната значение PIC колебалось в пределах 0,272 (UBC 834) – 0,494 (UBC 811), что согласуется с нашими результатами [21].
Кластерный анализ позволил дифференцировать большинство исследованных образцов (рис.). Количество сгруппированных образцов на дендрограмме варьировалось от 14 до 32. Наиболее многочисленным был кластер 3, в котором было локализовано 32 образца, что составило 35 % всех изученных генотипов. Следует отметить, что в этом кластере объединены генотипы, собранные в Агсуинском регионе. В этот кластер вошли также 13 из 15 генотипов граната, собранных в Габале. Третий кластер дендрограммы объединил 2 генотипа из Исма-иллы и генотипа из Гейчая.
Результаты кластерного анализа выявили группировку некоторых сортов в зависимости от места их сбора. Например, первый кластер представлен в основном генотипами Самухского района; преобладающее количество изученных сортов самухов (15 из 16) были объединены в первом кластере. Среди 19 генотипов, включенных во второй кластер, преобладают представители Исмаиллинского района. Все генотипы, сгруппированные в пятом кластере, были собраны из Агсу. Комбинация этих генотипов указывает на наличие сходных аллельных вариантов для большинства изученных интермикроса-теллитных локусов. В исследованиях M. Talebi с сотрудниками при анализе молекулярной вариации ISSR существенной корреляции между географическими регионами и генетической структурой изученных образцов граната не отмечали. При этом значение индекса сходства колебалось в пределах 0,291–0,930 и в среднем было равно 0,674 [24]. В нашем исследовании коэффициент жаккардового сходства варьировался от 0,03 до 1,00 со средним значением 0,77.
Заключение. Настоящее исследование показывает, что разнообразие существует в зародышевой плазме дикого граната, собранной в Азербайджане. С тех пор наблюдалось большое количество генетического разнообразия в растениях, что в дальнейшем привело к легкой адаптации растений к различным условиям окружающей среды. Исследования по молекулярному анализу различных генотипов могут также привести к установлению филогенетических отношений внутри генотипов, принадлежащих к одному или разным местам. Это также поможет понять процесс одомашнивания в ближайшем будущем.
Список литературы Изучение генетического разнообразия генотипов дикого граната (Punica granatum L.) Азербайджана с использованием маркеров ISSR
- Teixeira da Silva J., Rana T.S., Narzaryd D. et al. Pomegranate biology and biotechnology // A review. Sci. Hort. 2013. V. 160. P. 85-107.
- Al-Zoreky N.S. Antimicrobial activity of pomegranate (Punica granatum L.) fruit peels // Int J. Food Microbiol. 2009. V. 134. P. 244-8.
- Zamani Z., Sarkhosh A., Fatahi R., Ebadi A. Genetic relationships among pomegranate genotypes studied by fruit characteristics and RAPD markers // J. Hort Sci Biotechnol. 2007. V. 82. P. 11-18.
- Kazemialamuti M., Zeinalabedini M., Derazmahalleh M.M. et al. Extensive genetic diversity in Iranian pomegranate (Punica granatum L.) germplasm revealed by microsatellite markers // Sci Hort. 2012. V. 146. P. 104-114.
- Ajal E.A., Jbir R., Melgarejo P. et al. Efficiency of Inter Simple Sequence Repeat (ISSR) markers for the assessment of genetic diversity of Moroccan pomegranate (Punica granatum L.) cultivars // Biochem. Syst. Ecol. 2014. V. 56. P. 24-31.
- Aliyev R.T., Abbasov M.A., Mammadov A.C. Genetic identification of diploid and tetraploid wheat species with RAPD marker // Turk. J. Biol. 2007. V. 31. P. 173-180.
- Doyle J.L., Doyle J.J. A rapid DNA isolation procedure for small quantities of fresh leaf tissue // Phytochem. Bull. 1987. V. 19. P. 11-15.
- Hammer O., Harper D.A., Ryan P.D. Past: paleontological statistics software package for education and data analysis // Palaeontologia Electronica. 2001. V. 4. P. 1-9.
- Weir B.S. Genetic Data Analysis Methods for Discrete Genetic Data. Sunderland, MA, USA: Sinauer Assoc. Inc., 1990.
- Чесноков Ю.Ф. Оценка меры информационного полиморфизма генетического разнообразия // Сельскохозяйственная биология. 2015. Т. 5. С. 571-578.
- Roldan-Ruiz I., Dendauw J., Vanbockstaele E. et al. AFLP markers reveal high polymorphic rates in ryegrasses (Lolium spp.) // Mol. Breed. 2000. V. 6. P. 125-134.
- Yuan Z., Yin Y., Qu J., Zhu L. Population genetic diversity in Chinese pomegranate (Punica granatum L.) cultivars revealed by fuorescent-AFLP markers // J. Genet. Genom. 2007. V. 34. P. 1061-1071.
- Jbir R., Hasnaoui N., Mars M. et al. Characterization of Tunisian pomegranate (Punica granatum L.) cultivars using amplified fragment length polymorphism analysis // Sci. Hortic. 2008. V. 115. P. 231-237.
- Talebi M., Bahar M., Sharifnabi B., Yamchi A. Evaluation of genetic diversity among Iranian pomegranate (Punica granatum L.) cultivars, using ISSR and RAPD markers // Taxonomy and Biosystematics. 2011. V. 8. P. 35-44.
- Sarkhosh A., Zamani Z., Fatahi R., Ebadi A. RAPD markers reveal polymorphism among some Iranian pomegranate (Punica granatum L.) genotypes // Scientia Horti culturae. 2006. V. 111. P. 24-29.
- Omayma M.I., Rania A.A., Ibrahim A.M. Morphological and molecular evaluation of some Egyptian pomegranate cultivars // African Journal of Biotechnology. 2014. V. 13. P. 226-237.
- Zahra N., Ali F., Saeed H-R. et al. Genetic variation among Iranian pomegranates (Punica granatum L.) using RAPD, ISSR and SSR markers // Aust. J. Crop Sci. 2012. V. 6 (2). P. 268-275.
- Narzary D., Rana T.S., Ranade S.A. Molecular analysis of genetic diversity in Indian pomegranates using RAPD, DAMD and ISSR // Fruit, vegetable and cereal science and Biotechnology. 2010. V. 4. P. 126-143.
- Carvalho A., Brito J.L., Macas B., Pinto H.G. Genetic variability analysis of a collection of Old Portuguese bread wheat using ISSRs // Options Mediterraneennes. Ser. A. Sem. Medit. 2008. V. 81. P. 35-38.
- El Amine Ajal, Rania Jbir, Pilar Legua et al. Genetic diversity of Moroccan pomegranate (Punica Granatum L.) cultivars using AFLP markers // Australian Journal of Crop Science. 2015. V. 9. P. 22-29.
- Noormohammadi Z., Fasihee A., Homaee-Rashidpoor S. et al. Genetic variation among Iranian pomegranates (Punica granatum L.) using RAPD, ISSR and SSR markers // Australian Journal of Crop Science. 2012. V. 6. P. 268-275.
- Botstein D., White R.L., Skalnick M.H., Davies R.W. Construction of a genetic linkage map in man using restriction fragment length polymorphism // Am. J. Hum. Genet. 1980. V. 32. P. 314-331.
- Najaphy A., Ashrafi Parchin R., Farshadfar E. Evaluation of genetic diversity in wheat cultivars and breeding lines using inter simple sequence repeat markers // Biotechnology & biotechnological equipment. 2011. V. 25. P. 2634-2638.
- Talebi B.M., Sharifi N.B., Bahar M. Analysis of genetic diversity in pomegranate cultivars of Iran, using Random Amplified Polymorphic DNA (RAPD) markers // Proceedings of the Third National Congressof Biotechnology. 2003. V. 2. P. 343-345.


