Изучение иммунореактивности ВЛКРС-инфицированных коров на основе ПЦР-ПДРФ анализа гена ENV BLV
Автор: Якупов Т.Р., Усольцев К.В., Шангараев Р.И., Зиннатов Ф.Ф., Масленников Н.Н.
Статья в выпуске: 3 т.259, 2024 года.
Бесплатный доступ
В статье описываются результаты исследования сывороток крови методом ИФА и ПЦР-ПДРФ анализа гена env BLV в целях изучения особенностей иммунореактивности, инфицированных вирусом лейкоза крупного рогатого скота. Результаты ИФА показали, что 64.1% исследованных проб сывороток крови от ВЛКРС инфицированных коров положительно реагировали на микобактериальные антигены. Результаты сравнительного изучения данных ПЦР-ПДРФ анализа ДНК изолятов и ИФА свидетельствуют о том, что антитела против антигенов 4 генотипа ВЛКРС больше склонны проявлять перекрестные реакции с антигенами M.Avium, а антитела против 7 генотипа – с антигенами M.Bovis.
Лейкоз, антитела, ИФА, ПЦР-ПДРФ анализ, ВЛКРС, микобактерии
Короткий адрес: https://sciup.org/142242508
IDR: 142242508 | УДК: 619:616.002.5-07.636.2.9 | DOI: 10.31588/2413_4201_1883_3_259_313
Текст научной статьи Изучение иммунореактивности ВЛКРС-инфицированных коров на основе ПЦР-ПДРФ анализа гена ENV BLV
Вопросы о возможности реакций на туберкулин у скота, инфицированного с ВЛКРС и о положительной реакции в РИД у коров, инфицированных микобактериями несмотря на то, что для борьбы с этими инфекциями предлагаются самые современные высокоэффективные методики и технологии, в научной литературе остаются открытыми [1]. Встречаются утверждения разнопланового характера. Если одни выявляют прямую связь между уровнем инфицированности ВЛ КРС и реагированием животных на туберкулин, то другие утверждают, что крупный рогатый скот с диагнозом на лейкоз по гематологическим показателям, а также инфицированный ВЛ КРС, как правило, не реагируют на туберкулин [2, 3]. Причинами таких утверждений, несомненно, являются как сложная антигенная структура микобактерий, у которых выявляется множество антигенов общих для всех групп микобактерий [4, 6], так и неоднородность, перекрестная реактивность, постоянное изменение титров и спектров антител, соотношения между свободными и связанными антителами к ВЛКРС у инфицированных животных с развитием инфекционного процесса [5]. Целью данной работы было изучение иммунореактивности ВЛКРС инфицированных коров на основе ПЦР-ПДРФ анализа гена env BLV.
Материал и методы исследований. Иммуноферментный анализ ставили по стандартной методике в твердофазном неконкурентном варианте. Для обнаружения противотуберкулезных антител применяли липополисахаридные антигены M. bovis, M. avium и M. sctochromogenes.
Постановка ПЦР осуществлялась с помощью гнездовых праймеров по методике, описанной Fechner Hetal [8]. Выделение ДНК осуществлялось из осадка после центрифугирования с помощью набора «Рибо-преп» производства Интерлабсервис согласно инструкции производителя.
Для рестрикционного анализа применялись рестриктазы: PvuII, SspI, BstDEI, BamHI. Реакционная смесь на 1 реакцию – 10-ти кратный реакционный буфер – 1 мкл, рестриктаза – 1 мкл, бычий сывороточный альбумин (БСА) (100 мкг/мл) – 0,1 мкл. Программа рестрикции: для PvuII, SspI и BamHI – 37 ℃ - 1 час, 80 ℃ - 20 мин; для BstDEI – 60 ℃ - 1 час, 80 ℃ - 20 мин. Детекцию результатов проводили посредством горизонтального электрофореза в 2,5 % агарозном геле.
Результат исследований. Всего исследовано методом ИФА 300 проб сывороток крови, полученные из разных хозяйств Республики Татарстан. Все исследуемые сыворотки крови были РИД положительными 95.6 % (287) проб в ИФА на обнаружение противолейкозных антител показали положительные результаты. Все пробы положительные в
ИФА на лейкоз крупного рогатого скота были исследованы на обнаружение микобактериальных антител с использованием антигенов М. bovis, M. avium и M. sctochromogenes. В результате в 168 пробах (64,1 %) обнаружены микобактериальные антитела. В том числе 38 проб реагировали только на M. Avium, 18 – на M. Bovis и 7 – на M. Scot. Все 168 проб были в дальнейшем исследованы методом ПЦР на лейкоз (провирусная ДНК Bovine leukemia virus) и туберкулез (M. bovis). Предварительно образцы сыворотки крови были осаждены при 13000 об/мин в течение 10 мин. Выделение ДНК проводили из осадка после центрифугирования посредством набора «ДНК-сорб В» (Интерлабсервис) согласно инструкции производителя. Постановка ПЦР на лейкоз выполнялась по следующему протоколу. Приготовление ПЦР-смесей (на 1 образец) осуществляли по представленной ниже прописи: 2 мкл 10-ти кратного ПЦР-буфера, 2 мкл 2,5 мМ раствора нуклеозидтрифосфатов, 2 мкл 25 мМ раствора магния хлорида, по 1 мкл 10 рМ прямого (5’-ggcaccgggtctcgcaagtatg-3'), обратного (5'-cggttaggctggtcatgtggcc-3')
праймеров и олигонуклеотидного зонда типа TaqMan (ROX- aaacactacgacttgcaatcttacaggccgac-RTQ2) (праймеры и зонд патент RU 2644233 C2), 1 мкл Taq-полимераза (5 ед.акт./мл), 10 мкл исследуемого образца ДНК. Для идентификации M. bovis методом ПЦР-РВ были использованы праймеры
(IS1081_Forward – ggctgctctcgacgttcatc,
IS1081_Reverse - cgctgattggaccgctcat) и олигонуклеотидный зонд (IS1081_Probe – FAM-ctgaagccgacgccctgtgc-MGBNFQ), разработанные Duffy SC et al (7).
Результаты ПЦР подтвердили отсутствие в пробах генетического материала микобактерий и три пробы в ПЦР на ВЛКРС были отрицательные. Методом случайной выборки из каждой группы свороток крови отобрали по 5 проб и использовали для ПЦР-ПДРФ анализ гена envBLV. Всего 15 проб, где первые 5 – реагирующие на M.Avium, следующие 5 – на M.Bovis и на M.Scot. Детекцию результатов проводили посредством горизонтального электрофореза в 2,5 % агарозном геле (Рисунок 2 и 3).
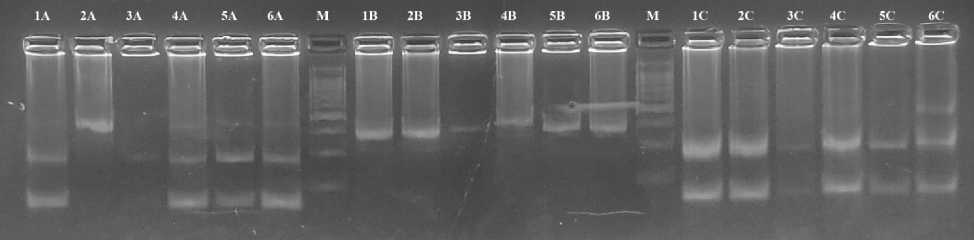
Рисунок 2 – Результаты ПЦР-ПДРФ гена env BLV . Обозначения: М – маркер молекулярного веса ДНК от 100 до 1000 пар нуклеотидов (п.н.); 1А – 6А – образцы ДНК, обработанные рестриктазой PvuII; 1B – 6B – образцы ДНК, обработанные рестриктазой SspI; 1C – 6C – образцы ДНК, обработанные рестриктазой BstDEI
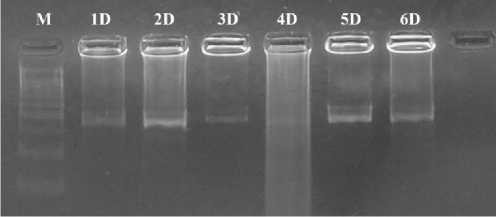
Рисунок 3 – Результаты ПЦР-ПДРФ гена env BLV . Обозначения: М – маркер молекулярного веса ДНК от 100 до 1000 пар нуклеотидов (п.н.); 1D – 6D – образцы ДНК, обработанные рестриктазой BamHI
При ПЦР-ПДРФ анализе ДНК изолятов 1-5 с использованием рестриктазы PvuI идентифицировали два паттерна размером 164 и 280 п.н., что, согласно филогенетической классификации, представленные изоляты могут иметь отношение к четвёртому генотипу. А в ДНК изолятов 6-15 обнаружен один паттерн размером 444 п.н., следовательно, данный изолят имеет отношение седьмому или восьмому генотипу.
При применении рестриктазы SspI в ДНК всех изолятов обнаруживается единичный паттерн размером от 395 до 444 п.н., что не позволяет точно определить принадлежность к тому или иному генотипу. Необходимо выполнить дополнительные исследования.
Использование рестриктазы BstDEI, которая является изошизомером эндонуклеазы DdeI, позволило определить наличие двух паттернов величиной 168 и 276 п.н. во всех исследуемых изолятах, что скорее всего относит их четвёртому или седьмому, или восьмому генотипам.
Применив рестриктазу BamHI), было обнаружено, что в первых 5 анализируемых образцах ДНК выявлен только паттерн величиной в 444 п.н., следовательно, данные изоляты вероятно всего относятся к четвёртому генотипу.
Таким образом проведенный рестрикционный анализ позволяет приблизительно заключить, что изоляты №№ 1-5 относятся к четвертому генотипу, а 6-10 к седьмому. Однако, полученные результаты желательно подтвердить дополнительными исследованиями, например, секвенированием ДНК.
Заключение. Представленные результаты исследований позволяют заключить как о возможной детерминантной общности антигенов ВЛКРС и микобактерий, так и об изменениях в иммунореактивности организма коров, инфицированных ВЛ КРС. Результаты сравнительного изучения данных ПЦР-ПДРФ анализа и ИФА ДНК изолятов свидетельствуют о том, что антитела против антигенов 4 генотипа ВЛКРС больше склонны проявлять перекрестные реакции с антигенами M. Avium, а антитела против 7 генотипа – с антигенами M. Bovis. Однако, нужно помнить, что более 100 из исследованных проб сывороток крови положительные результаты показывали в ИФА одновременно против нескольких видов микобактериальных антигенов. Причиной такой неоднородности и перекрестной реактивности безусловно, является постоянное изменение титров и спектров антител к ВЛКРС у инфицированных животных с развитием инфекционного процесса (5). А также, как отмечает Иванов О.В. (1), инфицирование организма ВЛКРС приводит к нарушению регулирования иммунной системы хозяина как на клеточном (поражение В-лимфоцитов, части Т-лимфоцитов, моноцитов), так и на гуморальном уровне (дефицит IgM, IgA).
Безусловно, для дальнейших утверждений требуются более глубокие исследования, однако, неоспоримым является то, что при проведении диагностических мероприятий на лейкоз и туберкулез крупного рогатого скота необходимо учитывать эпизоотическую ситуацию по этим инфекциям.
Список литературы Изучение иммунореактивности ВЛКРС-инфицированных коров на основе ПЦР-ПДРФ анализа гена ENV BLV
- Иванов, О. В. Качество серологической диагностики – гарантия оздоровления стада от лейкоза крупного рогатого скота / О. В. Иванов, О. Ю. Иванова // Farm Animals. – 2014. – № 3. – С. 26-29.
- Магер, С. Н. Биологическая характеристика потомства здоровых и больных лейкозом коров, и ассоциативное развитие лейкоза и туберкулеза у животных / С. Н. Магер // Автореферат дис. … док. биол. наук, Новосибирск. – 2006.
- Сорокина, А. И. Изучение влияния инфицированности вирусом лейкоза и гельминтозов на проявление аллергических туберкулиновых реакций у крупного рогатого скота / А. И. Сорокина // Автореферат дис. … канд. вет. наук, Благовещенск. – 2000.
- Якупов, Т. Р. Молекулярно- генетические и иммунохимические методы в диагностике, индикации и идентификации возбудителей туберкулеза и лейкоза крупного рогатого скота / Т. Р. Якупов // Автореферат дис. … док. вет. наук. – Казань. – 2011. – 49 с.
- Якупов, Т. Р. Новые подходы в диагностике лейкоза крупного рогатого скота / Т. Р. Якупов // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. – 2010. – Т. 204. – С. 342-347.
- Alok Choudhary. Characterization of the Antigenic Heterogeneity of Lipoarabinomannan, the Major Surface Glycolipid of Mycobacterium tuberculosis and Complexity of Antibody Specificities toward This Antigen / C. Alok, P. Deendayal, H. William [et all.] // J. Immunol. – 2018. – P. 3053-3066.
- Duffy, S. C. Development of a Multiplex Real-Time PCR Assay for Mycobacterium bovis BCG and Validation in a Clinical Laboratory.MicrobiolSpectr / S. C. Duffy, M. Venkatesan, S. Chothe [et all.] // Spectrum.01098-21. Epub. – 2021.
- Fechner, H. Provirus variants of the bovine leukemia virus and their relation to the serological status of naturally infected cattle / H. Fechner, P. Blankenstein, А. Looman [et all.] // Virology. – 1997. – P. 261-9. – doi: 10.1006/viro.1997.8784. PMID: 9356338).


