Изучение кето-енольной таутомерии пептидной связи глицилглицина при комплексообразовании с ионами металлов
Автор: Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р.
Статья в выпуске: 1 т.221, 2015 года.
Бесплатный доступ
Изучена кето-енольная таутомерия пептидной связи глицилглицина в зависимости от рН реакционной среды. Показано, что в кислой среде не идет превращение амидной группы в иминольную (енольную). В щелочной среде (рН 8,5) (при эквимолярном соотношении субстрата и щелочи) глицилглицин из кетоформы превращается в енольную форму мононатриевого производного. При последующем действии на реакционную смесь солями металлов (рН 5) енольная форма переходит в кетонную с образованием глицилглицинатов металлов в кетоформе. В сильно щелочной среде (рН 11-12) (соотношение субстрат: щелочь 1 : 2 моль) глицилглицин из кетоформы превращается в енольную форму динатриевого производного, при последующим действии на который сульфатом меди (II) получается двойной медный комплекс в енольной форме.
Пептиды, глицилглицин, комплексные соли марганца, железа, кобальта, цинка, меди, пептидная связь, таутомерия
Короткий адрес: https://sciup.org/14288517
IDR: 14288517 | УДК: 547.461.4
Текст научной статьи Изучение кето-енольной таутомерии пептидной связи глицилглицина при комплексообразовании с ионами металлов
В последние годы активно развивается фармакология физиологически активных пептидов. Выделено и изучено несколько сотен природных пептидов, которые играют самостоятельную физиологическую роль. Пептидные антибиотики синтезируются микроорганизмами, например грамицидин- S , в состав которого входят остатки аминокислот – орнитина и D -изомеры фенилаланина. Регуляторные пептиды – пептидные гормоны, регулирующие многие химические реакции в клетках и тканях организма (например инсулин, вазопрессин и др.). Интенсивно развивается учение о нейропептидах. К ним относятся пентапептиды (энкефалины), выделенные из мозга животных, которые оказывают обезболивающее действие и используются как лекарственные средства [1].
В ГУНИИ фармакологии имени В.В. Закусова РАМН созданы оригинальные нейротропные глицин- и пролинсодержащие дипептидные соединения, при комплексном исследовании которых продемонстрированы их
+NH3 - CH(R1) - CO - иммунокорригирующие свойства и противовоспалительное действие [2].
Получены высокоэффективные дипептидные лекарственные препараты: ноотроп, ноопепт, антипсихотик дилепт нейропротектор KF-2 и др. [3].
Ранее нами [4] были проведены экспериментальные исследования по изучению комплексообразующей способности дипептида глицилглицина с ионами 3 d -биогенных металлов. Показано, что комплексообразование глицилглицина с ионами металлов может идти по амино-, карбоксильной и пептидной группам в зависимости от рН реакционной среды. В оптимальных условиях синтезированы комплексонаты глицилглицина с высокими выходами [4].
Комплексообразование дипептидов с ионами биогенных металлов представляет интерес, так как позволяет моделировать биологические системы, в которых свойства белка модифицированы присоединением иона металла. Дипептиды в водном растворе существуют в виде цвиттер-ионов:
NH - CH(R2) - COO-
Пептидная (амидная) группа является р,P—сопряженной системой, в которой сопряжена с кетогрупп:
электронами л -связями
неподеленная пара электронов атома азота
.. О
NH C
Делокализация электронной плотности в пептидной группе может быть представлена резонансными структурами:
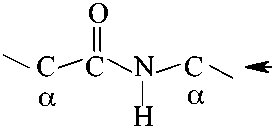
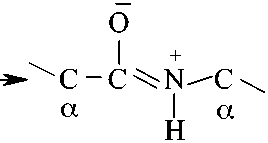
В пептидной связи за счет резонанса канонических структур простая связь С – N между углеродным атомом карбонильной группы и атомом азота NН-группы имеет характер частично двойной связи, что проявляется в уменьшении ее длины (0,132
нм) по сравнению с длиной одинарной простой связи С – N (0,147 нм). Такое сопряжение обусловливает копланарность пептидной группировки. В пептидах и белках пептидная группа находится в состоянии кето-енольной таутомерии:
_С NC = N
II II
O HOH кетоформа енольная форма
Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях. При нагревании с концентрированными кислотами или щелочами пептидов происходит гидролиз пептидных связей с образованием свободных аминокислот.
В сильно щелочной среде пептидные группы пептидов переходят из кетоформы в енольную (иминольную) форму. В избытке щелочи происходит диссоциация водорода енольной ОН-группы. При этом возникает отрицательный заряд на атоме кислорода и при взаимодействии с ионами металлов образуются соли [chem. msu. su л rus / teachind / kolman / 72htm.]. [Биохимия. Biochemistru. ru > biochimija-severind / B 5873 Part 4.].
С целью разработки физиологически активных дипептидных лекарственных препаратов, и учитывая свойства пептидной связи в кислой и щелочной средах, нами проведено изучение кето-енольной таутомерии пептидной связи глицилглицина при комплексообразовании с ионами металлов в зависимости от рН реакционной среды.
Материал и методы. Для изучения кето-енольной таутомерии пептидной связи глицилглицина при комплексообразовании были использованы следующие реактивы: глицилглицин (дипептид), содержание основного вещества 99,8 %, производства «АСROS Organics» (Бельгия); сульфаты: MnSO 4 > 5H 2 O; FeSO 4 • 7H 2 O; CuSO 4 • 5H 2 O; ZnSO 4 • 7H 2 O; CoCl • 6H 2 O и гидроксид натрия марки «х.ч.».
-
1. Общая методика синтеза глицилглицинатов марганца (II) (1) и железа (II) (2) в кислой среде. Раствор 0,0076 моль сульфатов Mn (II) или Fe (II) в 18 мл воды (рН 3) нагревают до 45-50 • С в течение 20 минут. К гомогенному гидролизату (рН 2) прибавляют по частям 0,0152 моль глицилглицина, нагревают 3035 минут до 45-50 О С (рН реакционного раствора 6,5), выдерживают в течение двух
-
2. Общая методика синтеза глицилглицината Cu (II) (3) в кислой среде. К раствору 0,0076 моль глицилглицина в 10 мл воды прибавляют 0,0038 моль сульфата меди (II), 0,00365 моль ацетата натрия и выдерживают при комнатной температуре в течение двух часов. Гомогенный раствор (рН 5) ярко синего цвета упаривают, кристаллический продукт промывают спиртом и сушат при комнатной температуре. Получают глицилглицинат меди (II) дигидрат (кристаллический продукт ярко голубого цвета) с выходом 96,60 % [4]. Продукт хорошо растворяется в воде, не растворяется в спирте, ацетоне.
-
3. Общие методики синтеза глицилглицинатов цинка, меди (II), кобальта (II)
-
3.1. Синтез глицилглицината цинка (4) . 1-стадия – щелочная среда. К раствору 0,0152 моль глицилглицината в 15 мл воды прибавляют 0,0152 моль гидроксида натрия. Наблюдается разогрев реакционной массы до 36 О С выдерживают 10 минут (рН 8,5) и нагревают до 50 о с.
-
-
3.2. Синтез глицилглицинат меди (II) (3). 1-стадия – щелочная среда. К раствору 0,0152 моль глицилглицина в 15 мл воды прибавляют 0,0152 моль гидроксида натрия. Наблюдается разогрев реакционной массы до 36 О С, выдерживают 10 минут (рН 8,5) и нагревают до 50 О С
2-стадия – кислая среда . К гомогенному раствору прибавляют 0,0076 моль сульфата меди (II) и перемешивают. Реакционную смесь (рН 5) нагревают в течение 25 минут при 55 О С охлаждают, выдерживают 2 часа при комнатной температуре и упаривают. Кристаллический остаток голубого цвета промывают спиртом и сушат при комнатной температуре. Получают глицилглицинат меди (II) дигидрат (кристаллический продукт голубого цвета с фиолетовым оттенком) с выходом 96,0 %. Продукт хорошо растворяется в воде, не растворяется в спирте, ацетоне.
-
3.3. Синтез глицилглицината кобальта (II) (5). 1-стадия – щелочная среда. К раствору 0,0076 моль глицилглицина в 10 мл воды прибавляют 0,0076 моль гидроксида натрия. Наблюдается разогрев реакционной массы до 36 о с выдерживают 10 минут (рН 8,5) и нагревают до 50 О С
2-стадия – кислая среда . К гомогенному раствору прибавляют 0,0038 моль хлорида кобальта (II) и перемешивают. Реакционную смесь (рН 5) выдерживают 15 минут при 55 о с и в течение двух часов при комнатной температуре. Получают глицилглицинат кобальта (II) дигидрат (кристаллический продукт темновишневого цвета) с выходом 97,72 %. Продукт хорошо растворяется в воде, не растворяется в спирте, ацетоне.
-
4. Комплексообразование в сильно щелочной среде (рН 11-12).
часов при комнатной температуре и упаривают. Остаток обрабатывают спиртом, кристаллизуют, сушат при комнатной температуре и получают целевые продукты с высокими выходами (глицилглицинат Mn (II) дигидрат – 95,0 %, глицилглицинат Fe (II) дигидрат – 98,0 %[4]). Продукты хорошо растворяются в воде, не растворяются в спирте и ацетоне.
2-стадия – кислая среда. К гомогенному раствору прибавляют по частям 0,0076 моль сульфата цинка и перемешивают. Через 10 минут выпадает белый осадок. Реакционную смесь (рН 5) выдерживают 30 минут при 50 ОС в течение одного часа при комнатной температуре и охлаждают. Осадок фильтруют, промывают водой (контроль на сульфаты с BaCl2), спиртом и сушат при комнатной температуре. Получают глицилглицинат цинка дигидрат (кристаллический продукт белого цвета) с выходом 94,5 %. Продукт не растворяется в воде, спирте, ацетоне.
Синтез двойного комплекса глицилглицината меди (II) (6). К раствору 0,0152 моля глицилглицина в 15 мл воды прибавляют 0,034 моля гидроксида натрия. Наблюдается разогрев реакционной массы до 40 ОС, выдерживают 10 минут (рН 11-12) и нагревают до 50 ос. к гомогенному раствору присыпают по частям 0,0152 моль сульфата меди (II) и перемешивают. Реакционную смесь (рН 10) нагревают в течение 30 минут при 55 ОС охлаждают, выдерживают 2 часа при комнатной температуре и упаривают. Получают двойной комплекс глицилглицината меди (II) – ди-(глицилглицинат)-дикупрат (кристаллический продукт темнофиолетового цвета) с выходом 93,75 %. Продукт с трудом растворяется в воде при комнатной температуре, не растворяется в спирте, ацетоне.
Результаты исследования. Комплексообразование глицилглицина с ионами 3 d -биогенных металлов основана на взаимодействии субстрата с гидроксидами данных металлов. Технология процесса определяется растворимостью, устойчивостью образующихся гидроксидов в реакционной среде.
Гидроксиды марганца (II), железа (II) хорошо растворяются в кислой среде и не подвергаются окислению, в щелочной среде – нерастворимы и быстро окисляются до гидроксидов металлов (III).Для образования Mn(OH) 2 и Fe(OH) 2 нами использован процесс гидролиза соответствующих сульфатов при рН 2 реакционной смеси [4]. При действии на гомогенный водный гидролизат (рН 2), содержащий гидроксиды Me(II), глицилглицином реакция комплексообразования с ионами Mn2+, Fe2+ протекает в кислой среде по амино- и карбоксильной группам и не идет по пептидной группе. Реакция глицилглицина с ионами Сu2+ (реагенты сульфат меди и ацетат натрия [5]) при рН 5 идет по аналогичной схеме:
Схема комплексообразования глицилглицина в кислой среде:
t o C
MeSO4 + 2HOH Me(OH)2 + H2SO4
2NH CH C N CH COOH +
2 2 2 рН < 7
ОН
[NH CH C N CH COO ] Ме
( H 2 O) 2 2 2 2
ОН
(1 3)
где Me2+ : Mn2+ (1); Fe2+(2) ; Cu2+(3) Комплексообразование глицилглицина с ионами Zn2+ и Со2+ проводится действием на реакционный раствор субстрата и гидроксида натрия солями соответствующих металлов. На первой стадии процесса идет взаимодействие глицилглицина с гидроксидом натрия (при эквимолярном соотношении) с образованием мононатриевой соли по карбоксильной группе субстрата при рН (8,5) [6] и превращение пептидной группы из кетоформы в енольную форму. На второй стадии при добавлении в щелочной раствор реакционной смеси солей металлов происходит образование гидроксидов Me(II) и их взаимодействие с енольной формой мононариевой соли глицилглицина при рН 5 реакционной среды.
На второй стадии в реакционной смеси протекают следующие превращения реагентов, соответственно:
ZnSO 4 ° 7H 2 O + 2NaOH • Zn(OHh + Na 2 SO 4 + 7H 2 O ZnSO 4 + 2H 2 O ^ Zn(OH) 2 + 2H+ + SO
2 -
C0CI 2 6H 2 O + 2NaOH ^ Co(OH) 2 + NaCl + 6H 2 O
C0CI 2 + 2H 2 O ^ Co(OH) 2 + 2H+ + 2
-
Ñl
В результате указанных превращений среда становится кислой (рН 5).
При переходе рН среды в кислую область (от 8,5 до 5) комплексонаты глицилглицина цинка (II) и кобальта (II) получаются в кетонной форме, т. е. протекает кето-енольная таутомерия в две стадии по схеме:
1-стадия
+ NaOH
NH2 CH2 C N CH2COOH NaO NH2 CH2 C = N CH2COONa
2 2 2 p H > 7 2 2 2
O H ( H2O) OH кетоформа енольная форма
2-стадия
+ Me(OH)2 (H+) pH < 7
2NH2 CH2 C = N CH2COONa енольная
OH форма
[NH2 CH2 C NH CH2 COO ]2Me
O кетоформа где Me2+: Zn2+ (4), Со2+ (5)
Глицилглицинат меди (II) (3), полученный указанным способом (методика 3.2) имеет фиолетовый оттенок (в отличие от продукта (3) по способу 2), что связано с наличием примеси биуретового медного комплекса.
В сильнощелочной среде (рН 11-12) комплексообразование глицилглицина с
ионами меди (II) протекает через енольную форму динатриевой соли глицилглицина [6]. В результате реакции получается двойной медный комплекс: первый – по карбоксильной и аминной группам, второй – по иминольной группе (биуретовый комплекс), ди-(глицилглицинат)-дикупрат (6).
Схема превращения
NH2 CH2 C N CH2 COOH 22 2
O H кетоформа 1-стадия
+ 2 NaOH(pH 11-12)
( 2H 2 O)
+ 2 CuSO
NH2 CH2 C = N CH2COONa 4>
I ( Na2So4)
ONa2-стадия енольная форма
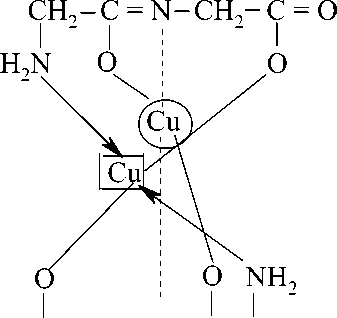
O = C CH2 N = C CH2
Двойной комплекс – кристаллический высокоплавкий продукт темно-фиолетового цвета. В водном растворе (в воде растворяется с трудом) ионы Cu2+ с К 4 [Fe(CN) 6 ] образуют осадок красно-бурого цвета Cu 2 [Fe(CN) 6 ] (качественная реакция).
Биуретовая реакция обусловлена наличием в белках и пептидах пептидной связи, которая в щелочной среде превращается из кетоформы (амидной) в иминольную форму и с сульфатом меди (II) образует биуретовый комплекс фиолетового цвета. [Studopedia ru > 1 …Biuretovaja…na peptidnuy – svuaz…v; Википедия – пептидная связь].
Глицилглицинаты меди (II) (3), цинка (4), кобальта (II) (5) дают качественную биуретовую реакцию на пептидную связь в щелочной среде (рН 8,5) с сульфатом меди (II). В этих условиях глицилглицинаты марганца (II) (1), железа (II) (2) образуют цветные осадки соответствующих гидроксидов, которые маскируют характерное фиолетовое окрашивание
ЛИТЕРАТУРА: 1. Комов В.П., Шведова В.Н. Биохимия. – М.: Дрофа, 2004. с. 26-28;
2. Щипаева Е.В. Иммунофармакологические свойства глицин- и пролинсодержащих дипептидов: Автореф…диссерт…канд. мед. наук. – Москва: ГУНИИ фармакологии им. В.В. Закусова РАМН. 2008.; 3. Гудашева Т.А. Стратегия создания дипептидных лекарств. / Инновации в современной фармакологии. Тез. докл. IV съезда фармакологов России. – Казань. 18-21.09.2012.; 4. Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р. Изучение комплексообразующей способности глицилглицина с 3 d -биогенными металлами. // Ученые записки КГАВМ им. Н.Э, Баумана. – Казань, 2014. – т. 218, с. 102-110.; 5. Гранберг И.И Практические работы и семинарные занятия по органической химии. – М.: Дрофа, 2001. – 352с.; 6. Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р. Изучение реакции взаимодействия глицилглицина с гидроксидами щелочных и щелочноземельных металлов. // Ученые записки КГАВМ им. Н.Э. Баумана. – Казань, 2014. – с. 110-117.
биуретового комплекса.
Заключение. Изучена кето-енольная таутомерия пептидной связи глицилглицина в зависимости от рН реакционной среды.
Показано, что в кислой среде не идет превращение амидной группы в иминольную (енольную). В щелочной среде (рН 8,5) (при эквимолярном соотношении субстрата и щелочи) глицилглицин из кетоформы превращается в енольную форму мононатриевого производного. При последующем действии на реакционную смесь солями металлов (рН 5) енольная форма переходит в кетонную с образованием глицилглицинатов металлов в кетоформе. В сильно щелочной среде (рН 11-12) (соотношение субстрат: щелочь 1 : 2 моль) глицилглицин из кетоформы превращается в енольную форму динатриевого производного, при последующим действии на который сульфатом меди (II) получается двойной медный комплекс в енольной форме.
ИЗУЧЕНИЕ КЕТО-ЕНОЛЬНОЙ ТАУТОМЕРИИ ПЕПТИДНОЙ СВЯЗИ ГЛИЦИЛГЛИЦИНА ПРИ КОМПЛЕКСООБРАЗОВАНИИ С ИОНАМИ МЕТАЛЛОВ
Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р.
Резюме
Изучена кето-енольная таутомерия пептидной связи глицилглицина в зависимости от рН реакционной среды.
Показано, что в кислой среде не идет превращение амидной группы в иминольную (енольную). В щелочной среде (рН 8,5) (при эквимолярном соотношении субстрата и щелочи) глицилглицин из кетоформы превращается в енольную форму мононатриевого производного. При последующем действии на реакционную смесь солями металлов (рН 5) енольная форма переходит в кетонную с образованием глицилглицинатов металлов в кетоформе. В сильно щелочной среде (рН 11-12) (соотношение субстрат: щелочь 1 : 2 моль) глицилглицин из кетоформы превращается в енольную форму динатриевого производного, при последующим действии на который сульфатом меди (II) получается двойной медный комплекс в енольной форме.
KETO-ENOL GLYCYLGYCINE PEPTIDE BOND TAUTOMERISMSTUDY AT COMPLEXATION WITH METAL IONS
Kadyrova R.G., Kabirov G.F., Mullakhmetov R.R.
Список литературы Изучение кето-енольной таутомерии пептидной связи глицилглицина при комплексообразовании с ионами металлов
- Комов В.П., Шведова В.Н. Биохимия. -М.: Дрофа, 2004. с. 26-28;
- Щипаева Е.В. Иммунофармакологические свойства глицин-и пролинсодержащих дипептидов: Автореф…диссерт…канд. мед. наук. -Москва: ГУНИИ фармакологии им. В.В. Закусова РАМН. 2008.;
- Гудашева Т.А. Стратегия создания дипептидных лекарств.//Инновации в современной фармакологии. Тез. докл. IV съезда фармакологов России. -Казань. 18-21.09.2012.;
- Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р. Изучение комплексообразующей способности глицилглицина с 3d-биогенными металлами.//Ученые записки КГАВМ им. Н.Э, Баумана. -Казань, 2014. -т. 218, с. 102-110.;
- Гранберг И.И. Практические работы и семинарные занятия по органической химии. -М.: Дрофа, 2001. -352с.;
- Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р. Изучение реакции взаимодействия глицилглицина с гидроксидами щелочных и щелочноземельных металлов.//Ученые записки КГАВМ им. Н.Э. Баумана. -Казань, 2014. -с. 110-117.


