Изучение клинической и патоморфологической картины при остром токсическом гепатите на фоне применения биодобавки
Автор: Домбровский В.О., Матросова Л.Е., Губеева Е.Г., Танасева С.А., Тарасова Е.Ю.
Статья в выпуске: 3 т.251, 2022 года.
Бесплатный доступ
В ходе гистологического исследования крыс, получавших тетрахлорметан и «Карсил», выявлены признаки очаговой жировой дистрофии гепатоцитов, зернистой дистрофии с некробиозами, некрозами вокруг центролобулярных вен, паретическое полнокровие, эритростазы, отек стенок сосудов. У крыс, которые получали тетрахлорметан и БАД, изменения структуры были наименее выраженными.
Печень, гепатит, гепатопротекторы, тетрахлорметан, биодобавка
Короткий адрес: https://sciup.org/142235681
IDR: 142235681 | УДК: 619:616.36-002:619:615.4 | DOI: 10.31588/2413_4201_1883_3_251_102
Текст научной статьи Изучение клинической и патоморфологической картины при остром токсическом гепатите на фоне применения биодобавки
Оптимизация процессов производства продукции на животноводческих предприятиях нашей страны принесла большое количество новых обменных патологий сельскохозяйственных животных [5]. Печень является одним из центральных органов метаболизма, который, сохраняя динамическое постоянство внутренней среды, принимает самое активное участие в устранении последствий различных заболеваний. Не существует такого звена обмена веществ в организме, которое так или иначе не было бы связано с процессами, протекающими в печени [10, 11]. Нарушение работы печени – одна из наиболее частых патологий, встречающихся на производстве. Гепатопатологии наносят колоссальный экономический ущерб, что связано с падежом животных, снижением их продуктивности, воспроизводительной способности, резистентности, развитием на этом фоне многих инфекционных и незаразных болезней [2, 3, 12].
Основной группой лекарственных препаратов для лечения болезней печени, связанных с патологией обмена веществ, являются гепатопротекторы. Данные препараты препятствуют разрушению мембран клеток и стимулируют регенерацию гепатоцитов [5]. Поэтому разработка новых гепатопротективных средств и биодобавок является перспективной целью для отечественной фармакологии [1, 8, 9, 13].
Доклинические исследования перспективных гепатопротективных лекарственных средств проводятся на классической модели токсического гепатита, вызванного внутрижелудочным или интраперитонеальным введением 50 % масляного раствора тетрахлорметана [7]. Этот гепатотоксин оказывает прямое повреждающее действие на печень посредством образования ковалентных связей с клеточными макромолекулами, что, в свою очередь, приводит к выраженному повреждению мембран гепатоцитов, активации процессов липопероксидации, дисбалансу в работе ферментативного звена антиоксидантной системы организма, нарушению метаболизма липидов, белков, углеводов [4].
Материал и методы исследований. Опытная часть исследований была выполнена на базе отделения токсикологии ФГБНУ «ФЦТРБ-ВНИВИ» (г. Казань). Для моделирования токсического гепатита печени использовали тетрахлорметан в дозе 0,4 мл/кг, вводили внутрибрюшинно. Эксперименты проведены на 24 белых крысах, разделенных по принципу аналогов на 4 группы. Биологическим контролем служили животные первой группы. Белые крысы второй, третьей и четвертой групп получали внутрибрюшинно тетрахлорметан в 50 % растворе на оливковом масле в дозе 0,4 мл/кг однократно. Подопытным животным третьей и четвертой групп на фоне затравки задавали препараты. Животные третьей группы получали коммерческий препарат «Карсил» (100 мг/кг внутрижелудочно один раз в сутки). Четвертая группа получала биодобавку на основе шрота расторопши, янтарной кислоты, бентонита, пробиотического штамма B. subtilis, витаминов А и Е. Лечение препаратами продолжалось в течение 14 суток.
По окончании лечения животные были подвергнуты декапитации под эфирным наркозом. Вскрытие проводилось по общепринятой методике. Была проведена визуальная оценка внутренних органов, а также забор материала на гистологическое исследование печени. Кусочки органов фиксировали в 10 % нейтральном формалине, проводку проводили общепринятыми в патоморфологии методами. Гистопрепараты окрашивали гематоксилин-эозином. Микрофотосъемку гистологических препаратов осуществляли в проходящем свете с помощью микроскопа Leica DM 1000, камера Leica DFC 320 («Leica Microsystems», Япония).
Результат исследований. В группе крыс, получавших тетрахлорметан без лечения, уже на третьи сутки эксперимента наблюдалось угнетение, частичный отказ от приема корма, взъерошенность кожного покрова. К концу эксперимента большая часть животных была сильно истощена, дегидратирована.
У группы, получавшей помимо тетрахлорметана «Карсил», клиническая картина проявилась на седьмые сутки угнетением и снижением тургора кожи.
У животных, получавших на фоне введения тетрахлорметана биодобавку, клиническая картина не проявлялась.
При вскрытии у всех подопытных, получавших тетрахлорметан без лечения, наблюдалась иктеричность слизистых оболочек, гепатомегалия, очаговые кровоизлияния под капсулой печени, сама печень была тестоватой консистенции. Из группы, получавшей «Карсил», только у двух из шести крыс наблюдалась желтушность слизистых оболочек, у одной наблюдались очаговые кровоизлияния под капсулой печени. В остальных группах при осмотре внутренних органов визуальные изменения не обнаружены.
Гистологическая картина печени у животных группы биологического контроля соответствовала картине нормальной печени, сохранена структура печеночных долек без деструкции гепатоцитов (Рисунок 1).
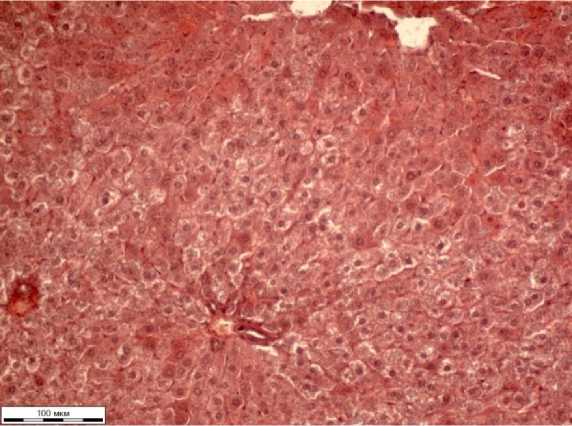
Рисунок 1 – Печень белой крысы группы биологического контроля, окраска гематоксилином
Эрлиха и эозином водным, объектив Х20
У животных четвертой группы были выявлены общие изменения в виде неравномерного кровенаполнения сосудов. Стенки венозных сосудов были тонкие.
При этом толщина стенок, как на поперечном срезе, так и на продольном срезе могла различаться, имелись еще более истонченные участки. Сами стенки были окрашены в мутноватый эозинофильный цвет. Артерии во всех препаратах имели утолщенные стенки, ядра эндотелия не на всем протяжении среза. Однако ядра, которые были видны, различались формой и цветом, некоторые были гиперхромные, округлые, другие – «сплюснутые» бледные. В перипортальных трактах определялась инфильтрация лимфоцитами, гистиоцитами. Во всех препаратах синусоиды были заполнены гомогенными эозинофильными массами неравномерно с участками скоплений, местами выглядели как сдавленные. Здесь же определялись единичные лимфоциты и деформированные, вытянутые Купферовские клетки. Гепатоциты были более крупные, чем в контроле, а некоторые почти в два раза. Цитоплазма гепатоцитов имела неравномерную эозинофильную «мутную» окраску. В некоторых клетках определялись участки пустот и фрагменты цитоплазмы в виде зерен. В других гепатоцитах определялись круглые, мелкие оптические пустотки. Также обращало на себя внимание строение ядер клеток. В некоторых они были увеличены, неравномерно окрашены, зернистые, базофильные. В отдельных гепатоцитах не определялись ядра. Наиболее выраженные изменения гепатоцитов наблюдались вокруг центральной вены. Строение балок в дольках было нарушено (Рисунок 2).
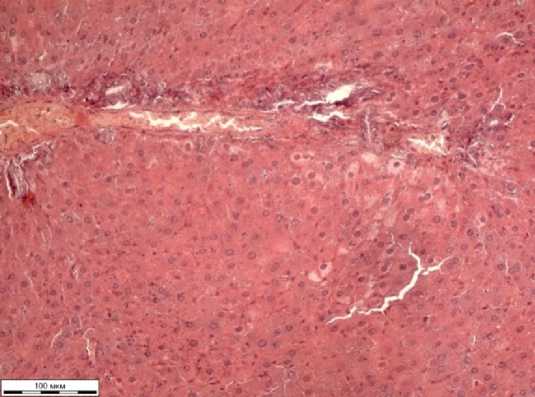
Рисунок 2 – Печень белой крысы группы токсического контроля, окраска гематоксилином Эрлиха и эозином водным, объектив Х20
В ходе гистологического исследования крыс, получавших «Карсил», наблюдались выраженные изменения структуры. Вены и артерии были расширены, заполнены эритромассами с признаками агрегации эритроцитов. Стенки артерий были неравномерно утолщены, вены тонкие. Гепатоциты неравномерно увеличенные, некоторые набухшие. В цитоплазме многих гепатоцитов определялись мелкие круглые пустоты. В других имелись просветления цитоплазмы и зернистые массы. Ядра гепатоцитов были разного размера, некоторые увеличенные, другие мельче, чем в контроле. Имелось неравномерное окрашивание ядер с гиперхромным глыбчатым хроматином. Синусоиды были сдавлены, неравномерно заполнены эозинофильными гомогенными массами. Встречались единичные лимфоциты и Купферовские клетки, которые были деформированными. Единичные гепатоциты были без ядер, располагались они преимущественно вокруг центролобулярных вен. Балочные структуры были плохо различимы (Рисунок 3).
У крыс, которые получали тетрахлорметан и БАД, также были выявлены расширенные сосуды, заполненные эритромассами. Стенки артерий были несколько утолщены, эндотелий преимущественно с круглыми ядрами. Строение долек было сходно с группой биологического контроля. В цитоплазме гепатоцитов определялись оптические пустоты и зернистые эозинофильные массы. У всех крыс определялись единичные безъядерные гепатоциты (Рисунок 4).
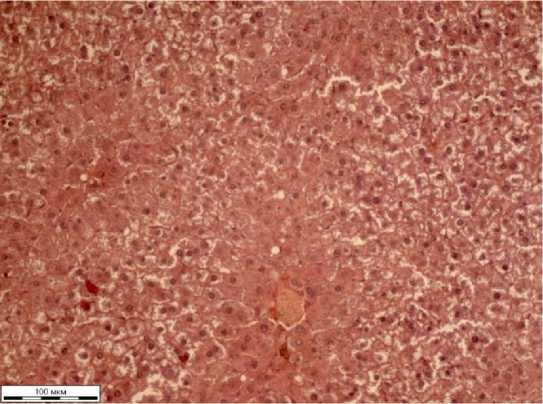
Рисунок 3 – Печень белой крысы третьей группы, окраска гематоксилином Эрлиха и эозином водным, объектив Х20
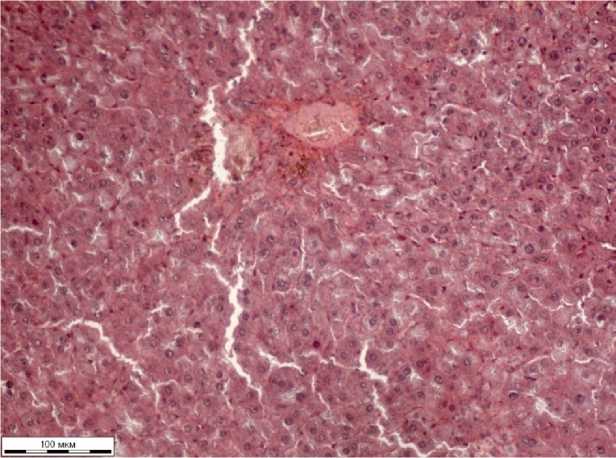
Рисунок 4 – Печень белой крысы четвертой группы, окраска гематоксилином Эрлиха и эозином водным, объектив Х20
Заключение. При гистологическом исследовании препаратов печени крыс группы токсического контроля выявлены признаки нарушения сосудистого тонуса, отек стенок сосудов, деформация эндотелия артерий и вен, слабо выраженная мелкокапельная жировая дистрофия и зернистая дистрофия с некробиозами, некрозами, сдавление синусоидов, деформация Купферовских клеток.
У крыс, получавших тетрахлорметан и «Карсил», в печени выявлены признаки очаговой жировой дистрофии гепатоцитов, зернистой дистрофии с некробиозами, некрозами вокруг центролобулярных вен, паретическое полнокровие, эритростазы, отек стенок сосудов.
У крыс, которые получали тетрахлорметан и БАД, изменения структуры печени были наименее выраженными. Наблюдались признаки очаговой зернистой дистрофии, некробиозы и некрозы единичных гепатоцитов.
Печень белых крыс из группы, получавших БАД, имела наименее значимые изменения. Это свидетельствует о достаточно высокой эффективности биодобавки.
В ходе гистологического исследования крыс, получавших тетрахлорметан и «Карсил», выявлены признаки очаговой жировой дистрофии гепатоцитов, зернистой дистрофии с некробиозами, некрозами вокруг центролобулярных вен, паретическое полнокровие, эритростазы, отек стенок сосудов. У крыс, которые получали тетрахлорметан и БАД, изменения структуры были наименее выраженными.
Список литературы Изучение клинической и патоморфологической картины при остром токсическом гепатите на фоне применения биодобавки
- Абрамов, А. А. Изучение токсических свойств нового инъекционного гепатопротектора в остром эксперименте / А. А. Абрамов, М. Н. Семененко, В. В. Меньшенин // Сборник научных трудов СКНИИЖ. -Краснодар, 2018. - С. 160.
- Абрамов, А. А. Определение гепатозащитной активности препарата филовектин на модели острой патологии печени у лабораторных животных / А. А. Абрамов // Сборник научных трудов СКНИИЖ. - Краснодар, 2021. - С. 294.
- Ермолаева, О. К. Качество мяса свиней при микотоксикозе на фоне применения энтеросорбентов / О. К. Ермолаева, С. А. Танасева, Л. Е. Матросова, Е. Ю. Тарасова, Э. И. Семенов // Ветеринарный врач. -2020. - № 4. - С. 15-20.
- Ерютин, А. В. Сравнительный анализ токсического гепатита, вызванного внутрижелудочным и интраперитонеальным введением раствора тетрахлорметана / А. В. Ерютин, М. Э. Филь, М. А. Шилова [и др.] // Journal of Siberian Medical Sciences. - 2016. - 5. -С. 8.
- Кузьминова, Е. В. Перспективы расширения спектра применения гепатопротекторов в ветеринарии / Е. В. Кузьминова, М. П. Семененко, Е. А. Старикова [и др.] // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2014. - № 102. - С. 787-797.
- Минушкин, О. Н. Гепатопротекторы в лечении некоторых заболеваний печени / О. Н. Минушкин // Медицинский совет. - 2016. - № 14. - С. 52.
- Миронов, А. Н. Руководство по проведению доклинических исследований лекарственных средств / Под ред. А. Н. Миронова. - Москва: Гриф и К, 2012. - 944 с.
- Мишина, Н. Н. Обоснование введения в рацион животных комбинации сорбентов неорганической и органической природы при Т-2 токсикозе / Н. Н. Мишина, Э. И. Семенов, К. Х. Папуниди [и др.] // Ветеринарный врач. - 2019.- № 2. - С. 3037.
- Танасева, С. А. Эффективность адсорбентов при сочетанном микотоксикозе цыплят-бройлеров / С. А. Танасева, Е. Ю. Тарасова, Л. Е. Матросова [и др.] // Международный вестник ветеринарии. - 2020. - № 4. - С. 5056.
- Тарасова, Е. Ю. Изучение сорбционной активности потенциальных средств профилактики микотоксикозов в отношении афлатоксинов / Е. Ю. Тарасова, Э. И. Семенов, Л. Е. Матросова [и др.] // В етер инарный врач - 2020. - № 2. - С. 5158.
- Тяпкина, Е. В. Влияние биологически активных соединений на метаболические функции печени / Е. В. Тяпкина, О. А. Фомин // Молодой ученый. - 2015. - № 7. - С. 1048.
- Семенов, Э. И. Методические рекомендации по диагностике, профилактике и лечению микотоксикозов животных / Э. И. Семенов, М. Я. Тремасов, К. Х. Папуниди [и др.]. -Росинформагротех, 2017. - 67 с.
- Matrosova, L. E. Enterosorbent efficiency mineral attenuation during pig mycotoxicosis / L. Е. Matrosova, N. N. Mishina, S. A. Tanaseva [et al.] // International Journal of Mechanical and Production Engineering Research and Development. - 2020. - V. 10. - P. 1851.


