Изучение маркеров апоптоза, пролиферации и ангиогенеза у больных раком яичника, получивших сопроводительную иммунотерапию
Автор: Камышов Сергей Викторович, Нишанов Донир Анарбаевич, Пулатов Донир Анварович, Юлдашева Наргиза Шавкатовна
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 1 (22), 2017 года.
Бесплатный доступ
Целью работы явилось изучение ряда молекулярно-биологических маркеров опухоли в качестве критериев выбора методов сопроводительной экстракорпоральной иммунофармакотерапии (ЭИФТ) у больных раком яичника (РЯ). Объектом исследования служили 30 больных РЯ с II-III клиническими стадиями заболевания, проходивших лечение в онкогинекологическом отделении РОНЦ МЗ РУз с 2009 по 2011 гг. и получивших стандартное комбинированное лечение. У большей части больных РЯ (у 83,3, 86,7 и 80,0% соответственно) присутствовали молекулярно-биологические маркеры p53, VEGF и Ki-67. В то же время, маркеры HER-2/neu и EGFR обнаруживались у 20,0 и 30,0% пациенток соответственно. Показано, что наибольшей прогностической значимостью в отношении эффективности лечения больных РЯ обладают онкомаркеры p53, VEGF и Ki-67, а также уровень пролиферативной активности (ПА) опухоли. Наибольший эффект в увеличении 5-летней выживаемости пациенток оказывала схема сопроводительной иммунотерапии, включающая ЭИФТ с плазмаферезом. Положительный уровень окомаркеров p53, VEGF и Ki-67 у больных РЯ наряду с высокой ПА опухоли могут служить основанием для проведения данной категории пациенток сопроводительной иммунотерапии с ЭИФТ. В случае положительных значений всех рассмотренных молекулярно-биологических факторов, мы рекомендуем проведение сопроводительной ЭИФТ с плазмаферезом, что может существенно увеличить эффективность стандартных схем противоопухолевого лечения.
Рак яичника (ря), экстракорпоральная иммунофармакотерапия (эифт), молекулярно-биологические маркеры опухоли: p53, пролиферативная активность опухоли
Короткий адрес: https://sciup.org/140223031
IDR: 140223031 | DOI: 10.18027/2224-5057-2017-1-84-90
Текст научной статьи Изучение маркеров апоптоза, пролиферации и ангиогенеза у больных раком яичника, получивших сопроводительную иммунотерапию
Злокачественные опухоли яичника – одна из актуальных проблем в клинической онкологии. По данным Международного агентства по изучению рака, ежегодно в мире регистрируется более 192 тыс новых случаев рака яичника (РЯ) и более 114 тыс женщин умирают от злокачественных опухолей яичника [1, 2].
Химиотерапия наряду с хирургической операцией является одним из основных компонентов лечения РЯ. Однако различные побочные эффекты лечения, связанные с её токсическим воздействием на организм больной, заставляют исследователей искать пути их снижения, в том числе с помощью методов иммунотерапии [3].
Прогноз больных РЯ зависит от ряда клинических, морфологических, иммунологических и молекулярно-биологических факторов. Ведущими клиническими факторами являются стадия заболевания и стратегия лечения больных. Наряду с этим прогноз заболевания сопряжен с особенностями биологических свойств опухоли. Расширение знаний о молекулярных маркерах и изучение их экспрессии поможет прогнозировать течение заболевания. Большое внимание уделяется изучению степени амплификации генов и экспрессии соответствующих рецепторов и белков, характеризующих апоптоз, пролиферацию клетки и ангиогенез. Характеризуя биологические особенности каждой конкретной опухоли, молекулярные маркеры могут помочь в прогнозировании исхода заболевания и в индивидуализации лекарственного лечения [4, 5, 6].
За последние годы достигнуты успехи в исследовании иммунологии и иммунотерапии рака, в том числе злокачественных опухолей женской репродуктивной системы. Однако до сих пор не выработаны критерии выбора иммунологических методов, а также недостаточно изучена их эффективность у больных РЯ [7, 8].
Белок p53, являясь продуктом гена-супрессора опухоли TP53, экспрессируется во всех клетках организма. При отсутствии повреждений генетического аппарата белок р53 находится в неактивном состоянии, а при появлении повреждений ДНК активируется. Результатом активации p53 является остановка клеточного цикла и репликации ДНК; при сильном стрессовом сигнале – запуск апоптоза.
Нарушения механизма развития апоптоза могут наступать тогда, когда ключевой ген этого процесса р53 теряет свою функцию. Это может наступить в результате мутации гена р53 с образованием мутантного онкопротеина – mut-р53, что наблюдается в условиях патологии или в результате блокады р53 другими протеинами, к которым, в первую очередь, относится Bcl-2. Увеличение экспрессии мутированного p53 в опухоли сопровождается его большей агрессивностью, поскольку уменьшается количество опухолевых клеток, подвергающихся апоптозу. При РЯ, по данным разных исследователей, мутантный р53 обнаруживается более чем у половины больных уже на ранних этапах заболевания [9].
Одним из наиболее изученных показателей агрессивности опухолевого роста является клеточная пролиферация, которая может быть оценена с помощью митотического индекса и индекса Ki-67. Антиген Ki-67 экспрессируется практически во всех фазах митотического цикла, и в соответствии с этим отражает пролиферативный пул опухоли. Пролиферативный индекс Ki-67 рассматривается как независимый прогностический показатель возникновения рецидива, общей и безрецидивной выживаемости, предсказательный фактор для определения чувствительности к химиотерапии (ХТ) и лучевой терапии (ЛТ). Индекс Ki-67 позволяет оценить степень злокачественности опухоли и прогнозировать течение заболевания в совокупности с другими факторами. Показано, что высокий уровень индекса Ki-67 сопряжен с неблагоприятным прогнозом. В частности, при высоком уровне Ki-67 отмечается ухудшение показателей безрецидивной и общей выживаемости больных раком молочной железы, яичника, толстой кишки, мочевого пузыря, саркомах мягких тканей и др. При злокачественных опухолях яичника в большинстве случаев выявляется высокий уровень экспрессии Ki-67 [3]. В некоторых работах, посвященных РЯ, показано, что амплификация HER-2/neu, встречающаяся в 10–50%, указывает на неблагоприятный прогноз течения заболевания [10]. Однако существуют и противоположные данные, поэтому практическая значимость HER-2/neu-тестирования остается на сегодня дискутабельной [11, 12]. В последнее время выяснилось, что некоторые муцинозные карциномы яичника имеют амплификацию гена HER2/neu и гиперэкспрессию его белка [13, 14]. В недавно опубликованных результатах геномного анализа 50 образцов светлоклеточного рака яичника показано наличие амплификации HER2/neu в 14% случаев [15]. Получается, что при редкой частоте гиперэкспрессии HER2/neu и амплификации его гена в общей группе карцином яичника в подгруппе муцинозных и светлоклеточных карцином этот рецептор встречается значительно чаще.
Рецептор эпидермального фактора роста EGFR является трансмембранным гликопротеином, локализующимся на хромосоме 7р12. EGFR функционирует через димеризацию, активируя тирозинкиназу, участвуя в регуляции нормальной и неопластической клеточной пролиферации. Семейство рецепторов EGFR состоит из 4 членов: EGFR/ ErB1/HER1, ErbB2/Neu/HER2, ErB3/HER3 и ErB4/HER4. В нормальных физиологических условиях активация HER-рецепторов контролируется временной невысокой экспрессией их лигандов. При трансформации клеток наблюдается гиперэкспрессия этих белков и увеличение количества рецепторов на поверхности клеток. EGFR присутствует во многих нормальных тканях и выраженная экспрессия наблюдается в солидных опухолях. Согласно данным литературы, экспрессия EGFR наблюдается примерно в 40% злокачественных опухолей ЖКТ, легкого, яичников, матки [16, 17, 18].
Основным активатором ангиогенеза считают фактор роста эндотелия сосудов (VEGF), ответственный за пролиферацию и миграцию эндотелиальных клеток, а также имеющий непосредственное отношение к инвазии и метастазированию опухоли. Накоплены данные, подтверждающие участие VEGF и эпидермального фактора роста (EGF) в построении сосудистого русла, росте и прогрессии злокачественных новообразований. Причем взаимодействие этих лигандов с трансмембранными тирозинкиназными рецепторами рассматривают как важнейший аутокринный путь промоции опухоли. При РЯ различные исследователи отмечают высокую экспрессию VEGF [19, 20].
Таким образом, определение индивидуального профиля онкомаркеров у больных РЯ может способствовать более точному представлению о развитии заболевания и прогнозу об эффективности проводимого лечения, а также необходимости проведения сопроводительной иммунотерапии.
ЦЕЛЬ
Целью работы явиляется изучение ряда молекулярно-биологических маркеров опухоли в качестве критериев выбора методов сопроводительной иммунотерапии у больных РЯ.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили 30 больных РЯ с II– III клиническими стадиями заболевания, проходивших лечение в онкогинекологическом отделении РОНЦ МЗ РУз с 2009 по 2011 гг. и получивших стандартное комбинированное лечение.
Всем больным РЯ выполнялась комбинированная терапия в неоадъювантном режиме, включающая ПХТ по схеме
В 1-й (контрольной) группе больных иммунотерапию не проводили (табл. 1).
Во 2-й группе больным РЯ проводили ЭИФТ путем эксфузии 200–250 мл аутокрови в стерильные контейнеры «Ге-макон» или «Терумо», инкубацией с иммуномодулятором тималином в суммарной дозе 30 мг (за 3 процедуры) при 37 ° С в течение 60-100 мин с последующей реинфузией полученного конъюгата.
В 3-й группе пациенток применяли метод ЭИФТ, который являлся расширением возможностей плазмафереза. Осуществляли эксфузию 500–1000 мл аутокрови в стерильные контейнеры «Гемакон» или «Терумо», затем проводили ее центрифугирование при 3000 об/мин в течение 30 мин. Удаляли 50–80 мл надосадочного слоя плазмы крови, содержащего антитела, циркулирующие иммунные комплексы, цитокины, продукты клеточного метаболизма. Затем полученную лейкотромбомассу и эритроцитарную массу инкубировали с тималином в суммарной дозе 30 мг (за 3 процедуры) при 37 ° С в течение 60-100 мин, с последующим возвращением конъюгата в кровеносную систему больных.
Возраст обследованных больных РЯ составил от 27 до 72 лет, средний возраст – 41,7±7,5 лет.
Стадирование заболевания проводилось согласно Международной клинической классификации TNM (7-е издание, 2006 г.).
Изучение данных анамнеза показало, что у большей части (у 43,8%) пациенток анамнез заболевания составил от 1 до 3 месяцев.
ИММУНОГИСТОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ
Материалом для исследования послужили гистологические препараты операционно-биопсийного материала первичной опухоли больных РЯ, полученные до начала исследования. Образцы опухолевой ткани фиксировали в нейтральном забуференном формалине с обычной стандартной проводкой и заливкой в парафин. Гистологиче- ские препараты окрашивали обычными способами и проводили иммуногистохимические исследования.
Парафиновые срезы депарафинировали и регидратиро-вали по стандартной методике. Для визуализации иммуногистохимической реакции использовали DAB+ систему [DakoCytomation, Дания]. Оценку результатов окрашивания проводили с применением светового микроскопа «Leica» (Германия) под увеличением х10; х20; х40. Для маркера оценивали локализацию окрашивания в клетке (ядро, цитоплазма, мембрана). Количество положительных клеток оценивали в зонах, содержащих их максимальное количество. В иммуногистохимической оценке экспрессии p53 использовали моноклональные мышиные антитела к р53 (клон DO-7), VEGF (клон VG1), Ki-67 (клон M1B-1), EGFR (клон E30) и кроличьи антитела к c-erbB-2 (клон pAb) (DakoCytomation, Дания).
В исследовании применяли следующие критерии оценки маркеров:
-
1. Опухоль считали отрицательной по р53, если в ткани опухоли отсутствовала ядерная реактивность с антителами или количество окрашенных клеток было менее 25%; и положительной по р53, если было окрашено более 25% ядер опухолевых клеток.
-
2. Опухоль считали отрицательной по VEGF, EGFR и HER-2/ neu, если в ткани опухоли отсутствовала цитоплазматическая реактивность с антителами или количество окрашенных клеток было менее 25%; и положительной, если было окрашено более 25% опухолевых клеток.
-
3. Для оценки пролиферативной активности (ПА) опухоли подсчитывали количество Ki-67-положительных опухолевых клеток, приходящихся на 200–300 опухолевых клеток. Индекс Ki-67 определяли по формуле: ПА = число Ki-67-положительных клеток х 100/общее количество клеток. При этом пролиферативная активность опухоли оценивалась как процент Ki-67 положительных клеток от общего количества опухолевых клеток. Высокая пролиферативная активность соответствовала индексу Ki-67>40%, низкая пролиферативная активность опухоли соответствовала индексу Ki-67 <40%.
При статистической обработке результатов исследования рассчитывали значения средних величин с показателями их ошибок. Для сравнения достоверности различий между средними величинами использовали критерий Стьюдента. Данные считали достоверными при уровне значимости р<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При назначении методов экстракорпоральной иммунотерапии больным мы старались учитывать в наибольшем объеме результаты клинико-диагностических исследований.
86,7
83,3 80
16,6 20703013,3 20
p53
Her-2neu
EGFR
VEGF
Ki-67
Отрицательный уровень Положительный уровень
Рис.
1. Количество больных раком яичника с отрицательным
и положительным уровнями изучаемых онкомаркеров
p53(-) p53(+) Her-2neu(-) Her-2neu(+) EGFR(-) EGFR(+)
1 группа без иммунотерапии 2 группа ЭИФТ без ПФ 3 группа ЭИФТ с ПФ
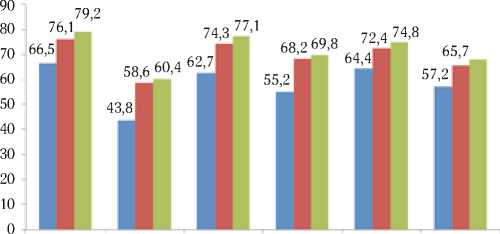
Рис. 2. 5-летняя выживаемость больных раком яичника в зависимости от вида иммунотерапии и экспрессии молекулярно-биологических маркеров опухоли р53, Her-2/neu, EGFR
VEGF(-) VEGF(+) Ki-67(-) Ki-67() ПА низкая ПА высокая
1 группа без иммунотерапии 3 группа ЭИФТ без ПФ 3 группа ЭИФТ с ПФ
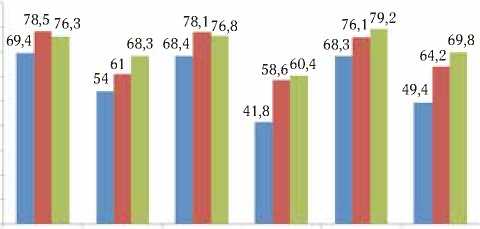
Рис. 3. 5-летняя выживаемость больных раком яичника в зависимости от вида иммунотерапии и экспрессии молекулярно-биологических маркеров VEGF, Ki-67, а также пролиферативной активности (ПА) опухоли
Наилучшие результаты после проведения иммунотерапевтических методов наблюдались в 3-й группе больных, что выражалось в улучшении общего анализа крови, умень-
шении лейкопении и лимфопении, а также нормализации показателей В-лимфоцитов, CD4+, CD8+ и NK. Менее выраженные результаты наблюдались во 2-й группе больных. Степень токсичности химиотерапии у больных РЯ устанавливали по шкале CTC-NCIC. В контрольной группе больных РЯ наиболее часто наблюдалась картина нейтропении и нейропатии на фоне угнетения миелопоэза. Выраженность таких побочных проявлений химиотерапии, как анемия, лейкопения, ухудшение аппетита, тошнота и аллопеция, у части больных составляла третью степень токсичности. Под влиянием ЭИФТ наблюдалось заметное уменьшение токсических эффектов химиотерапии.
Отрицательный уровень р53 был отмечен у 5 (16,6%) пациенток, положительный – у 25 (83,3%) (Рис. 1). Соответствующие показатели при изучении HER-2/neu обнаруживались у 24 (80,0%) и 6 (20,0%) пациенток, при изучении EGFR – у 21 (70,0%) и 9 (30,0%), VEGF – у 4 (13,3%) и 26 (86,7%) и при изучении Ki-67 – у 6 (20,0%) и 24 (80,0%) пациенток.
Таким образом, у большей части больных РШМ уровень изучаемых онкомаркеров был положительным, за исключением HER-2/neu и EGFR, которые были отрицательными у 80,0 и 70,0% пациенток соответственно.
Наиболее высокие показатели 5-летней выживаемости отмечались в группе больных, которым проводилась ЭИФТ с плазмаферезом. Так, в контрольной группе больных выживаемость с отрицательным уровнем р53 составила 62,6±6,8%, тогда как в группах с ЭИФТ и ЭИФТ+ПФ эти показатели составили 74,1±6,7 (р>0,05) и 78,1±7,7% (р>0,05) соответственно (Рис. 2). При положительном значении данного онкомаркера 5-летняя выживаемость составила 43,8±5,8% для контрольной группы без иммунотерапии и 58,6±6,7 (р<0,05) и 60,4±6,3% (р>0,05) для групп с применением методов иммунотерапии соответственно.
Показатели 5-летней выживаемости в контрольной группе больных при рассмотрении маркера HER-2/neu составили 62,7±4,6% при отрицательном его уровне и 55,2±6,4% – при его положительном значении (Рис. 2). Соответственно, в группах с иммунотерапией данный показатель составил 68,2±7,2 (р<0,05) и 74,3±6,7% (р<0,05) при отрицательном уровне и 69,8±6,5 (р>0,05) и 77,1±6,7% (р>0,05) – при его положительном значении.
При рассмотрении маркера EGFR было показано, что при его отрицательном значении в группе без иммунотерапии 5-летняя выживаемость составила 64,4±5,8%, а при положительном – 57,2±6,0% (Рис. 2). В группе с ЭИФТ соответствующие показатели составили 72,4±6,9 (р>0,05) и 65,7±5,6% (р>0,05), а в группе с ЭИФТ+ПФ – 74,8±7,4 (р<0,05) и 68,0±6,8% (р>0,05).
При отрицательном значении уровня VEGF в контрольной группе 5-летняя выживаемость пациенток составила 69,4±5,8 и при положительном – 54,0±6,0% (Рис. 3).
В группах больных, в которых применялась сопроводительная иммунотерапия, соответствующие значения при отрицательном значении VEGF составили 78,5±6,8 (р>0,05) и 76,3±7,2% (р>0,05), при положительном уровне данного онкомаркера – 61,0±6,7 (р<0,05) и 68,3±7,3% (р<0,05).
Онкомаркер Ki-67 не обнаруживался в опухолях 6 больных, у которых в контрольной группе 5-летняя выживаемость составила 68,4±6,9% (Рис. 3). При его положительном уровне в группе без иммунотерапии данный показатель составил 41,8±3,8%. В группах с проведением ЭИФИ и ЭИФТ+ПФ при отрицательном Ki-67 показатели выживаемости составили 78,1±6,5 (р>0,05) и 76,8±7,9% (р>0,05) соответственно, а при положительном – 58,6±6,3 (р<0,05) и 60,4±6,5% (р<0,05).
При низком уровне индекса ПА, который высчитывали по Ki-67, 5-летняя выживаемость в группе без иммунотерапии составила 68,3±7,7, при высоком его уровне – 49,4±5,4% (Рис.3). В группах с применением имммунотерапевтиче-ских методов 5-летняя выживаемость при низком индексе ПА составила 76,1±7,8 (р>0,05) и 79,2±8,0% (р>0,05), при высоком индексе – 64,2±6,8 (р<0,05) и 69,8±6,7% (р>0,05).
ЗАКЛЮЧЕНИЕ
Проведённые исследования позволили установить, что у большей части больных РЯ (у 83,3, 86,7 и 80,0% соответственно) присутствовали молекулярно-биологические маркеры p53, VEGF и Ki-67. В то же время, маркеры HER-2/neu и EGFR обнаруживались у 20,0 и 30,0% пациенток соответственно. При этом положительный уровень маркеров p53, VEGF и Ki-67 оказывал заметное негативное влияние на показатели 5-летней выживаемости больных РЯ, в случае же HER-2/neu и EGFR такое влияние было не столь выраженным, что указывает на их меньшую прогностическую значимость при данном заболевании.
При этом наибольший эффект в увеличении 5-летней выживаемости больных РЯ оказывала схема сопроводительной иммунотерапии, включающая ЭИФТ с плазмаферезом: такое влияние данного метода проявлялось как при положительных, так и при отрицательных уровнях рассмотренных онкомаркеров.
Таким образом, положительный уровень окомаркеров p53, VEGF и Ki-67 у больных РЯ наряду с высокой ПА опухоли, может служить основанием для проведения данной категории пациенток сопроводительной иммунотерапии с ЭИФТ. В случае положительных значений всех рассмотренных молекулярно-биологических факторов мы рекомендуем проведение сопроводительной ЭИФТ с плазмаферезом, что может существенно увеличить эффективность стандартных схем противоопухолевого лечения.
ВЫВОДЫ
-
1. У большей части больных раком яичника (у 83,3, 86,7 и 80,0% соответственно) присутствовали молекулярно-биологические маркеры p53, VEGF и Ki-67. В то же время, маркеры HER-2/neu и EGFR обнаруживались у 20,0 и 30,0% пациенток соответственно.
-
2. Наибольшей прогностической значимостью в отношении эффективности лечения больных раком яичника обладают молекулярно-биологические маркеры p53, VEGF и Ki-67, а также уровень пролиферативной активности (ПА) опухоли.
-
3. При положительном уровне маркеров p53, VEGF, Ki-67, а также при высокой ПА опухоли, 5-летняя выживаемость больных в группе без сопроводительной иммунотерапии составила 43,8±5,8, 54,0±6,0, 41,8±3,8 и 49,4±5,4% соответственно, тогда как при отрицательном значении данных маркеров и низком уровне ПА, показатели выживаемости составили 62,6±6,8, 69,4±5,8, 68,4±6,9 и 68,3±7,7% соответственно.
-
4. Использование в схемах лечения рака яичника сопроводительной иммунотерапии с ЭИФТ позволяет увеличить 5-летнюю выживаемость от 6,1 до 18,8%, в зависимости от схемы иммунотерапии и уровня рассмотренных онкомаркеров.
-
5. Наибольшей эффективностью в увеличении 5-летней выживаемости больных раком яичника обладает схема сопроводительной иммунотерапии, включающая ЭИФТ с плазмаферезом: такое влияние данного метода проявлялось как при положительных, так и при отрицательных уровнях всех рассмотренных онкомаркеров.
Список литературы Изучение маркеров апоптоза, пролиферации и ангиогенеза у больных раком яичника, получивших сопроводительную иммунотерапию
- de la Torre F. J., Garcia A., Gil-Moreno A., Planaguma J., Reven-tos J., Ramon y Cajal S., Xercavins J. Apoptosis in epithelial ovarian tumors Prognostic significance of clinical and histopathologic factors and its association with the immuno-histochemical expression of apoptotic regulatory proteins (p53, bcl-2 and bax)//Eur. J. Obstet. Gynecol. Reprod. Biol.-2007.-Vol. 130, N1.-P. 121-128.
- Khouja M. H., Baeke-landt M., Nesland J. M., Holm R. The clinical importance of Ki-67, p16, p14, and p57 expression in patients with advanced ovarian carcinoma//Int. J. Gynecol. Pathol.-2007.-Vol. 26, N4.-P. 418-425.
- Schindlbeck C., Hantschmann P., Zerzer M., Jahns B., Rjosk D., Janni W., Rack B. et al. Prognostic impact of KI67, p53, human epithelial growth factor receptor 2, topoisomerase IIalpha, epidermal growth factor receptor, and nrn23 expression of ovarian carcinomas and disseminated tumor cells in the bone мarrow//Int. J. Gynecil. Cancer.-2007.-V.17.-N5.-P. 1047-1055.
- Имянитов Е. Н. Молекулярные нарушения в опухолях яичников. В кн.: Горбунова В. А. (ред.). Диагностика и лечение рака яичников.-М.: Медицинское информационное агентство, 2011.-C.15-28
- Никогосян С. О., Кузнецов В. В. Рак яичников: вопросы диагностики и современные методы лечения//Врач.-2010.-№ 9.-С. 2-9
- Kommoss S., Rochon J., Harter P., Heitz F., Grabowski J. P., Ewald-Riegler N., Haberstroh M. et al. Prognostic impact of extended surgical procedures in advanced-stage primary ovarian cancer//Ann. Surg. Oncol.-2010.-V.17.-N1.-P. 279-286.
- Curtsinger J. M., Gerner M. Y., Lins D. C., Mescher M. F. Signal 3 Availability Limits the CD8 T Cell Response to a Solid Tumor//Journal of Immunology.-2007.-V. 178.-P. 6752-6760.
- Rosenberg S., Restifo N., Yang J., Morgan R., Dudley M. Adoptive cell transfer a clinical path to effective cancer immunotherapy//Nature Reviews Cancer.-2008.-N8.-P. 299-308.
- Чумаков П. М. Белок p53 и его универсальные функции в многоклеточном организме//Успехи биол. хим.-2007.-Т. 47.-№ 3.-С. 52.
- Sylvia M. T., Kumar S., Dasari P. The expression of immunohistochemical markers estrogen receptor, progesterone receptor, Her-2-neu, p53 and Ki-67 in epithelial ovarian tumors and its correlation with clinicopathologic variables//Pathology & Microbiology.-2012.-V.55.-N1.-P. 33-37.
- Hoopmann M., Sachse K., Valter M. M., Becker M., Neumann R., Ortmann M., Göhring U. J. et al. Serological and immunohistochemical HER-2/neu statuses do not correlate and lack prognostic value for ovarian cancer patients//Eur. J. Cancer.-2010.-V.19.-P. 809-815.
- Le Page C., Huntsman D. G., Provencher D. M., Mes-Masson A. M. Predictive and Prognostic Protein Biomarkers in Epithelial Ovarian Cancer: Recommendation for Future Studies//Cancer.-2010.-N2.-P. 913-954.
- McAlpine J.N., Wiegand K. C., Vang R., Ronnett B. M., Adamiak A., Köbel M., Kalloger S. E. et al. HER2 overexpression and amplification is present in a subset of ovarian mucinous carcinomas and can be targeted with trastuzumab therapy//BMC Cancer.-2009.-V.9.-P. 433.
- Han C. P., Hsu J. D., Yao C. C., Lee M. Y., Ruan A., Tyan Y. S., Yang S. F. et al. HER2 gene amplification in primary mucinous ovarian cancer: a potential therapeutic target//Histopathology.-2010.-V. 57.-N5.-P. 763-764.
- Tan D. S., Iravani M., McCluggage W.G., Lambros M. B., Milanezi F., Mackay A., Gourley C. et al. Genomic analysis reveals the molecular heterogeneity of ovarian clear cell carcinomas//Clin. Cancer. Res.-2011.-V.17.-N6.-P. 1521-1534.
- Шаназаров Н. А., Сабиров А. Х., Сироткина С. М. Роль эпидермального фактора роста и его рецептора в канцерогнезе: молекулярные механизмы их действия//Российский биотерапевтический журнал.-2009.-Т. 8.-№ 4.-С. 85-90.
- Yarden Y. The EGFR family and its ligands in human cancer signaling mechanisms and therapeutic opportunities//Eur. J. Cancer.-2001.-V.37.-N4.-P. 3-8.
- Song X., Shi B., Huang K., Zhang W. miR-133a inhibits cervical cancer growth by targeting EGFR//Oncol. Rep.-2015.-V. 34.-N3.-P. 1573-1580.
- Ferrara N., Gerber H. P., LeCouter J. The biology of VEGF and its receptors//Nat. Med.-2003.-N9.-Р.669-676.
- Ribatti D. History of research on tumor angiogenesis.-Netherlands, 2009.-125 р.


