Изучение механизмов противомикробного действия соединения (+)-erogorgiane
Автор: Нестерова Л.Ю., Ткаченко А.Г., Писцова О.Н.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Исследованы антибактериальная активность и возможные механизмы действия химически синтезированного соединения (+)-erogorgiane, аналога природного антибиотика, выделенного из морских кораллов Pseudopterogorgia elisabethae. Показано, что оно обладает бактерицидной активностью по отношению к Mycobacterium smegmatis как в логарифмической фазе роста культуры, так и в стационарной. С увеличением времени воздействия снижается концентрация, вызывающая полную гибель клеток в культуре. Эффект (+)-erogorgiane проявляется также по отношению к нерас-тущим клеткам M. smegmatis, которые являются более устойчивыми к действию антибиотиков ри-фампицина, изониазида и левофлоксацина, традиционно используемых для лечения туберкулеза. В то же время грамотрицательный микроорганизм Escherichia coli показал высокую устойчивость к данному препарату. Обнаружено концентрационно-зависимое подавление биопленкообразования М. smegmatis в присутствии (+)-erogorgiane. Ингибирующее действие оказывали как сублетальные, так и субингибиторные концентрации препарата, которые не оказывали влияние на рост культуры и не вызывали гибели клеток. С помощью атомно-силовой микроскопии установлено влияние (+)-erogorgiane на поверхностные структуры клетки: под действием сублетальных концентраций антибиотика увеличивается шероховатость клеточной поверхности. Получить мутантов, устойчивых к действию антибиотика высевом на твердую среду, содержащую препарат в высокой концентрации, не удалось.
Антибиотик, биопленки
Короткий адрес: https://sciup.org/147204794
IDR: 147204794 | УДК: 579.22
Текст научной статьи Изучение механизмов противомикробного действия соединения (+)-erogorgiane
Туберкулез, вызываемый Mycobacterium tuberculosis, уже в течение многих десятилетий остается одной из главных проблем здравоохранения, являясь причиной более чем миллиона смертей ежегодно [WHO Global Tuberculosis Report, 2015]. Наиболее существенной проблемой, препятствующей эффективному лечению туберкулеза, является быстрое появление ангибиотикорезистснгных форм возбудителя.
Особую тревогу' вызывает распространение штаммов с множественной лекарственной устойчивостью, которое делает существующие методы лечения неэффективными [Migliori, Sotgiu. Gandhi et al, 2013J. Лечение лекарственно устойчивых форм туберкулеза ? как правило, является дорогостоящим и предусматривает использование высокотоксичных препаратов с многочисленными побочными эффектами. В связи с Этим актуальным является поиск новых эффективных противотутберкулезных средств.
В последние годы внимание исследователей привлекли морские кораллы Pseudopterogorgia elisabethae, обитающие в Карибском море и продуцирующие необычные соединения, обладающие
(С Нестерова Л. Ю., Ткаченко А. Г., Писцова О. Н , 2016
фармакологической активностью. Ранее было обнаружено. что соединение дитерпеновой природы (+)-erogorgiane, выделенное из этих организмов,, обладает противотуберкулезной активностью [Do Souza. 2006], однако, изучение сто биологических свойств не проводилось в связи с трудностями его выделения из морских кораллов. Следует отметить что данное соединение по своей структуре значительно отличается от используемых в клинической практике антибиотиков различных классов. Исходя из этого, можно предполагать. что (+)-erogorgiane имеет принципиально иной способ воздействия на бактерии.
Поскольку’ для оценки возможности дальнейшего использования данного вещества в качестве лекарственного средства необходимо понимание механизмов действия антибиотика, целью данной работы является изучение антибактериальной активности и возможных механизмов противомикробного действия искусственно синтезирова иного соединения (+)-erogorgiane, которое является аналогом природного вещества, выделенного из морских кораллов.
Для изучения биологической активности и механизмов антибактериального действия (+)-erogorgiane в качестве объекта исследования выбран микроорганизм Mycobacterium smegmatis. близкий к М. tuberculosis^ в то же время нспато-генный и быстрорастущий и потому широко используемый в качестве модельного объекта при исследованиях физиологии возбудителя туберкулёзной инфекции.
Материалы и методы исследования
В качестве объектов исследования использовали штамм Mycobacterium smegmatis me'155. который сохраняли на чашке Петри с LB агаром (Sigma), культивировали на среде Middlebrook 7Н9 (Difco) с добавлением 0.005% Tween 80 при 37°С, 200 об/мин и штамм Escherichia coli GC 4468, который сохраняли на скошенном LB агаре и культивировали на глюкозо-минеральной среде М9 в термостатируемом шейкере GFL 1092 (Германия) 37°С 100 об/мин.
Для определения антибиотикочувствительности полученный инокулят разводили свежей средой до оптической плотности (ОП) 0.1 (□=600нм), доращивали в указанных условиях до нужной стадии роста и помещали 180 МКЛ культуры в лунки полистиролового 96-лу ночного планшета, куда добавляли 20 мкл раствора антибиотика нужной концентрации и тщательно перемешивали. Культивировали без перемешивания (время культивирования указано на графиках). По окончании культивирования количество живых клеток определяли с помощью подсчета колониеобразутощих единиц (КОЕ) после высева проб на чашки Петри с LB агаром.
Для определения влияния антибиотика на био- пленкообразование М. smegmatis выращенную в течение 24 ч. культуру откручивали на центрифуге, удаляли надосадочную жидкость и ресуспендиро-вали в свежей среде Middlebrook 7Н9 (Difco) без добавления Tween 80, доводя до ОП 0.L затем разводили ещё в 10 раз и помещали в лунки планшета. Культивировали в термостате при 37°С без встряхивания. Через 48 ч. из лунок осторожно удаляли планктонную культуру поверхностную пленку' высушивали и фотографировали. Для определения количества КОЕ в соответствующих пробах производили аналогичный посев на среду, содержащую 0.005% Tween 80. затем готовили десятикратные разведения и делали высевы на LB агар.
Профили поверхности клеток изучали с помощью атомно-силовой микроскопии (АСМ) с использованием совмещенной системы сканирования, состоящей из атомно-силового микроскопа Asylum MFP-3D-BIO (Asylum Research. США) и конфокального лазерного сканирующего микроскопа Olympus FV1000. (Olympus Corporation, Япония). Сканирование осуществляли в полукон-тактном режиме на воздухе с использованием кремниевого кантилевера AC240TS с резонансной частотой 50-90 кГц и константой жесткости 0.5-4.4 Н/м. Для характеристики структуры поверхности клеток (шероховатость Sq, индекс I) получали двух- и трехмерные топографические изображения бактерий. Обработку' микрофотографий проводили с помощью программы Igor Pro 6.22 А (WaveMetrics. США).
Статистическая обработка результатов проведена с использованием пакета стандартных программ Statistica 6.0 (“StatSoft ТпсД 2001). Различия считали значимыми при р<0.05.
Результаты и их обсуждение
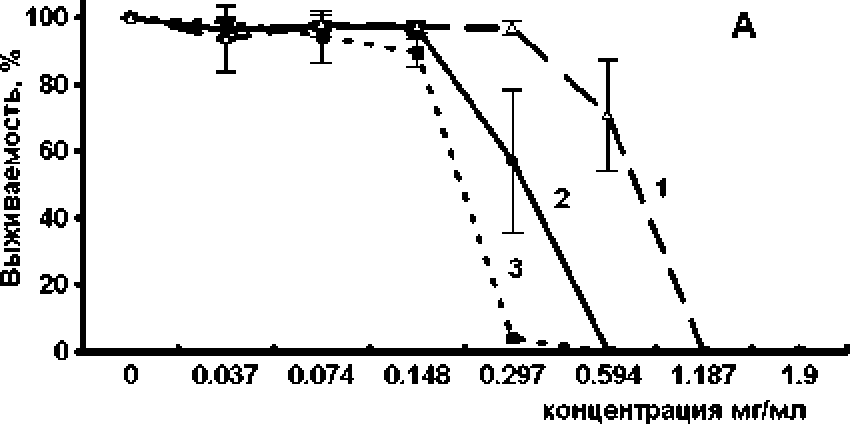
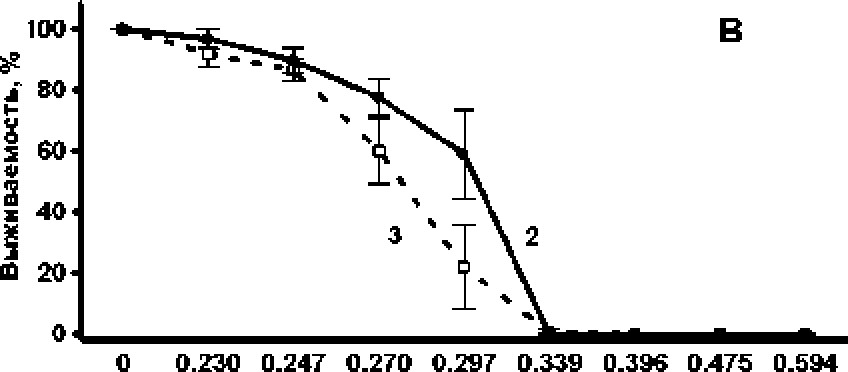
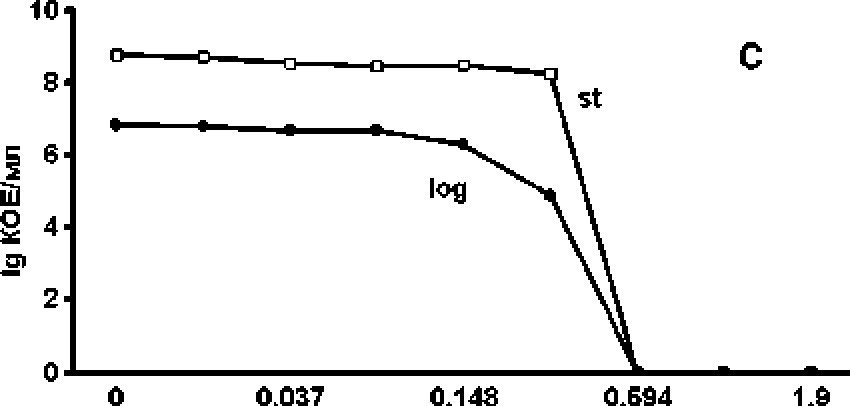
На первом этапе исследования была проведена оценка характера и интенсивности антибактериального действия исследуемого вещества. Показано, что (+)-erogorgiane обладает бактерицидным действием по отношению к М. smegmatis. При этом с увеличением времени воздействия снижается концентрация, которая вызывает полную гибель клеток в культуре (рис. 1А). При более подробной расгитровкс исследуемого препарата удалось установить концентрации, которые оказывают сублс-тальное действие, те. снижают количество клеток, не вызывая полной гибели культуры (рис. 1В). Однако разница между’ суббактериостатическими концентрациями, которые не оказывают влияния на количество клеток, и бактерицидными концентрациями была невелика. Данные концентрации отличались менее чем в 2 раза (рис. 1В). Следует отметить, что бактерицидный эффект исследуемого препарата проявлялся как по отношению к культуре, находящейся в логарифмической фазе роста, так в стационарной (рис. 1С), которая в большинстве случаев является более резистентной к действию различных неблагоприятных факторов, в том числе антибактериальных препаратов [Leisner, Jorgensen, Middelboe. 2016].
концентрация мг/мл
концентрация мг'мл
Рис. L Бактерицидное действие антибиотика на культуру Mycobacterium smegma tis.
Ашибиотк добавляли в культуру в ло^рифмической (А, В, С) и стационарной (С) фазе роста. Экспозиция с антибиотиком 1 - 5 ч ; 2, С - 24 ч.; 3 - 48 ч.
Эффект антибиотика проявлялся также по отношению к нерастущим клеткам, которые были помещены в буфер и после этого подвергнуты действию антибиотика. Такие клетки являются более устойчивыми к действию антибиотиков. Традиционные антибиотики, применяемые для лечения туберкулеза. такие как изониазид, рифампицин и ле-вофлоксацин, в аналогичных условиях нс приводили к полной гибели культуры. Более того, в культуре, взятой в стационарной фазе роста, изониазид практически не имел эффекта на количество клеток, а рифампицин снижал число клеток на 2 порядка (рис. 2). В этом эксперименте мы использовали концентрации антибиотиков, которые намного превышают терапевтические и в 100 раз превышают концентрации, которые препятствуют росту культуры (МПК). Таким образом, (+)-erogorgianc, в отличие от традиционных антибиотиков, способен нс только препятствовать размножению микобактерий, но и полностью убивать клетки вне зависимости от стадии роста культуры, препятствуя образованию персисторных форм ми-
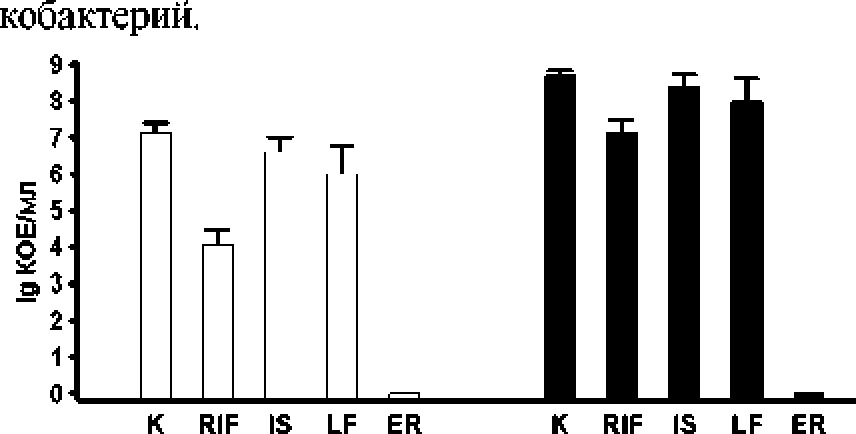
Рис. 2, Действие антибиотиков на нерастущую культуру М. smegmatis.
Антибиотики добавляли в культуру М. smegmatis^ взятую из логарифмической (светлые столбцы) и стационарной (черные столбцы) фазы роста, отмытую от питательной среды и ресуспецдированную в PBS , буфере. Экспозиция 24 ч.
К - контроль без добавки антибиотика; RIF - рифампицин (488 мкг/мл); IS - изониазид (488 мкг/мл); LF -левофлоксацин (63 мкг/мч); ER - (+)-erogorgiane (399 мкг/мч)
Грамотрицательный микроорганизм Esch eri -chia coU. в свою очередь, оказался совершенно нечувствительным к исследуемому антибиотику7. Нам не удалось обнаружить не только бактерицидного, но также и бактериостатического эффекта ни в одной из исследованных концентраций препарата. Исходя из этого, можно предположить, что мишень для действия (+)-erogorgiane специфична для грамположительных микроорганизмов, а возможно, для микобактерий. Несмотря на то, что действие исследуемого соединения на культуру Е. сой не сопровождается гибелью клеток, нами был обнаружен отклик некоторых генов, ответственных за адаптацию этого микроорганизма к стрессовым условиям на его действие (данные не показаны). Данный подход будет использован для дальнейшей работы по расшифровке механизма действия антибиотика.
Следующий этап исследований был посвящен оценке влияния (+)-erogorgianc на способность М. smegmatis к биопленкообразованию. Известно, что микроорганизмы в составе биопленок значительно более устойчивы к действию антибиотиков и иммунной системы хозяина [Syal, Maiti, Naresh et al., 2016]. Хотя роль биопленкообразования в патогенезе микобактерий остается неясной, многие их виды способны формировать биопленки [Arai, Niikawa, Kobayashi, 2013].
Установлено, что присутствие (+)-erogorgiane подавляет биопленкообразование М, smegmatis (рис. 3). Ингибирующее действие оказывали как суб л стальные, так и субингибиторные концентрации препарата, которые не имели эффекта на рост культуры и не вызывали гибели клеток (рис. 3). Влияние исследуемого препарата на биопленкообразование может осуществляться посредством различных механизмов, поскольку7 процесс формиро- вания биопленок у микобактерий регулируется множеством факторов [Sharma, Petchiappan, Chatter] L 2014]. Одним из возможных механизмов является изменение поверхностных структур клетки, которое, в свою очередь, влияет на способность бактерий формировать биопленки [Aguayo, Bozec,
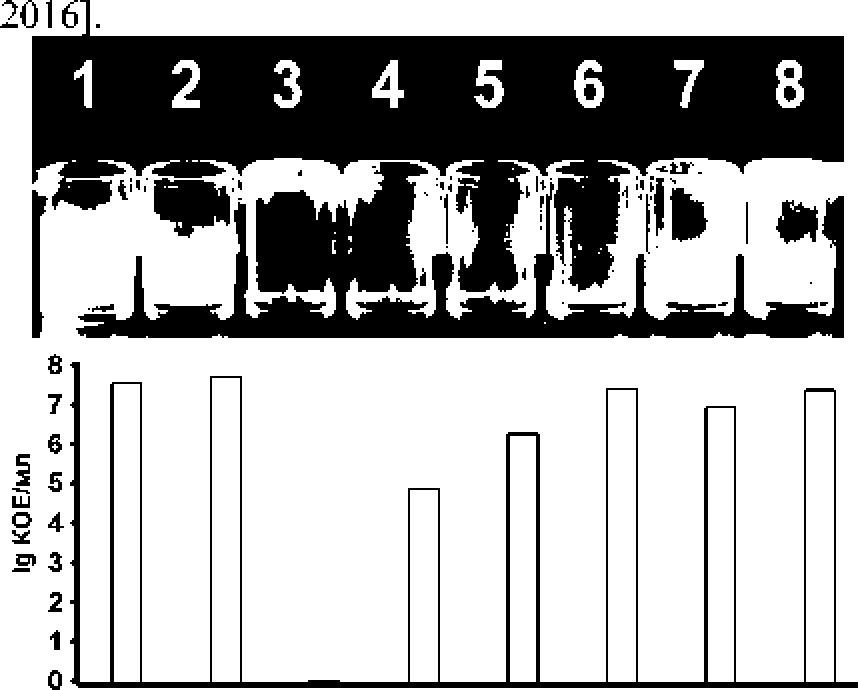
1 2 3 4 5 6 7 В
Рис. 3* Влияние (±)-erogorgiane на биопленко-об ра зовам ие A A smegmatis.
На фото поверхностная биопленка после высушивания. Столбики диаграммы отображают количество КОЕ в лунках. соответствующих лункам на фото, с добавлением Tween 80.
Концентрация антибиотика: 1:2 - контроль без антибиотика. 3 - 0.594 мг/мл: 4 - 0.297: 5 - 0.148 мг/мл: 6 -0,074 мг/мл; 7 - 0.037 мг/мл; 8 - 0.019 мг/мл
Отсутствие действия препарата на клетки гра-мотрицательных Е. с oh свидетельствует о том, что возможной мишенью для действия антибиотика является клеточная стенка грамположительных бактерий. В пользу этого предположения также свидетельствуют и данные, полученные с помощью атомно-силовой микроскопии. Установлено, что под действием сублетальных концентраций (±)-erogorgiane происходит статистически достоверное возрастание шероховатости поверхности клеток А/. smegmatis по отношению к контролю (таблица).
Изменение шероховатости клеточной поверхности под действием антибиотика
|
Вариант опыта |
Шероховатость Sq, нм |
|
Контроль |
153.8 (±7,5) |
|
Сублетальная концентрация (+)-erogorgiane (0,297 мг/мл) |
217.0 (±21.6) * |
Приведены средние значения шероховатости ± с.
*- статистически значимое отличие от контроля без добавки антибиотика. Достоверность различий определяли с помощью критерия Ньюмена—Кейлса.
Предполагалось, что следующим этапом работы должен стать анализ мутантов, устойчивых к действию (+)-erogorgiane. Однако наши попытки получить устойчивые клоны высевом большого количества клеток на твердую среду, содержащую высокие концентрации препарата [Kern, Oethinger, Jellen-Ritter, et al. 2000], не дали результатов. Возможно, это связано с особенностями действия данного антибиотика. Можно предположить, что мутаций в одном или двух генах недостаточно, чтобы микроорганизм стал нечувствителен к данному соединению, как это имеет место в отношении других антибиотиков [McMurry, McDermott, Lexy, 1999; Telenti. Honore, Bernasconi etal., 1997].
Заключение
Таким образом, искусственно синтезированный аналог природного антибиотика (+)-erogorgiane оказывает бактерицидное действие на клетки М smegmatis независимо от стадии роста культуры, а также на нерастущие клетки. Данное вещество в сублетальных концентрациях препятствует образованию биопленок микобактериями.
Несмотря на то, что на данном этапе исследований нельзя точно указать конкретный механизм действия (±)-erogorgiane на клетки микобактерий, нами установлено, что его действие приводит к изменению поверхностных структур клетки.
Работа выполнена при поддержке РНФ (проект 15-13-00092).
Список литературы Изучение механизмов противомикробного действия соединения (+)-erogorgiane
- Aguayo S., Bozec L. Mechanics of bacterial bells and initial iurface colonisation//Advances in Experimental Medicine and Biology. 2016. Vol. 915. P. 245-260
- Arai M., Niikawa H., Kobayashi M. Marine-derived fungal sesterterpenes, ophiobolins, inhibit biofilm formation of Mycobacterium species//Journal of Natural Medicines. 2013. Vol. 67, № 2. P. 271-275
- De Souza M. V.N. Marine natural products against tuberculosis//The Scientific World Journal. 2006. Vol. 21, № 6. P. 847-861
- Kern W.V., Oethinger M., Jellen-Ritter A.S., Levy S.B. Non-target gene mutations in the development of fluoroquinolone resistance in Escherichia coli//Antimicrobial Agents and Chemotherapy. 2000. Vol. 44, № 4. P. 814-820
- Leisner J.J., Jorgensen N.O., Middelboe M. Predation and selection for antibiotic resistance in natural environments//Evolutionary Applications Journal. 2016. Vol. 9, № 3. P. 427-434
- McMurry L.M., McDermott P.F., Levy S.B. Genetic evidence that InhA of Mycobacterium smegmatis is a target for triclosan//Antimicrobial Agents and Chemotherapy. 1999. Vol. 43, № 3. P. 711-713
- Migliori G.B., Sotgiu G., Gandhi N.R. et al. Drug resistance beyond extensively drug-resistant tuberculosis: individual patient data meta-analysis//European Respiratory Journal. 2013. Vol. 42, № 1. P. 169-179
- Sharma I.M., Petchiappan A., Chatterji D. Quorum sensing and biofilm formation in mycobacteria: role of c-di-GMP and methods to study this second messenger//International Union of Biochemistry and Molecular Biology Life. 2014. Vol. 66, № 12. P. 823-834.
- Syal K., Maiti K., Naresh K. et al. Synthetic arabino-mannan glycolipids impede mycobacterial growth, sliding motility and biofilm structure//Glycoconju-gate Journal. 2016. № 4
- Telenti A., Honore N., Bernasconi C. et al. Genotypic assessment of isoniazid and rifampin resistance in Mycobacterium tuberculosis: a blind study at reference laboratory level//Journal of Clinical Microbiology. 1997. Vol. 35, № 3. P. 719-723
- World Health Organisation. Global Tuberculosis report 2015. France, 2015. 192 p


