Изучение окислительных процессов в ткани сердца крыс при моделировании дефицита оксида азота
Автор: Медведев Д.В., Звягина В.И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.28, 2013 года.
Бесплатный доступ
Цель исследования: изучение влияния снижения содержания метаболитов оксида азота под действием L-NG-нитроаргинина метилового эфира (L-NAME) - неселективного ингибитора NO-синтазы - на активность сукцинатдегидрогеназы и супероксиддисмутазы и скорость протекания процессов спонтанного окисления белков в сердце крыс. Показано, что L-NAME дозозависимо и с разной интенсивностью снижает уровень метаболитов оксида азота в сыворотке крови и сердце крыс (в сыворотке сильнее, чем в сердце). Ингибирование синтеза оксида азота под действием L-NAME приводит к дозозависимому уменьшению спонтанного окисления белков в сердце крыс, одной из причин которого, возможно, является изменение активности митохондриальных ферментов.
Оксид азота, l-ng-нитроаргинина метиловый эфир (l-name), окислительная модификация белков, супероксиддисмутаза, сукцинатдегидрогеназа, митохондрии
Короткий адрес: https://sciup.org/14919855
IDR: 14919855 | УДК: 577.1:616.127-008.9
Текст научной статьи Изучение окислительных процессов в ткани сердца крыс при моделировании дефицита оксида азота
Оксид азота (NO) является вторичным мессенджером, аутокринным и паракринным регулятором. В настоящее время механизм действия и биологические эффекты оксида азота активно изучаются. Известно, что NO активирует гемсодержащий фермент – растворимую гуанилат-циклазу (ГЦ). В частности, в сердечной мышце крыс оксид азота может вызывать увеличение синтеза циклического гуанозинмонофосфата (цГМФ) гуанилатциклазой более чем в 23 раза [13]. Помимо этого он способен взаимодействовать с гемами других протеинов, тиолами, белками, углеводами, ионами металлов и т.д., локализованными в разных тканях и органах [3]. Столь высокая реакционная способность создает предпосылки для проявления оксидом азота разнообразных биологических эффектов.
Оксид азота синтезируется из аргинина NO-синтазой (NOS). Существуют 3 изоформы этого фермента: NO-синтаза 1-го типа (нейрональная, nNOS), NO-синтаза 2-го типа (индуцибельная, iNOS), NO-синтаза 3-го типа (эндотелиальная, eNOS). Нейрональная и эндотелиальная NOS – конститутивные формы NO-синтазы, т.е. их экспрессия постоянна. Их активация осуществляется ионами Са2+. В то же время NO-синтаза 2-го типа индуцируется под влиянием воспалительных цитокинов, ее активация не зависит от ионов Са2+ [7]. Изоформы NOS в значительной степени гомологичны, причем для C-концевого домена гомология характерна не только для самих изоферментов, но и для цитохрома P-450 [3].
Ряд патологических состояний, например, сердечнососудистые, инфекционные, воспалительные заболевания, тромбозы, злокачественные опухоли, заболевания мочеполовой системы, мозговые повреждения при инсультах и др. могут быть связаны с недостатком или гиперпродукцией оксида азота в организме [3]. Недостаток NO играет важную роль в патогенезе сердечно-сосудистых заболеваний. Однако в большинстве случаев исследования ограничиваются изучением участия оксида азота в регуляции сосудистого тонуса. В то же время влияние снижения синтеза NO на сердце, наблюдаемое при ряде патологических состояний, остается недостаточно изученным. Особенно это касается биохимических показателей самих клеток сердца.
Немаловажно изучение участия NO в процессах перекисного окисления липидов и белков. Одной из объективных методик оценки окислительной модификации белков (ОМБ) является спектрофотометрическое определение количества карбонильных групп и иминогрупп в белках по реакции образования динитрофенилгидра- зонов. На сегодняшний день ОМБ признана одним из наиболее ранних и стабильных показателей поражения различных тканей организма при свободно-радикальной патологии [1].
Дыхательная цепь митохондрий является одним из главных источников активных форм кислорода (АФК) в клетках [6]. Особую роль генерация АФК этими органеллами играет для клеток сердца, т.к. в кардиомиоцитах много митохондрий, и в них активно протекают процессы аэробного окисления, ведь окислительное фосфорилирование – главный источник энергии для сердечной мышцы. Поэтому процессы свободно-радикального окисления в клетках сердца можно объяснять с позиций изменения активности митохондриальных оксидоредуктаз. С этой целью в данной статье рассматривается изменение активности супероксиддисмутазы (СОД) как одного из главных ферментов антиоксидантной защиты и сукцинатдегидрогеназы (СДГ) как важного связующего звена в процессах аэробного окисления, а именно между циклом трикарбоновых кислот и дыхательной цепью митохондрий.
Цель: изучить влияние снижения содержания метаболитов оксида азота в сыворотке крови и митохондриях клеток сердца под действием L-NG-нитроаргинина метилового эфира (L-NAME) – неселективного ингибитора NO-синтазы – на активность митохондриальных оксидоредуктаз (СОД и СДГ) и скорость протекания процессов спонтанного окисления белков в сердце.
Материал и методы
Исследование проводилось на 24 крысах-самцах линии Wistar, которые были разделены на три равные группы. Крысам первой (контрольной) группы (n=8) внутрибрюшинно вводился 0,9 %-й раствор хлорида натрия (NaCl) 1 раз в сутки в течение 7 дней, второй (n=8) – внутрибрюшинно вводился препарат L-NAME (L-NG-нит-роаргинина метиловый эфир) – неселективный ингибитор NO-синтазы в виде 0,5%-го раствора 1 раз в сутки в течение 7 дней из расчета 25 мг препарата на 1 кг массы тела крысы, а третьей (n=8) – внутрибрюшинно вводился L-NAME в дозе 200 мг на 1 кг также 1 раз в сутки в течение 7 дней. Дозы L-NAME были выбраны в соответствии с литературными данными [11, 14]. Немедленно после забоя животных (на 8-й день эксперимента) брали кровь и сердце. Сыворотку крови использовали для определения содержания в ней метаболитов NO. Из ткани сердца получали гомогенат и выделяли из него митохондрии методом дифференциального центрифугирования [10]. Для оценки окислительной модификации белков использовали надосадочную жидкость, а осадок, содержащий митохондрии, ресуспендировали в 0,25 М растворе сахарозы с добавлением детергента Тритона Х-100 (для разрушения митохондриальных мембран) и далее использовали для определения активности митохондриальных ферментов: СДГ и митохондриальной Mn-зависимой СОД, а также для измерения концентрации метаболитов NO в митохондриях.
Общее содержание белка в пробах определяли по методу Лоури с помощью стандартизированного набора
DiaSyS Diagnostic Systems. Окислительную модификацию белков оценивали по методу R.L. Levine [12] в модификации Е.Е. Дубининой [5], который основан на реакции взаимодействия карбонильных групп и иминогрупп окисленных аминокислотных остатков с 2,4-динитрофенил-гидразином (2,4-ДНФГ) с образованием 2,4-динитрофе-нилгидразонов, обладающих специфическим спектром поглощения в ультрафиолетовой и видимой областях спектра. При этом образуются альдегид-динитрофенил-гидразоны (А-ДНФГ) и кетон-динитрофенилгидразоны (К-ДНФГ). А-ДНФГ являются ранним маркером окислительной деструкции белков, а КДНФГ – поздним [4]. Оптическую плотность образовавшихся динитрофенилгид-разонов регистрировали на спектрофотометре СФ-2000 при длинах волн 254, 270, 280, 356, 363, 370, 430 и 530 нм.
Активность СДГ исследовали с помощью метода, основанного на определении восстановленного гексацианоферрата [10]. Активность СОД определяли при помощи метода В.А. Костюка [8].
Определение метаболитов NO (нитритов и нитратов) проводили в митохондриальной фракции гомогената сердечной мышцы и в сыворотке крови с помощью метода в модификации В.А. Метельской [9] на иммунофер-ментном анализаторе StatFax 3200.
Полученные в ходе исследования результаты обрабатывались с помощью программы Microsoft Excel, 2003. Для определения различий между независимыми группами (контрольной и получавшими L-NAME) использовали U-критерий Манна–Уитни. Уровень отличий рассматривался как статистически значимый при вероятности ошибки (p<0,05).
Результаты и обсуждение
Введение L-NAME статистически достоверно (p<0,01) приводит к дозозависимому снижению содержания метаболитов оксида азота как в сыворотке крови, так и в митохондриальной фракции гомогената сердца крыс (табл. 1).
Однако это снижение более выражено в сыворотке, чем в митохондриях. Это может быть обусловлено как особенностями распределения L-NAME в организме, так и некоторой селективностью его действия в отношении ингибирования разных изоферментов NOS. Так, L-NAME несколько сильнее ингибирует конститутивные формы NOS (nNOS, eNOS), чем индуцибельную [3]. Основным поставщиком NO для крови является eNOS эндотелия сосудов. В сердце присутствуют все 3 изоформы NО-син-таз: nNOS локализуется в саркоплазматическом ретикулуме и митохондриях клеток сердца, eNOS – в инвагинациях плазматической мембраны кардиомиоцитов (каве-олах), iNOS – в кардиомиоцитах вдоль сократительных волокон, в их плазматических мембранах, включая T-ту-булы, ядерную оболочку, митохондрии и комплекс Гольджи, а также в макрофагах, фибробластах, эндотелиоци-тах коронарных сосудов и эндокарда, гладкомышечных клетках коронарных сосудов [2]. Причем iNOS экспрессируется в клетках сердца как при патологии, так и в норме. Учитывая, что активность iNOS в сотни раз выше, чем
Таблица 1
Концентрация метаболитов NO в сыворотке крови и митохондриях сердца, мкмоль/л (результаты представлены в форме: среднее значение±стандартное отклонение, M±s)
|
Крысы, получавшие в/б 0,9%-й раствор NaCl в течение 7 дней |
Крысы, получавшие в/б L-NAME в дозе 25 мг/кг в течение 7 дней |
Крысы, получавшие в/б L-NAME в дозе 200 мг/кг в течение 7 дней |
|
|
Концентрация метаболитов NO в сыворотке крови, мкмоль/л Концентрация метаболитов NO в митохондриях сердца, мкмоль/л |
111,8±9,09 96,6±19,33 |
74,6±8,56** ( ↓ 33,28%) 78,0±13,24** ( ↓ 19,2%) |
31,7±12,88** ( ↓ 71,63%) 52,8±13,81** ( ↓ 45,33%) |
Примечание: ** – p<0,01 – по сравнению с контрольной группой.
контрольная группа
L-NAME 25 мг/кг
L-NAME 200 мг/кг сдг
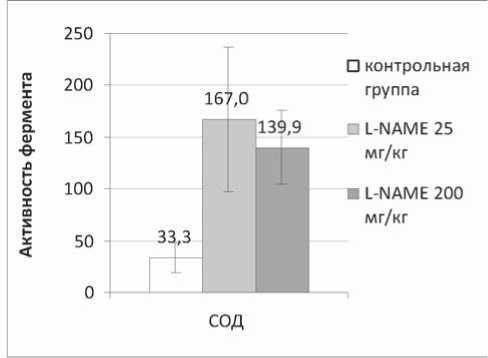
Рис. 2. Изменение активности СОД (оптическая плотность, у.е./ мг белка) в сердце под действием L-NAME в дозах 25 мг/кг и 200 мг/кг (p<0,05 – по сравнению с контрольной группой)
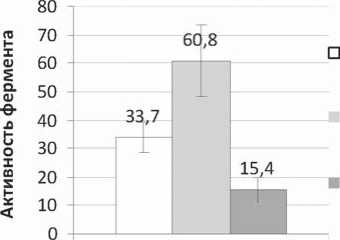
Рис. 1. Изменение активности СДГ (нмоль сукцината/мин на г белка) в сердце под действием L-NAME в дозах 25 мг/кг и 200 мг/кг (p<0,05 – по сравнению с контрольной группой)
у конститутивных форм NO-синтазы, она, по-видимому, является главным продуцентом NO в кардиомиоцитах. Поэтому не столь значительное снижение содержания метаболитов NO в митохондриях клеток сердца по сравнению с сывороткой крови можно объяснить менее выраженным ингибированием iNOS под действием L-NAME.
Следует также отметить, что сам факт ингибирования синтеза NO в митохондриях сердца указывает на наличие в этом органе эстераз, обеспечивающих гидролиз L-NAME как сложного эфира до его активного метаболита L-NG-нитроаргинина (L-NNA).
L-NAME вызывает значительное изменение активности митохондриальных ферментов, которые отражены на рисунках 1 и 2.
L-NAME повышает активность митохондриальной Mn-зависимой СОД, причем при введении ингибитора в дозе 25 мг/кг активность фермента повышается более чем в 4 раза, а в дозе 200 мг/кг – в 3,2 раза. Активность СДГ изменяется разнонаправленно: доза 25 мг/кг приводит к увеличению активности фермента на 80,39%, а доза 200 мг/кг – к ее снижению на 54,28%.
Повышение активности СДГ можно объяснить с позиций ингибирования оксидом азота ферментов цикла Кребса (аконитатгидратазы) и дыхательной цепи митохондрий (цитохром-с-оксидазы) [3]. Снижение синтеза NO под действием L-NAME в дозе 25 мг/кг, по-видимому, приводит к повышению скорости реакций цикла трикар- боновых кислот и дыхательной цепи митохондрий из-за снижения ингибирующего действия оксида азота. Понижение активности СДГ в результате более выраженного ингибирования синтеза NO после введения L-NAME в дозе 200 мг/кг может быть связано с нарушением коронарного кровотока и доставки к миокарду кислорода и, как следствие, с замедлением окислительных процессов в кардиомиоцитах. Повышение активности митохондриальной СОД под действием L-NAME в обеих дозах, возможно, также является следствием нарушения коронарного кровотока с последующей реперфузией. L-NAMЕ является обратимым ингибитором NOS, и вполне возможно, что при введении этого препарата 1 раз в сутки синтез NO успевает частично восстановиться, а это, в свою очередь, приводит к временному восстановлению коронарного кровотока. Таким образом, можно предположить, что повышение активности митохондриальной СОД является механизмом адаптации к стрессу, и в данном случае это не следует рассматривать как однозначно положительное влияние L-NAME на состояние антиоксидантной системы. Кроме того, необходимо учитывать, что под действием СОД из супероксидного анион-радикала образуется перекись водорода [6], также являющаяся токсическим соединением, способным вызывать дисбаланс системы антиоксидантной защиты.
Введение L-NAME в дозе 25 мг/кг не приводит к статистически значимому изменению содержания белка в
Таблица 2
Концентрация белка в гомогенате ткани сердца, лишенном митохондрий, мг/мл (М±s)
|
Крысы, получавшие в/б 0,9%-й раствор NaCl в течение 7 дней |
Крысы, получавшие в/б L-NAME 25 мг/кг в течение 7 дней |
Крысы, получавшие в/б L-NAME 200 мг/кг в течение 7 дней |
|
|
Общий белок, мг/мл гомогената ткани сердца |
4,5±1,12 |
3,9±1,71 ( ↓ 15%) |
6,3±1,02* ( ↑ 39%) |
Примечание: * – p<0,05 – по сравнению с контрольной группой.
Длина волны, нм
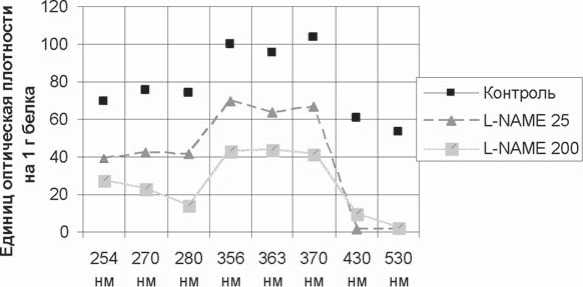
Рис. 3. Показатели спонтанной ОМБ
сердце, а доза 200 мг/кг достоверно его увеличивает на 39% (табл. 2).
При этом речь, конечно, идет только о белках, растворимых в 0,25 М растворе сахарозы, т.е. о саркоплазматических белках. Как известно, повышение содержания в сердце этих белков обычно наблюдается при патологии этого органа.
Изучение окислительной модификации белков в без-митохондриальной фракции гомогената сердца крыс после ингибирования синтеза оксида азота под действием L-NAME в дозах 25 и 200 мг/кг дало результаты, представленные на рисунке 3.
Введение L-NAME в дозе 25 мг/кг достоверно (p<0,05 – по сравнению с контрольной группой) снижает показатели спонтанной ОМБ при длине волны 430 нм (соответствует основным альдегид-динитрофенилгидразонам (АДНФГ) и кетон-динитрофенилгидразонамов (КДНФГ)) в 49,5 раз. L-NAME же в дозе 200 мг/кг достоверно снижает значения спонтанной ОМБ при λ =356 нм (что соответствует нейтральным АДНФГ) на 38,2% (p<0,01 – по сравнению с контрольной группой), а при 363 нм (что соответствует нейтральным КДНФГ) – на 31,3% (p<0,05 – по сравнению с контрольной группой).
Исходя из полученных при изучении ОМБ данных, можно заключить, что влияние L-NAME на процессы окисления белков в клетках сердца сильно зависит от дозы. Введение препарата в количествах 25 и 200 мг/кг в течение 7 дней дозозависимо замедляет процессы спонтанного окисления белков, практически не влияя на соотношение альдегидных и кетоновых производных протеинов (т.к. почти не изменяется спектр поглощения).
Снижение спонтанного окисления белков в сердце можно объяснить с разных позиций. Во-первых, такое изменение может быть связано со снижением концентрации метаболитов оксида азота; ведь NO сам по сути является свободным радикалом (содержит неспаренный электрон), а при взаимодействии с супероксидным анион-радикалом (O2·–) образует сильнейший окислитель – пероксинитрит (ОNOO–) [6]. Во-вторых, снижение окисления белков в сердечной мышце можно объяснить, исходя из изменения активности митохондриальных ферментов. Так, L-NAME в обеих дозах (25 и 200 мг/кг) вызывает выраженное увеличение активности митохондриальной СОД, что неизбежно должно снижать в клетке концентрацию O2·–, а следовательно, и ОNOO–. Более выраженное уменьшение скорости процессов спонтанного окисления белков при введении L-NAME в дозе 200 мг/кг, чем в дозе 25 мг/кг логично вытекает из изменения активности СДГ. Как уже отмечалось, дыхательная цепь митохондрий является важным источником генерации АФК в кардиомиоцитах. Ее активность непосредственно связана с активностью ферментов цикла трикарбоновых кислот, поставляющего доноры водорода для дыхательной цепи. Снижение активности СДГ под действием L-NAME в дозе 200 мг/кг должно приводить как к уменьшению скорости ферментативных реакций цикла Кребса, так и к ингибированию митохондриальной цепи переноса электронов. Результатом вышеперечисленного является замедление процессов свободнорадикального окисления в клетках сердца.
Выводы
L-NAME дозозависимо и с разной интенсивностью снижает уровень метаболитов оксида азота в сыворотке крови и сердце крыс (в сыворотке сильнее, чем в ткани сердца).
Ингибирование синтеза оксида азота под действием L-NAME приводит к дозозависимому уменьшению спонтанного окисления белков в сердце крыс, одной из причин которого, возможно, является изменение активности митохондриальных ферментов.
Список литературы Изучение окислительных процессов в ткани сердца крыс при моделировании дефицита оксида азота
- Абаленихина Ю.В. Фомина М.А., Чурилов Г.И. и др. Окислительная модификация белков тимуса крыс под влиянием меди в ультрадисперсной форме//Фундаментальные исследования. -2012. -№ 11. -С. 1315-1319.
- Гарматина О.Ю., Ткаченко М.Н., Мойбенко А.А. Индуцибельная синтаза оксида азота при патологии сердца (обзор литературы и собственных исследований)//Теоретична медицина. -2005. -Т. 11, No. 4. -С. 645-660.
- Граник В.Г., Григорьев Н.Б. Оксид азота (NO). Новый путь к поиску лекарств: монография. -М.: Вузовская книга, 2004. -360 с.
- Губский Ю.И., Беленичев И.Ф., Левицкий Е.Л. и др. Токсико-логические последствия окислительной модификации белков при различных патологических состояниях (обзор литературы)//Современные проблемы токсикологии. -2005. -Т. 8, № 3. -С. 20-27.
- Дубинина Е.Е., Бурмистров С.О., Ходов Д.А. и др. Окислительная модификация белков сыворотки крови человека, метод ее определения//Вопросы мед. химии. -1995. -Т. 41, № 1. -С. 24-26.
- Дубинина Е.Е. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение). Физиологические и клинико-биохимические аспекты. -СПб.: Медицинская пресса, 2006. -С. 276-282.
- Козловский В.И. Механизмы регуляции коронарного кровотока, опосредованной эндотелиальными сосудорасширяющими факторами: монография. -Гродно: ГрГМУ, 2011. -216 с.
- Костюк В.А., Потапович А.И., Ковалева Ж.В. Простой и чувствительный метод определения активности супероксид дисмутазы, основанный на реакции окисления кверцетина//Вопросы мед. химии. -1990. -№ 2. -С. 88-91.
- Метельская В.А., Гуманова Н.Г. Скрининг метод определения уровня метаболитов оксида азота в сыворотке//Клиническая лабораторная диагностика. -2005. -№ 6. -С. 15-18.
- Методы биохимических исследований (липидный и энер гетический обмен)/под ред. М.И. Прохоровой. -Л.: Изд во Ленинградского университета, 1982. -327 с.
- Покровский М.В., Покровская Т.Г., Корчаков В.И. и др. Эндотелиопротекторные эффекты L-аргинина при моделировании дефицита окиси азота//Экспериментальная и клиническая фармакология. -2008. -Т. 71, № 2. -С. 29-31.
- Levine R.L., Garland D., Oliver C.N. et al. Determination of carbonyl content in oxidatively modified proteins//Methods in enzymology. -1990. -Vol. 186. -P. 464-478.
- Murad F. Discovery of some of the biological effects of nitric oxide and its role in cell signaling//Bioscience reports. -1999. -Vol. 19, No. 3. -P. 133-154.
- Zun Yi Wang, Hakanson Rolf. Role of nitric oxide (NO) in ocular inflammation//British J. of Pharmacology -1995. -Vol. 116. -P. 244-245.


