Изучение противофаговой активности дезинфектантов в качестве фактора подавления горизонтальной передачи генов
Автор: Афонюшкин В.Н., Черепушкина В.С., Татарчук О.П., Фролова О.А.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
Ограничение использования антибиотиков в сельском хозяйстве в сочетании с ростом частоты появления антибиотико-резистентных штаммов бактерий стимулирует все более широкое использование бактериофагов в ветеринарии и медицине. Выявление противофаговой активности дезинфектантов имеет самостоятельное значение для медицины, ветеринарии и пищевой промышленности во всем мире. На предприятиях мясной промышленности целесообразно использовать дезинфектанты, снижающие вероятность горизонтального переноса нежелательной генетической информации путем инактивации ДНК, в том числе в составе бактериофагов. Цель исследования - изучение воздействия некоторых дезинфектантов на эффективность фаговой трансдукции E. coli бактериофагом М13. Заражение бактериофагом штамма кишечной палочки с дефектом гена галактозидазы приводило к тому, что колонии E.coli приобретали на среде «Уриселект 4» красную окраску. Изучали противофаговую активность 4 дезинфектантов по способности подавлять перенос гена галактозидазы в E.coli с помощью нелитического бактериофага М13...
Бактериофаг, персульфат калия, глутаральдегид, час, дезинфекция, переработка мяса, антибиотико-резистентность, трансдукция
Короткий адрес: https://sciup.org/140248956
IDR: 140248956 | УДК: 579.62, | DOI: 10.36718/1819-4036-2020-4-88-96
Текст научной статьи Изучение противофаговой активности дезинфектантов в качестве фактора подавления горизонтальной передачи генов
Введение . Общепринято, что биологическая безопасность пищевой продукции зависит от степени удаления загрязнений и бактериальных контаминантов с поверхностей технологического оборудования предприятий мясной отрасли [1]. Тем не менее с развитием знаний о механизмах обмена генетической информацией у бактерий стало очевидно, что биологическая безопасность продукции пищевой промышленности может быть снижена в случае горизонтальной передачи нежелательной генетической информации – генов антибиотикоустойчивости, эндо- и экзотокси-нообразования [2, 3]. Причиной горизонтальной передачи этих генов могут быть и бактериофаги [4]. Использование бактериофагов в медицине началось более 100 лет назад [5] и существенно активизировалось, в том числе и в ветеринарии, в последние годы [6]. Использование антибиотиков чревато накоплением антибиотикоустойчивых штаммов, бактерий, но и применение дезинфицирующих средств может обусловливать развитие перекрестной антибиотикоустойчивости [7]. Использование бактериофагов в качестве альтернативы антибиотикам в сельском хозяйстве представляется все более привлекательным, но научных данных о повышении рисков горизонтальной передачи генов микроорганизмов явно недостаточно.
Учитывая приведенные выше факты, на предприятиях мясной промышленности целесообразно использовать дезинфицирующие средства, не только уменьшающие микробную обсе-мененность обрабатываемых поверхностей, но и снижающие вероятность горизонтального переноса нежелательной генетической информации путем разрушения или инактивации ДНК [2], в том числе в составе бактериофагов [4, 8].
Новизна исследований заключается в анализе противобактериофаговой эффективности ря- да дезинфектантов, используемых на предприятиях по переработке мяса. В научной литературе большое внимание уделено активности дезинфектантов в отношении бактериофагов лактобактерий и лактококков, используемых в молочной промышленности [7, 9].
Цель исследования . Изучение воздействия некоторых дезинфектантов на эффективность фаговой трансдукции E. coli бактериофагом М13.
Задачи : выработать протокол исследований, позволяющий выявлять дезинфектанты, подавляющие фаговую трансдукцию; оценить активность дезинфектантов: «Экоцид», «Вирекс», «Вирошелд», формалин в отношении бактериофагов; изучить действие животного жира на противобактериофаговую активность Формалина, «Вирекса», «Вирошелда», «Экоцида».
Методы. Исследования проводили в секторе молекулярной биологии Сибирского федерального научного центра агробиотехнологий СО РАН. Для исследований использовали дезинфектанты: «Вирошелд» (15 % глутарового альдегида и 10 % алкилдименилбензил аммония), «Вирекс» (сульфаминовая кислота, калия пероксомоносульфат, дихлоризоцианурат), «Экоцид С» (калия пероксомоносульфат) и формалин (формальдегид). Также использовали референтный штамм E. coli XL-1Blue (Promega). Бактериофаг М13 культивировали на детекторных штаммах E. coli (ХL Blue) без гена бета-галактозидазы, руководствуясь общепринятыми методами работы с нелитическими бактериофагами [10]. Наличие бета-галактозидазной активности при трансдукции и трансформации определяли на среде «Уриселект 4» (Био-Рад) [11]. Оценку защиты изучаемого объекта в присутствии жиров проводили в соответствии с методическими указаниями [12]. Все исследования проводили в трех повторностях. Полученные цифровые данные обрабатывали методами вариационной статистики, достоверность различий определяли с использованием t-критерия Стьюдента [13].
Результаты и их обсуждение. Бактериофаг М13 – нелитический бактериофаг, геном которого представлен кольцевой одноцепочечной ДНК, размножающийся в E. coli , имеющей F пили [14]. Заражение бактериофагом штамма кишечной палочки с дефектом в отношении гена галактозидазы приводит к тому, что колонии E. coli приобретают на среде «Уриселект 4» красную окраску.
Количество красных колоний кишечной палочки будет равно количеству фаговых частиц, что позволяет использовать этот метод для оценки противовирусной активности дезинфектантов.
В работе изучали противофаговую активность 4 дезинфектантов: «Вирошелд», «Ви-рекс», «Экоцид С» (Экоцид) и формалин.
Протокол исследований:
-
1. Дезинфекционные средства развели до 1 %-й концентрации дистиллированной водой.
-
2. В качестве интактного контроля использовали дистиллированную воду.
-
3. Внесли по 100 мкл разведенных дезинфектантов в 96-луночный микропланшет и добавили 10 мкл препарата бактериофага М13 (титр 3,6 + 0,015х1012log инфекционных фаговых частиц/мл).
-
4. Инкубировали 30 минут (при комнатной температуре).
-
5. Для минимизации воздействия дезинфектантов на бактерии приготовили суспензию из суточной культуры E. сoli (штамм, восприимчивый к бактериофагу М13) в объеме 1 мл и к ней добавили по 10 мкл обработанного дезинфектантами бактериофага (при этом концентрации дезинфектантов становились ниже значений, способных ингибировать рост и метаболическую активность бактериальных клеток).
-
6. Инкубировали 10 минут при комнатной температуре.
-
7. Развели еще в 10 раз и сделали посев на секторальную чашку со средой «Уриселект 4» в объеме 100 мкл.
-
8. Культуры инкубировали в термостате 18 часов при температуре 37 °С и в дальнейшем хранили при комнатной температуре до появления окрашивания колоний.
Для оценки влияния протективного действия животного жира против активности дезинфектантов в отношении бактериофага М13 применяли подкожный жир свиньи, который предварительно наносили в количестве 50 мг в лунку планшета и распределяли по поверхности ее стенок. Схема исследований была следующая:
– в 24-луночный микропланшет, предварительно обработанный жиром животного происхождения, добавили 50 мкл бактериофага М13, инкубировали 20 минут при комнатной температуре;
– в отдельные лунки в трех повторностях добавили по 200 мкл образцов исследуемых де- зинфектантов: «Вирошелд», «Вирекс», «Экоцид С» и формалин, в концентрации 1 %;
– в качестве интактного контроля использовали дистиллированную воду (по 200 мкл);
– инкубировали 30 минут при комнатной температуре;
– приготовили суспензию из суточной культуры E. сoli (детекторный штамм для бактериофага М13) в объеме 1 мл и к ней добавили по 10 мкл обработанного дезинфектантами бактериофага;
– инкубировали 10 минут (малый объем инокулята позволил исключить действие дезинфектантов на детекторный штамм);
– пробы (культуры кишечной палочки после заражения бактериофагом) развели еще в 10 раз и сделали посев на секторальную чашку со средой «Уриселект 4» в объеме 100 мкл;
– поставили в термостат на 18 часов при температуре 37 °С и в дальнейшем хранили при комнатной температуре до появления окрашивания колоний (рис. 1, 2).
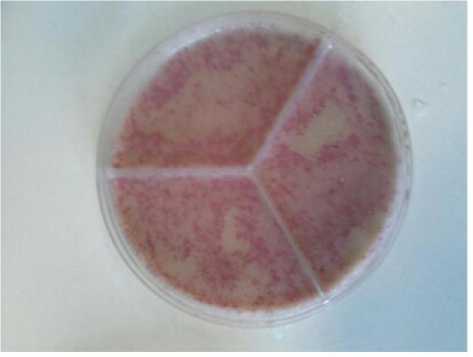
Рис. 1. Культуры E. coli после трансдукции бактериофагом М13, обработанным 1%-м формалином

Рис. 2. Культуры E. coli после трансдукции с бактериофагом М13, обработанным 1 % «Экоцид С»
Дезинфектанты «Экоцид С», «Вирекс» и «Вирошелд» в 1%-й концентрации обладают высокой дезинфицирующей активностью в отношении бактериофага М13 (табл. 1, 2), что выражается в уменьшении количества окрашен- ных в красный цвет колоний кишечной палочки. При этом на среде «Уриселект 4» росли исключительно незараженные бактериофагом бесцветные колонии E. coli.
Таблица 1
Концентрация частиц бактериофага М13 Log10/мл после обработки дезинфектантами (M ± m)
|
Дезинфектант |
Опыт без жира |
Опыт с жиром |
|
Вирошелд 1 % |
3,3 + 1,18* |
0 + 0 |
|
Вирекс 1 % |
0 + 0 |
0 + 0 |
|
Экоцид С/Экоцид 1 % |
0 + 0 |
0 + 0 |
|
Формалин 1 % |
8,38 + 0,27* |
8,95 + 0,07 |
|
Контроль |
9,99 + 0,22 |
8,79 + 0,22 |
* P <0,05.
Эффективность инактивации бактериофага М13 дезинфектантами, %
Таблица 2
|
Дезинфектант |
Опыт без жира |
Опыт с жиром |
|
Вирошелд 1% |
99,999 |
100 |
|
Вирекс 1% |
100 |
100 |
|
Экоцид С/Экоцид 1% |
100 |
100 |
|
Формалин 1 % |
97,54 |
0 |
Фаговая трансдукция может приводить к горизонтальному переносу генов антибиотикоре-зистентности, поэтому выявление противофаго-вой активности дезинфектантов может иметь и самостоятельное значение. Так, 87 протеинов кишечной палочки непосредственно связаны с фагами, плазмидами и транспозонами. Наиболее важным и заметным примером переноса функционально значимых генов является появление шиготоксинов (веротоксинов) в кишечной палочке, в частности E. coli O157H7 [15]. Именно веротоксигенные формы кишечной палочки отличаются наибольшей патогенностью для людей [16], и нельзя исключить вероятности появления новых токсигенных штаммов, обусловленных фаговой трансдукцией.
Как следует из результатов наших исследований, такие современные дезинфекционные средства, как «Экоцид С» (Экоцид), «Вирекс» и «Вирошелд», способны оказывать выраженное инактивирующее воздействие в отношении фаговых частиц в сравнении с формалином и интактным контролем (табл. 2). Относительно низкая эффективность формальдегида может быть объяснена обратимостью действия альдегидов на белки. Взаимодействие альдегидов с аминогруппами с образованием основания Шиффа и последующими реакциями с другими аминогруппами, низкомолекулярными органическими соединениями может носить обратимый харак- тер, особенно при снижении концентрации альдегидов [17]. С другой стороны, фаговые частицы, в отличие от бактерий, в своем составе преимущественно имеют структурные белки небольших размеров, функции которых часто не требуют структурных изменений, подвижности молекулярных цепочек, конформационных перестроек. Следовательно, можно предполагать меньшую эффективность альдегидов применительно к вирусам и бактериофагам в сравнении с бактериальными клетками. Широкое разнообразие белков в бактериальной клетке, множество ферментов, регуляторных белков, на наш взгляд, повышают вероятность гибели бактериальной клетки при инактивации низкокопийных белков с ферментативными или регуляторными активностями. Четвертичные аммонийные соединения также не повреждают белки, а влияют на их вторичную и третичную структуру, действуя как катионные детергенты [2]. Соответственно, вероятность рефолдинга при снижении концентрации ЧАС, остается, но шансов восстановления вторичной и третичной структуры всех функционально значимых белков в протеоме бактерии или бактериофаге, на наш взгляд, немного. Действие «Экоцида С» (Экоцида) основано на окислительном действии персульфата калия, носит необратимый характер и затрагивает самые разные органические молекулы и биополимеры, включая ДНК [3], что также может объяснять его большую противофаговую (противовирусную) эффективность в сравнении с альдегидами. Из литературных данных известна сравнительно более высокая противофаго-вая активность окисляющих агентов и четвертичных аммонийных соединений в сравнении со спиртами, хлор- и йодсодержащими дезинфицирующими средствами [18, 19]. Физические методы инактивации бактериофагов относительно эффективны [20], но остается риск сохранения ДНК бактериофагов.
Использование дезинфицирующих средств с обратимым действием на биополимеры бактерий создает риск сохранения генетической информации, содержащей гены антибиотикорези-стентности и/или патогенности в виде неповрежденной ДНК [3, 21–24] или в составе фаговых частиц, повышая риск горизонтальной передачи генов патогенности [25].
Теоретически использование на мясоперерабатывающих предприятиях дезинфектантов с противофаговой активностью могло бы быть актуальным в случае их достаточной эффективности для минимизации риска распространения генов антибиотикорезистентности и патогенности бактерий через продукты питания человеку (однако подобная рекомендация требует изучения противофаговой эффективности дезинфектантов на популяционном уровне).
Таким образом, мы пришли к следующим выводам:
-
1. Дезинфектанты «Экоцид С» (Экоцид), «Вирекс» и «Вирошелд» в 1 %-й концентрации инактивируют фаговые частицы.
-
2. 1 %-й раствор формалина снижает количество фаговых частиц в 1 мл на 1,61 Log10 при отсутствии животного жира, и его активность подавляется в присутствии жира.
-
3. 1 %-й раствор «Вирошелд» снижает количество фаговых частиц вне зависимости от наличия животного жира.
-
4. 1 %-е растворы «Экоцид С» и «Вирекс» полностью разрушают фаговые частицы.
-
5. Протективного действия животного жира в отношении повреждающей активности дезинфектантов «Экоцид С» (Экоцид), «Вирекс» и «Вирошелд» не обнаружено.
Список литературы Изучение противофаговой активности дезинфектантов в качестве фактора подавления горизонтальной передачи генов
- Salvat G., Colin P. Cleaning and disinfection practice in the meat industries of Europe // Rev Sci Tech. 1995 Jun;14(2):313-41.
- Verraes C., Van Boxstael S., Van Meervenne E., Van Coillie E., Butaye P., Catry B., de Schaetzen M.-A., Van Huffel X., Imberechts H., Dierick K., Daube G., Saegerman C., De Block J., Dewulf J., Herman L. Antimicrobial Resistance in the Food Chain: A Review // Int. J. Environ. Res. Public Health 2013, 10. P. 2643-2669.
- Афонюшкин В.Н., Табанюхов К.А, Черепушкина В.С. [и др.]. Влияние дезинфицирующих средств на основе персульфата калия, перекиси водорода, глутаральдегида и четвертичных аммонийных соединений на генетический материал бактериальных патогенов, специфичных для мясоперерабатывающей промышленности // Развитие биотехнологических и постгеномных технологий для оценки качества сельскохозяйственного сырья и создания продуктов здорового питания: мат-лы 18-й Междунар. науч.-практ. конф. М., 2015. Т. 1. С. 52-59.
- Allué-Guardia A., Martínez-Castillo A., Munie-sa M. Persistence of infectious Shiga toxin-encoding bacteriophages after disinfection treatments. Appl. Environ. Microbiol. 2014; 80:2142 - 2149. Doi: 10.1128/AEM.04006-13.
- D’Herelle F. Sur un microbe invisible antago-niste des bacilles dysentériques. CR Acad. Sci. Paris. 1917; 165:373-375.
- García P., Martínez B., Obeso J. M., and Rodríguez A. (2008). Bacteriophages and their application in food safety. Lett. Appl. Microbiol. 47, 479-485.
- DOI: 10.1111/j.1472-765X.2008.02458.x
- Hernández A., Ruiz F.M., Romero A., Martínez J.L. (2011). The binding of triclosan to SmeT, the repressor of the multidrug efflux pump SmeDEF, induces antibiotic resistance in Stenotro-phomonas maltophilia. PLoS Pathog. 7:e1002103.
- DOI: 10.1371/journal.ppat.1002103
- Hawkshead Lane Phage Transduction // Methods Mol Biol. 2016; 1476:177-85.
- DOI: 10.1007/978-1-4939-6361-4_13
- De Melo A.G., Levesque S., Moineau S. Phages as friends and enemies in food processing. Curr. Opin. Biotechnol. 2017; 49:185-190.
- DOI: 10.1016/j.copbio.2017.09.004
- Маниатис Фрич Э., Сэмбрук Дж. Молекулярное клонирование. М.: Мир, 1984. 479 с.
- Perry J.D., Butterworth L.A., Nicholson A., Appleby M.R., Orr K.E. Evaluation of a new chromogenic medium, UriSelect4, for the isolation and identification of urinary tract pathogens // J. Clin. Pathol 2003. Vol. 56: P. 528-553.
- Методические указания по оценке эффективности дезинфицирующих средств, предназначенных для обеззараживания различных объектов и санитарной обработки людей. Утв. МЗ СССР 20 августа 1970 г. № 859-70. М., 1970.
- Student. The probable error of a mean // Biometrika. 1908. № 6 (1). P. 1-25.
- Fernández L., Escobedo S., Gutiérrez D., Portilla S., Martínez B., García P., Rodríguez A. Bacteriophages in the dairy environment: From enemies to allies. Antibiotics. 2017;6:E27.
- DOI: 10.3390/antibiotics6040027
- Donnelly A., Yata T., Bentayeb K. i, Suwan K., Hajitou A. Bacteriophage Mediates Efficient Gene Transfer in Combination with Conventional Transfection Reagents // Viruses. 2015 Dec; 7(12): 6476-6489.
- DOI: 10.3390/v7122951
- Blattner F.R., Plunkett G, Bloch C.A., Perna N.T., Burland V., Riley M., Collado-Vides J., Glasner J.D., Rode C.K., Mayhew G.F., Gregor J., Davis N.W., Kirkpatrick H.A., Goeden M.A., Rose D.J., Mau B., Shao Y. The complete genome sequence of Escherichia coli K-12// Science. 1997 Sep 5;277(5331). P. 1453-62.
- Karch H., Tarr P., Bielaszewska M. Enterohaemorrhagic Escherichia coli in human medicine // Int J Med Microbiol. Vol. 295. Vyp. 6-7. P. 405-18.
- Campagna C., Villion M., Labrie S.J., Duchaine C., Moineau S. Inactivation of dairy bacteriophages by commercial sanitizers and disinfectants. Int. // J. Food Microbiol. 2014; 171:41-47. 10.1016/j.ijfoodmicro. 2013.11.012.
- DOI: 10.1016/j.ijfoodmicro.2013.11.012
- Hayes S., Murphy J., Mahony J., Lugli G.A., Ventura M., Noben J.P., Franz C.M., Neve H., Nauta A., van Sinderen D. Biocidal inactivation of Lactococcus lactis bacteriophages: Efficacy and targets of commonly used sanitizers. Front. Microbiol. 2017; 8:107. 10.3389/fmicb. 2017.00107.
- DOI: 10.3389/fmicb.2017.00107
- Atamer Z., Dietrich J., Müller-Merbach M., Neve H., Heller K.J., Hinrichs J. Screening for and characterization of Lactococcus lactis bacteriophages with high thermal resistance. Int. Dairy J. 2009; 19:228-235. 10.1016/ j.idairyj.2008.10.012.
- DOI: 10.1016/j.idairyj.2008.10.012
- Balson E.W., Lawson A. The potentiometric determination of polypeptides and aminoacids: The formaldehyde titration // Biochem J. 1936 Jul; 30(7), P.1257-1263.
- Jia Zhishen; Shen Dongfeng; Xu Weiliang (2001). Synthesis and antibacterial activities of quaternary ammonium salt of chitosan // CarbohydrateResearch333 (1): 1-6.
- DOI: 10.1016/S0008-6215(01)00112-4
- Bauer T., Hammes W.P., Haase N.U., Hertel C. Effect of food components and processing parameters on DNA degradation in food // Environ. Biosaf. Res. 2004, 3, P. 215-223.
- Straub J.A., Hertel C., Hammes W.P. A 23S rDNA-targeted polymerase chain reaction-based system for detection of Staphylococcus aureus in meat starter cultures and dairy products // J. Food Protect. 1999, 62, P.1150-1156.
- Афонюшкин В.Н., Юшков Ю.Г., Донченко А.С. [и др.]. Обнаружение генов патогенности и антибиотикорезистентности S. enterica у некоторых микроорганизмов сем. Enterobacteriaceae // Вестник российской сельскохозяйственной науки. 2012. № 2. С. 67-69.


