Изучение распространения условных генотипов вируса лейкоза крупного рогатого скота
Автор: Батенва Н.В., Смирнов П.Н., Михнович И.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная вирусология
Статья в выпуске: 4 т.47, 2012 года.
Бесплатный доступ
Методом полимеразной цепной реакции (ПЦР) исследовали 762 пробы крови от животных разных пород крупного рогатого скота, больных и инфицированных вирусом лейкоза крупного рогатого скота (ВЛ КРС). При помощи программы Vector NTI были подобраны эндонуклеазы рестрикции. На основании данных, полученных при анализе полиморфизма длин рестрикционных фрагментов (ПДРФ-анализ), по типам паттернов выделили 11 групп, обозначенных как условные генотипы.
Вирус лейкоза крупного рогатого скота (вл крс), генотипы, эндонуклеаза рестрикции, полимеразная цепная реакция, породы крупного рогатого скота, р24
Короткий адрес: https://sciup.org/142133332
IDR: 142133332 | УДК: 636.2:619:616.155.392
Текст научной статьи Изучение распространения условных генотипов вируса лейкоза крупного рогатого скота
Генотипическая неоднородность вируса лейкоза крупного рогатого скота (bovine leukemia virus — BLV), носительство которого регистрируют как в России, так и за рубежом, продолжает вызывать интерес не только в общебиологическом, но и в прикладном аспекте. В то же время следует отметить, что этой проблеме посвящено ограниченное число публикаций, в силу чего сложить более или менее определенное мнение по проблеме затруднительно (1-13). Вместе с тем появляются сообщения об особенностях течения лейкозной инфекции, ее этиологическом агенте (3, 5, 7), о высокой степени агрессивности некоторых генотипов BLV (2).
Большинство авторов изучали BLV по env -гену и только некоторые исследования выполнены по gag -гену (1, 2, 6, 7, 10). Сведений по вариабельности гена gag BLV в доступной научной литературе мы не обнаружили. При этом идентифицировать вирус в организме животных по гену gag удается на 5-7 мес раньше, чем по гену env (3, 4).
Мы попытались охарактеризовать генотипическую вариабельность у вируса лейкоза крупного рогатого скота по gag -гену.
Методика . Исследовали 762 пробы крови от животных разных пород крупного рогатого скота, содержащихся на сельскохозяйственных предприятиях Краснодарского края (2006-2009 годы) и серопозитивных в реакции иммунодиффузии (РИД+) со штаммом gp 51 BLV.
ДНК провируса лейкоза выделяли из лейкоцитов крови сорбентным методом с использованием набора Diatom DNA Prep 100 (ООО Лаборатория «Изоген», Россия) в соответствии с рекомендациями изготовителя. Для ПЦР использовали наборы GenePak™ PCR test (OOO Лаборатория «Изоген», Россия), включающие положительный и отрицательный контроли для вируса лейкоза ( gag ).
При выполнении ПЦР режим амлификации, предложенный M.R. Mo-hammadabadi (10), оптимизировали, исходя из ожидаемой длины фрагмен- та. Число циклов элонгации подбирали эмпирически для наиболее высокого выхода специфичного ампликона при минимальном содержании неспецифических фрагментов. Реакцию проводили в амплификаторе Mastercycler Gradient (фирма «Eppendorf AG», Германия). Объем реакционной смеси — 40 мкл, температурно-временной режим: начальная денатурация при 94 °C в течение 3 мин; 42 цикла (денатурация при 94 °C — 15 с, отжиг при 58 °C — 15 с, элонгация при 72 °C — 30 с); финальная элонгация при 72 °C в течение 3 мин.
Для выявления вирусоносителей по гену gag (p24) (ожидаемая длина фрагмента 347 п.н.) применили олигонуклеотидные праймеры 5'-GGA GGW GGR AAG ATG CGA ACT ATT-3' и 5'-GTC CGY TCT ACY AAC CCT GAA CTT-3' (10). Праймеры синтезировали в лаборатории «МедиГен» (г. Новосибирск). Дизайн праймеров осуществлен, исходя из последовательности полноразмерной копии гена gag , взятой из базы данных NSBI (National Center for Biotechnology Information, gi40796166, NP_777381.1).
При анализе структуры наиболее вариабельных участков (с целью подбора эндонуклеаз рестрикции для оценки их полиморфизма) использовали программу Vector NTI.
Результаты . Длина области gag -гена, фланкированная специфичными праймерами, составляла 347 п.н. На рисунке 1 приведена типичная электрофореграмма продуктов амплификации, свидетельствующая о наличии провирусной ДНК (интегрирована в ДНК клетки животного-хозяина). Во всех анализируемых образцах ДНК диагностировался фрагмент, соответствующий расчетной длине ампликона (347 п.н.).
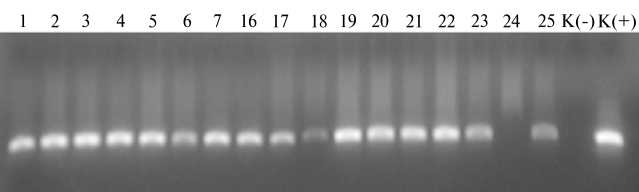
Рис. 1. Типичная электрофореграмма продуктов ПЦР-амплификации области гена gag провирусной ДНК вируса лейкоза крупного рогатого скота (347 п.н.) , полученных с использованием образцов ДНК (1-25) обследованных животных красной степной породы (CПK «Колос», Краснодарский край, Динский р-н) : К( - ) — отрицательный контроль, К(+) — положительный контроль (GenePak™ PCR test, OOO Лаборатория «Изоген», Россия).
ПЦР-анализ наличия провирусной ДНК у крупного рогатого скота с использованием праймеров, специфических для области gag -гена размером 347 п.н., показал (табл. 1), что доля РИД-серопозитивных животных с отрицательным результатом в ПЦР составляла 2,6 %.
1. Наличие провирусной ДНК вируса лейкоза крупного рогатого скота (область гена gag , 347 п.н.) , выявляемой методом ПЦР у животных, серопозитивных в реакции иммунодиффузии (РИД) (Краснодарский край, 2006-2009 годы)
|
Порода крупного рогатого скота |
Число животных, гол. |
||
|
РИД+ 1 |
РИД+, ПЦР+ I |
РИД+, ПЦР - |
|
|
Черно-пестрый голштинизированный скот |
284 |
263 |
21 |
|
Красная степная |
255 |
244 |
11 |
|
Айрширский скот |
223 |
217 |
6 |
|
Всего |
762 |
724 |
38 |
П р и м е ч а н и е. Черно-пестрый голштинизированный скот — ЗАО «Агроном», красная степная порода — CПK «Колос», айрширский скот — ПЗ «им. В.И. Чапаева».
При изучении структуры последовательностей gag-гена, имеющих- ся в ресурсе NSBI, проанализировали данные для 11 изолятов BLV, в результате чего были выявлены наиболее вариабельные участки gag-гена. На этом основании для оценки полиморфизма длин рестрикционных фрагментов выбрали две эндонуклеазы (HaeIII и FaeI). Процедура определения полиморфизма длин рестрикционных фрагментов была предварительно оптимизирована: ПЦР — по критерию максимального выхода ампликона, ПДРФ — по полноте гидролиза, электрофоретическое разделение — по параметрам режима, обеспечивающим наибольшую четкость паттернов. Для генотипирования с использованием ограниченной панели с ДНК от животных, серопозитивных к BLV в РИД, образцы (по 10 из каждой панели) отбирали случайным образом, в результате чего на панели располагались изоляты от особей разной породной и территориальной принадлежности. Пример электрофореграммы продуктов гидролиза ампликона рестриктазой HaeIII представлена на рисунке 2.
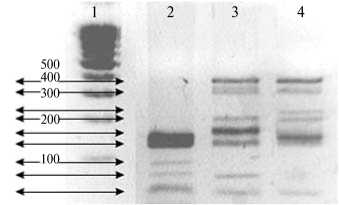
Рис. 2. Пример электрофореграммы продуктов гидролиза эндонуклеазой рестрикции HaeIII ам-ликонов (347 п.н.) гена gag вируса лейкоза крупного рогатого скота , полученных с использованием провирусной ДНК из лейкоцитов цельной крови животных: 1 — маркер молекулярных масс (ООО Лаборатория «Медиген», г. Новосибирск), 2-4 — опытные образцы (случайная выборка; соответственно II, X и IV условные генотипы провируса).
Метод использовали для исследования черно-пестрого голштинизированного скота (ЗАО «Агроном»), животных красной степной породы (СПК «Колос») и айрширского скота (ПЗ «им. В.И. Чапаева») (Краснодарский край, 2006-2009 годы).
Сравнивая фактические и ожидаемые спектры продуктов гидролиза, мы условно разделили изученные варианты вируса BLV по полиморфизму gag -гена. При гидролизе рестриктазой HaeIII можно визуализировать не менее 8 групп паттернов, Fae I — 4 группы, включая вариант, в котором отсутствуют сайты рестрикции. То есть всего с использованием двух рестриктаз можно выделить не менее 11 условных генотипов, регистрируемых у изученных групп крупного рогатого скота: 8 — у животных айрширской породы, 6 — у черно-пестрого голштинизированного и 3 — у красного степного скота. При этом у животных всех обследованных пород были зарегистрированы три одинаковых условных генотипа провируса — I, II и III (табл. 2).
2. Распределение (%) условных генотипов вируса лейкоза крупного рогатого скота (по гену gag ) в обследованных хозяйствах Краснодарского края (2006-2009 годы)
Хозяйство, порода
ЗАО «Агроном», красная степная СПК «Колос», черно-пестрый голштинский скот
ПЗ «им. В.И. Чапаева», айрширская В среднем
Условный генотип
I II III I IV I V I VI I VII I VIII IX I X I XI 17 8 75 - - - - -- - -
44 12 6 6 13 19 — - - --
40 6 6 - - - 7 20 7 77
36 10 27 2 5 7 2 7 2 22
П р и м е ч а н и е. Прочерки означают, что вариант не выявлялся.
Таким образом, нами изучено распространение условных генотипов вируса лейкоза крупного рогатого скота (BLV) по gag -гену в трех хозяйствах Краснодарского края. Среди инфицированных BLV животных наибольшее разнообразие генотипов провируса BLV было выявлено у крупного рогатого скота айрширской породы, наименьшее — у животных
красной степной породы. Следовательно, можно предположить наличие взаимосвязи между породной принадлежностью и восприимчивостью животного к определенному генотипу BLV по gag-гену.
Л И Т Е Р А Т У Р А
-
1. Ч и ч и н и н а С.В. Роль аллельной вариабельности генов цитокинов в формировании резистентности крупного рогатого скота к лейкозу. Автореф. канд. дис. Новосибирск, 2005.
-
2. Д р о б о т Е.В. Результаты изучения генотипического разнообразия вируса лейкоза крупного рогатого скота и особенности эпизоотологического и гематологического проявления. Автореф. канд. дис. Новосибирск, 2007.
-
3. Иванов О.В., Федотов В.П., Крючкова Е.Н. Об эффективности серодиагностики лейкоза коров при трематодозной инвазии. С.-х. биол., 2009, 2: 111-113.
-
4. Крикун В.А. Лейкоз крупного рогатого скота и иммунологическая толерантность. Ветеринария, 2002, 6: 7-9.
-
5. С м и р н о в П.Н. Болезнь века — лейкоз крупного рогатого скота. Новосибирск, 2007.
-
6. С м и р н о в П.Н., Г р а ч е в а Н.В., Б е л я в с к а я В.А. Генотипическое разнооб
разие вируса лейкоза крупного рогатого скота разной породной принадлежности. Аграрный вестник Урала, 2009, 4: 89-91.
-
7. П е т р о п а в л о в с к и й М.В., Д о н н и к И.М., Т а т а р ч у к А.Т. Методология снижения инфицированности животных вирусом лейкоза в оздоравливаемых стадах крупного рогатого скота. Екатеринбург, 2009.
-
8. Y a n g D., S n a n k s R.D., S t e w a r t J.A., L e w i n H.A. Milk and fat yields decline in bovine leukemia virus-infected Holsten cattle with persistant lymphocytosis. PNAS USA, 1993, 90: 6538-6541.
-
9. B e i e r D., S i a k k o u H.A. Comparison of serological tests for the diagnosis of enzootic bovine leukosis and eradication of infection from a large herd. Tierarztliche umschau., 1994, 49(6): 356-360.
-
10. Mohammadabadi M.R. Detection of bovine leukemia virus proviral DNA in Yaroslavl’, Mongolian and Black pied cattle by PCA. Cell. Mol. Biol. Lett., 2004, 9(4A): 766-768.
-
11. R i e b e R., B l a n k e n s t e i n P., S t a r i c k E., B o n d z i o A. Establishment of a new bovine leucosis virus producing cell line. J. Virol. Meth., 2004, 121(2): 239-246.
-
12. J o h n s t o n E.R., A l b r i 11 o n L., R a d k e K. Envelope proteins containing single amino acid substitutions support a structural model of the receptor-binding domain of bovine leukemia virus surface protein. J. Virol., 2002, 76(21): 10861-10872.
-
13. L i c u r s i M., I n o s h i m a Y., Y o k o y a m a T., G o n z a l e s E., S e n t s u i H. Genetic heterogeneity bovine leukemia virus genotypes and its relation to humoral responses in hosts. Virus Res., 2002, 86: 101-110.
ФГБОУ ВПО Новосибирский государственный аграрный университет,


