Изучение реакции комплексообразования аскорбиновой кислоты с ионами цинка и меди (II)
Автор: Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р.
Статья в выпуске: 2 т.222, 2015 года.
Бесплатный доступ
Изучена реакция комплексообразования аскорбиновой кислоты с ионами цинка и меди (II). Найдены оптимальные условия синтеза аскорбатов цинка и меди (II) с хорошими выходами, что позволяет исследовать их биологическую активность. Показано, что для обеспечения стабильности аскорбиновой кислоты реакцию необходимо проводить в кислой среде.
Аскорбиновая кислота, аскорбаты цинка, меди (ii)
Короткий адрес: https://sciup.org/14288524
IDR: 14288524 | УДК: 547.461.4
Текст научной статьи Изучение реакции комплексообразования аскорбиновой кислоты с ионами цинка и меди (II)
Природная биологически активная аскорбиновая кислота имеет L-конфигурацию и представляет собой у-лактон (белые кристаллы, т. пл. 190-192 О С, растворимые в воде).
В водных растворах аскорбиновая кислота дает кислую реакцию (для 0,1н раствора рН 2,2). Кислые свойства аскорбиновой кислоты определяются главным образом гидроксильной группой в положении 3. Частично за кислую реакцию ответственна гидроксильная группа в положении 2. Наличие в аскорбиновой кислоте двух сопряженных двойных связей обусловливает ее способность к обратимому окислению, продуктом которого является дегидроаскорбиновая кислота (ДАК – бесцветные кристаллы, т. пл. 222-225 ос, хорошо растворимые в воде). В сильно щелочных условиях лактонная связь в ДАК разрывается и она превращается в 2,3-дикето-L-гулоновую кислоту [Аскорбиновая кислота. Химические и физические свойства витамина С. Электронная медицина]. Эта реакция необратима.
-
L- аскорбиновая кислота восстанавливает окисленные формы ферментов, окисляясь в ДАК, обратимо легко регенерующуюся в аскорбиновую кислоту под действием глутатиона (трипептида) за счет его сульфогидрильной
группы. Окисление аскорбиновой кислоты катализируется ионами меди, в меньшей степени – ионами серебра и железа. [Строение и физико-химические свойства аскорбиновой кислоты – allRefs. net > Биология «17 klb / p4»].
Аскорбиновая кислота принимает участие в некоторых важных окислительных процессах, например в качестве второго донора электронов при окислении остатков пролина в проколлагене до гидроксипролина. При этом она превращается в ДАК, которая восстанавливается до аскорбата с помощью специальной редуктазы [1].
Аскорбиновая кислота (витамин С) способствует здоровому функционированию митохондрий, стимулирует иммунную систему для производства интерферона. Витамин С содействует преобразованию аминокислот в нейротрансмиттеры, снижает окислительное повреждение генов.
Аскорбиновая кислота важна для поддержания здоровья и нормального роста сельскохозяйственных животных как лекарственный препарат. Она назначается животным в профилактических и лечебных целях при гиповитаминозе С, нарушении обмена веществ, инфекционных болезнях и др. [Ветеринария].
В ветеринарийной и медицинской практике в лечебных целях используются комплексные соединения аскорбиновой кислоты с биогенными металлами.
Для лечения онкологических заболеваний разработаны нормы потребления минеральных аскорбатов, в том числе аскорбата цинка ~ 40 мг/сут., аскорбата марганца – 11 мг/сут. [Новые технологии в Германии. Лечение онкологических заболеваний. Центр Гамманож. Мюнхен].
Создан интерактивный мультивитаминный комплекс (супервитаминный) Activite (МНР), содержащий также аскорбаты кальция, магния, калия, цинка, меди, марганца, хрома [для спортсменов. Activite (МНР )– Maximum Human Performance. США. Megasila. ru > product 4403. html].
Аскорбат цинка входит в состав БАД к пище для взрослых: L-аскорбиновая кислота, L-аскорбаты натрия, калия, кальция, магния, цинка, аскорбил– пальмитат [Формы витаминов и минеральных солей для использования при производстве БАД к пище для взрослых. Приложение 10 к техническому регламенту Таможенного союза « О безопасности пищевой продукции»].
Аскорбат цинка, как биогенный препарат, рекомендован в качестве кормовой добавки для кормления сельскохозяйственных животных и птицы. Препарат способствует повышению продуктивности и сохранности поголовья [2].
Изучена фармакология и токсикология аскорбатов калия, железа, цинка, марганца, кобальта. Установлено, что препараты нетоксичные (Классификация К.К. Сидорова) и рекомендованы в качестве лечебно-профилактических средств при гипомикроэлементозах и для повышения продуктивности животных [3].
При взаимодействии аскорбата цинка с 1-этилимидазолом получен комплекс асказол (брутто формула С 16 Н 22 N 4 O 6 Zn), который повышает устойчивость организма к действию диоксида азота и обладает цитопротекторным и антигипоксическим действием.
Синтез аскорбата цинка при этом осуществляется действием водным раствором аскорбиновой кислоты на водную суспензию гидроксида цинка при 60 О С с последующим перемешиванием реакционной смеси в течение 6 часов при 50 ОС. Не вступивший в реакцию гидроксид цинка фильтруют, водный фильтрат упаривают в вакууме. Целевой продукт выделяют смесью ацетона и эфира с выходом 75,3 % в виде порошка желтого или желто-оранжевого цвета, растворимого в воде; температура плавления 104 о с [4].
Имеется сообщение об использовании аскорбата меди (II) для инактивации вирусов: простого герпеса 1-го и 2-го типа, цитомегаловируса и вируса пара-гриппа [Лечебные свойства витамина С против герпеса. hedlth-scince-report. сom. > alotek /topies 6/.].
О методиках синтеза аскорбата меди (II) сообщения в литературе малочисленны.
На форуме химиков (20.11.2013) обсуждался способ получения аскорбата меди (II) из аскорбата натрия. При этом рассматривались разные варианты синтеза:
– при постепенном приливании аскорбата натрия к купоросу будет последовательно получаться аскорбат меди (II) в смеси с основным сульфатом меди;
– при избытке аскорбата начнутся процессы комплексообразования и восстановления ионов Сu2+ до Сu1+;
– при обратном порядке слива реагентов, когда соль меди в недостатке, комплексообразование с восстановлением начнутся сразу.
В щелочной среде протекают процессы:
2CuSO 4 + С б Н 8 0 б + 4NaOH ^ C^O^ + С б Н б О б + 2Na 2 SO 4 + ЗН 2 О аскорбиновая (ДАК)
кислота
Аскорбат натрия окисляется до дегидроаскорбиновой кислоты (ДАК), а ионы меди (II) восстанавливаются до ионов меди (I) с выпаданием осадка красного цвета Cu 2 O [Аскорбат Na-CuSO 4 / Форум химиков > 20.11.2013. Chemport ru > форум химиков > viewtopic. php…].
Как следует из литературных источников, аскорбаты цинка, меди (II) являются перспективными биологически активными веществами, но технологичные способы их получения отсутствуют.
В связи с этим нами проведены экспериментальные исследования по изучению реакции комплексообразования аскорбиновой кислоты с ионами цинка и меди (II).
Материалы и методы. Для изучения реакции комплексообразования были использованы следующие реактивы: аскорбиновая кислота, имп. «ч». «Экофарм»; сульфаты: ZnSO 4 • 7H 2 O, CuSO 4 • 5H 2 O марки «хч».
-
1. Синтез аскорбата цинка . Раствор 4,07 г (0,0142 моль) сульфата цинка, ZnSO 4 • 7H 2 O в 15 мл воды (рН 3) нагревают до 4550 О С в течение 20 минут. К гомогенному раствору гидролизата (рН 2) присыпают порциями 5 г (0,0284 моль) аскорбиновой кислоты, перемешивают до полного растворения и нагревают реакционную смесь до 45-50 о с 30 минут (рН 1-2). Затем выдерживают при комнатной температуре 2 часа. Бесцветный гомогенный раствор упаривают, кристаллический продукт промывают этанолом. Проводят качественный контроль на содержание сульфат-анионов (с BaCl 2 ) и сушат при комнатной температуре.
-
2. Синтез аскорбата меди (II). а) Раствор 3,4 г (0,0142 моль) сульфата меди (II), CuSO 4 • 5H 2 O в 15 мл воды (рН 3) нагревают до 40-45 о с в течение 20 минут. К гомогенному раствору гидролизата (рН 2) присыпают по частям 5 г (0,0284 моль) аскорбиновой кислоты, перемешивают до полного растворения, нагревают реакционную смесь до 40-45 о с 30 минут (рН 1-2) и выдерживают при комнатной температуре в течение 2-3х часов. При этом реакционная смесь приобретает светлозеленый цвет и на дне колбы осаждается незначительное количество осадка красного цвета Сu 2 O. Реакционную смесь фильтруют, гомогенный раствор упаривают и получают кристаллический продукт голубого цвета с примесью зеленой густой жидкости. Сырец промывают несколько раз спиртом, голубые кристаллы сушат на воздухе. Получают 2,9 г (46,5 %) аскорбата меди (II) дигидрата, [C 6 H 7 O 6 ] 2 Cu • 2H 2 O.
Получают 6,02 г (94,2 %) аскорбата цинка дигидрата [C 6 H 7 O 6 ] 2 Zn • 2H 2 O.
Аскорбат цинка дигидрат - кристаллический продукт белого цвета (с кремовым оттенком), хорошо растворяется в воде, не растворяется в спирте. При необходимости дополнительная очистка препарата возможна методом высаживания из водного раствора спиртом. При температуре 93-94 ос продукт плавится с обугливанием. Аскорбат цинка дает качественную реакцию с раствором NaOH. При этом образуется белый гельобразный осадок Zn(OH)2. При взаимодействии водного раствора аскорбата цинка с раствором гексацианоферрат (III) калия, K3[Fe(CN)6] образуется желтый осадок Zn3[Fe(CN)6]2.
Аскорбат меди (II) дигидрат -кристаллический продукт голубого цвета, хорошо растворяется в воде, не растворяется в спирте. Легко очищается методом высаживания из водного раствора спиртом. При температуре 132-134 ОС наблюдается начало разложения (образец голубого цвета приобретает серое окрашивание).
Аскорбат меди (II) дает качественную реакцию на ионы меди (II) с гексацианоферрат (II) калия, K 4 [Fe(CN) 6 ]. При этом образуется осадок Сu 2 [Fe(CN) 6 ] красно-бурого цвета.
-
б) Раствор 3,4 (0,0142 моль) сульфата меди (II), CuSO 4 • 5H 2 O в 15 мл воды (рН 3) нагревают до 40-45 о с 20 минут. к гомогенному раствору гидролизата (рН 2) присыпают порциями 5 г (0,0284 моль) аскорбиновой кислоты при температуре 3035 о с, перемешивают до полного растворения и выдерживают при комнатной температуре в течение 3-х часов. Реакционная смесь приобретает светлозеленый цвет и на дне колбы осаждается незначительное количество Cu 2 O красного цвета. Реакционную смесь фильтруют, гомогенный раствор упаривают, остаток обрабатывают и очищают спиртом по аналогии с методикой (2а). Получают 3,27 г (51 %) аскорбата меди (II) дигидрата, [C 6 H 7 O 6 ] 2 Cu • 2H 2 O.
-
в) Раствор 1,7 г (0,0142 моль) сульфата меди (II) в 10 мл воды нагревают до 40-45 о с 20 минут. К гомогенному раствору гидролизата присыпают 2,5 г (0,028 моль) аскорбиновой кислоты при температуре 30-35 о с, перемешивают до полного растворения и выдерживают при комнатной температуре 45-50 минут. Реакционный раствор фильтруют от микропримесей Cu 2 O. Фильтрат (светлозеленого цвета) высаживают спиртом, голубые кристаллы фильтруют, промывают
спиртом, и сушат при комнатной температуре. Получают 0,7 г (22 %) аскорбата меди (II) дигидрата, [C 6 H 7 O 6 ] 2 Cu • 2H 2 O.
-
г) К гомогенному раствору 2,5 г (0,0284 моль) аскорбиновой кислоты (рН 2) приливают гидролизат, полученный из 1,7 г (0,0142 моль), CuSO 4 • 5H 2 O в 10 мл воды при температуре 40-45 о с в течение 20 минут. Реакционную смесь выдерживают 45-50 минут при комнатной температуре, фильтруют от микропримесей Cu 2 O. Фильтрат (светло-зеленого цвета) высаживают спиртом, голубые кристаллы фильтруют, промывают спиртом и сушат при комнатной температуре. Получают 0,82 г (25 %) аскорбата меди (II) дигидрата, [C 6 H 7 O 6 ] 2 Cu • 2H 2 O.
Аскорбат меди (II), полученный по методикам 2б-2г, хорошо растворяется в воде, не растворяется в спирте, имеет температуру начала разложения 132-134 о с, дают качественную реакцию с K 4 [Fe(CN) 6 ] на ионы Cu2+.
Результаты исследований . Реакция комплексообразования аскорбиновой кислоты с ионами цинка и меди (II) осуществлялась взаимодействием аскорбиновой кислоты с гидроксидами соответствующих металлов. При этом учитывалась стабильность аскорбиновой кислоты, которая неустойчива в щелочной среде, а устойчива в кислой среде. В связи с этим были использованы гидроксиды металлов, образованные в процессе гидролиза сульфатов, в виде гидролизатов, имеющих рН 2 [5].
Образование аскорбатов цинка и меди (II) протекают по схеме:
СН2ОН
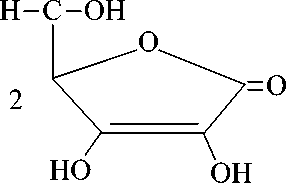
аскорбиновая кислота
to
MeSO4 + 2 HOH C Me(OH)2 + H2SO4
рН < 7
СН2ОН
( 2H2O)
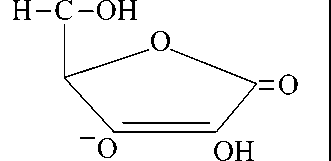
Ме
аскорбаты Ме (II)
(1,2)
где Ме: Zn2+ (1); Сu2+(2).
Из данных эксперимента следует, что комплексообразование аскорбиновой кислоты с ионами цинка протекает в гомогенной фазе в кислой среде однозначно . В оптимальных условиях реакции: температура 45-50 ОС, время 30-35 минут, аскорбат цинка получается с выходом более 90 %. При взаимодействии аскорбиновой кислоты с ионами меди (II) по данной схеме наряду с комплексообразованием протекают побочные реакции, связанные с окислительно-восстановительными процессами: окисление аскорбиновой кислоты, которое катализируется ионами Cu2+, и восстановление ионов Cu2+ до Cu1+ с образованием Cu2O. Для снижения побочных реакций нами была проведена отработка оптимальных условий реакции кмплексообразования. При этом изучалось влияние следующих факторов: температура
ЛИТЕРАТУРА: 1. Кнорре Д.Г., Мызина С.Д. Биологическая химия. М.: Высшая школа, 2003. – с. 34,157; 2. Пат. РФ 2078519.10.05.1997. Кормовая добавка. / А.Ю. Занкевич, А.И. Бойко, О.В. Мерзленко, А.А. Шапошников; 3. Мерзленко О.В. Фармакологические свойства препаратов, получаемых на основе биокоординационных соединений металлов с аскорбиновой кислотой: Автореф…диссерт…доктор. вет. наук, 1998.; 4. Пат РФ 2024514.15.12.1994. Комплекс 1-этилимидазола с аскорбатом цинка. / А.И. Скушникова, Е.С. Домнина, М.Г. Воронков и др.; 5. Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р. Изучение комплексообразующей способности глицилглицина с 3 d -биогенными металлами.// Ученые записки КГАВМ им. Н.Э. Баумана. – Казань, 2014. – т. 218, с. 102-110.
реакции, время, порядок смешивания реагента и субстрата, способ обработки реакционной смеси. Из данных опытов 2а-2г следует, что наибольший выход аскорбата меди (II) (51 %) получается по методике 2б (температура реакции 30-35 о с, выдержка реакционной смеси 3 часа при комнатной температуре).
Для подтверждения структуры полученных соединений (1,2) проведены качественные реакции на Мe (II).
Заключение. Изучена реакция комплексообразования аскорбиновой кислоты с ионами цинка и меди (II). Найдены оптимальные условия синтеза аскорбатов цинка и меди (II) с хорошими выходами, что позволяет исследовать их биологическую активность. Показано, что для обеспечения стабильности аскорбиновой кислоты реакцию необходимо проводить в кислой среде.
ИЗУЧЕНИЕ РЕАКЦИИ КОМПЛЕКСООБРАЗОВАНИЯ АСКОРБИНОВОЙ КИСЛОТЫ С ИОНАМИ ЦИНКА И МЕДИ (II)
Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р. Резюме
Изучена реакция комплексообразования аскорбиновой кислоты с ионами цинка и меди (II). Найдены оптимальные условия синтеза аскорбатов цинка и меди (II) с хорошими выходами, что позволяет исследовать их биологическую активность. Показано, что для обеспечения стабильности аскорбиновой кислоты реакцию необходимо проводить в кислой среде.
ASCORBIC ACID WITH ZINC AND COPPER(II) IONS COMPLEX FORMATION REACTION STUDY
Kadyrova R.G., Kabirov G.F., Mullakhmetov R.R.
Список литературы Изучение реакции комплексообразования аскорбиновой кислоты с ионами цинка и меди (II)
- Кнорре Д.Г., Мызина С.Д. Биологическая химия. М.: Высшая школа, 2003. -с. 34,157
- Пат. РФ 2078519.10.05.1997. Кормовая добавка./А.Ю. Занкевич, А.И. Бойко, О.В. Мерзленко, А.А. Шапошников
- Мерзленко О.В. Фармакологические свойства препаратов, получаемых на основе биокоординационных соединений металлов с аскорбиновой кислотой: Автореф…диссерт…доктор. вет. наук, 1998.
- Пат РФ 2024514.15.12.1994. Комплекс 1-этилимидазола с аскорбатом цинка./А.И. Скушникова, Е.С. Домнина, М.Г. Воронков и др.
- Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р. Изучение комплексообразующей способности глицилглицина с 3d-биогенными металлами.//Ученые записки КГАВМ им. Н.Э. Баумана. -Казань, 2014. -т. 218, с. 102-110.


