Изучение реактогенности, безопасности инактивированной вакцины «ОспаВир» и специфической эффективности двухэтапного метода вакцинации против натуральной оспы с применением на втором этапе живой оспенной вакцины
Автор: Рузавина Е.В., Шкуратова О.В., Ставицкая Н.Х., Мальцева Г.Г., Гаврилова М.А., Чуйкова К.И., Катанахова Л.Л.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2-2 т.24, 2009 года.
Бесплатный доступ
В НПО «Вирион» разработана инактивированная вакцина «ОспаВир», на основе высокоиммуногенно- го штамма Л-ИВП вируса вакцины. При доклиническом исследовании доказана безвредность и высокая иммунологическая эффективность. В соответствии с программой, согласованной с ГИСК им. Л.А. Тарасевича и утвержденной Комитетом медицинских иммунобиологических препаратов (МИБП) и Минздравом России на базе СиБГМУ были проведены клинические испытания вакцины «ОспаВир» с применением на втором этапе живой оспенной вакцины. Установлена низкая реактогенность и безвредность вакцины «ОспаВир». Применение ее при двухэтапном методе вакцинации против натуральной оспы сопровождается образованием грунд-иммунитета, что приводит к снижению степени проявления вакцинального процесса и не влияет на снижение общего иммунитета. На основании данных, полученных в ходе клинического исследования, была утверждена инструкция по применению. Инактивированная вакцина «Оспа- Вир» прошла регистрацию, а двухэтапный метод вакцинации против натуральной оспы рекомендован Росздравнадзором РФ для практического применения в здравоохранении.
Вакцинация, реактогенность, безвредность, специфическая активность, клинические исследования
Короткий адрес: https://sciup.org/14919058
IDR: 14919058 | УДК: 616.988.25-002.454.2
Текст научной статьи Изучение реактогенности, безопасности инактивированной вакцины «ОспаВир» и специфической эффективности двухэтапного метода вакцинации против натуральной оспы с применением на втором этапе живой оспенной вакцины
В связи с успешной ликвидацией натуральной оспы с 80-х годов вакцинация против данного заболевания прекращена. В настоящее время лица в возрасте до 23 лет не имеют иммунитета против натуральной оспы, а среди других возрастных групп населения только 10-15% имеют остаточный иммунитет. В связи с этим доля восприимчивого населения к вирусу оспы сегодня очень высока. Быстро эволюционирующий природный резервуар ортопоксвирусов с вовлечением человеческой популяции и опасность использования возбудителей в качестве поражающего агента при биотерроризме обосновывают необходимость поддержания запаса эффективных средств массовой вакцинопрофилактики для противоэпидемических мероприятий и иммунизации лиц повышенного риска.
С учетом современных требований к производству вакцин в НПО «Вирион» усовершенствована имеющаяся технология производства инактивированной оспенной вакцины и разработана вакцина «Ос-паВир», изготовленная из высокоиммуногенного штамма Л-ИВП. При доклиническом исследовании были доказаны безвредность и высокая иммунологическая эффективность созданного препарата.
В соответствии с программой, согласованной с ГИСК им. Л.А. Тарасевича и утвержденной Комитетом медицинских иммунобиологических препаратов (МИБП) и Минздравом России, на базе СибГМУ были проведены клинические исследования инактивированной вакцины «ОспаВир» с применением на II этапе живой оспенной вакцины.
Цель и задачи исследовании – изучение реакто-генности, безопасности и иммуногенности инактивированной вакцины «ОспаВир» при двухэтапном методе вакцинации против натуральной оспы.
МАТЕРИАЛ И МЕТОДЫ
В клиническом исследовании принимали участие 204 человека обоего пола в возрасте от 18 до 23 лет, ранее не привитые против натуральной оспы, соответствующие критериям включения. Исследование относилось к двойному слепому, рандомизированному, контролированному. Методом рандоменации добровольцы были распределены на 2 группы. По рекомендации ГИСК им. Л.А. Тарасевича с целью изучения реактогенности и токсичности инактивированной вакцины и анализа отдаленных постпрививочных проявлений в условиях эпидемиологической ситуации по вирусным заболеваниям была сформирована контрольная группа из 100 человек, основная – из 104 волонтеров.
Изучение реактогенности инактивированной вакцины проводилось в два этапа.
На первом этапе вакцинации инактивированную вакцину «ОспаВир» вводили подкожно в область левого плеча. С целью изучения ее реактогенности путем регистрации общих и местных постпрививочных реакций и осложнений за привитыми было установлено медицинское наблюдение с обязательной ежедневной регистрацией постпрививочных проявлений в течение 5 дней. Лица контрольной группы на первом этапе получили референс-препарат (раствор для инъекций изотонический-0,9%), во втором этапе они участие не принимали.
На втором этапе вакцинации волонтерам, получившим вакцину «ОспаВир», ввели живую оспенную вакцину методом скарификации уменьшенной дозой (1 надрез) в область правого плеча. Учитывая, что в ответ на введение живой оспенной вакцины у привитых развивается допустимый вакцинальный процесс, был проведен учет общих и специфических местных реакций на живую вакцину, введенную на фоне вакцинации «ОспаВир».
После проведения второго этапа вакцинации медицинское наблюдение осуществлялось до полного исчезновения всех общих и местных проявлений, до образования корочки на месте вакцинации.
Оценка степени проявления реакций проводилась с учетом допустимых реакций (повышение температуры тела, увеличение регионарных лимфатических узлов и последовательное развитие вакцинального процесса) и разработанных нами критериев.
Безопасность оценивали на основании показателей общего и биохимического анализа крови, общего анализа мочи.
Иммуногенность препарата при двухэтапном методе вакцинации оценивали по данным исследования сывороток крови (процент сероконверсии, серо-протекции) в реакции биологической нейтрализации
(РБН) и реакции торможения гемагглютинации (РТГА). Концентрацию специфических вируснейт-рализующих антител (титр) в сыворотке крови иммунизированных людей определяли в РБН на хорионаллантоисной оболочке (ХАО) развивающегося куриного эмбриона, используя в качестве тест-штамма вирус вакцины ОСО серия 5 производства «НПО «Вирион» (г. Томск) и в РТГА, используя диаг-ностикум оспенный серия 3 и контрольную сыворотку, не содержащую антител к ортопоксвирусам серия 2, производства «НПО «Вирион» (г. Томск).
В ходе исследования все количественные показатели обрабатывались методом вариационной статистики. Статистическую значимость различий определяли по Т-критерию Стъюдента, при этом статистически значимыми считали различия при Р<0,05.
С целью выявления отдаленных постпрививочных проявлений и возможного нарушения иммунной защиты организма вакцинированные находились под медицинским наблюдением в течение 3 месяцев после проведенной вакцинации.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
После проведения первого этапа вакцинации в 100% случаев не было зарегистрировано повышение температуры тела выше 37,5°С. Слабые температурные реакции (37,1-37,5°С) регистрировались в единичных случаях – у 6 (5,7%) человек.
Повышение температуры отмечалось кратковременно, ее нормализация происходила самостоятельно без медицинского вмешательства.
Симптомы общих реакций, такие как слабость, головная боль, регистрировались в единичных случаях в первый день наблюдения у 10 (9,6%) человек, во второй день – у 2 (1,9%) привитых. Недомогание отмечалось только в первый день наблюдения и регистрировалось у 8 (7,6%) волонтеров. Все симптомы общих реакций проходили самостоятельно к концу вторых суток. Местные реакции в виде слабой болезненности наблюдались у 10 (9,6%) вакцинированных, исчезли самостоятельно в течение 24 часов у 8 привитых и через 2 суток после введения вакцины у 2 привитых. В трех (2,8%) случаях местные реакции сопровождались небольшим кратковременным увеличением подмышечных лимфатических узлов (от 0,5 до 0,8 см), которые на третий день наблюдения сократились, стали мягкими, эластичными, безболезненными.
Гиперемии, припухлости в месте введения и других проявлений местных реакций не наблюдалось ни у одного из привитых за весь период наблюдения. В контрольной группе добровольцев были зафиксированы как местные, так и общие реакции. Местные проявления были расценены как «уколочные». Повышение температуры тела до 37,5°С у пяти человек, недомогание и головная боль в трех случаях яви-
Таблица 1
Частота основных симптомов у добровольцев, вакцинированных инактивированной вакциной «ОспаВир», и добровольцев, получивших плацебо
|
Симптомы |
Основная группа («ОспаВир») (n=104) |
Контрольная группа (натрия хлорид 0,9%) (n=100) |
|||
|
I. |
Общие реакции |
абс |
%±m |
абс |
%±m |
|
1. |
Температурная реакция |
||||
|
Нормальная (36,0-37,0)ºС |
98 |
94,3±2,2 |
95 |
95±2,1 |
|
|
Легкая степень (37,1-37,5)ºС |
6 |
5,7±2,2 |
5 |
5,0±2,1 |
|
|
Слабая степень (37,6-38,5)ºС |
0 |
0 |
0 |
0 |
|
|
Сильная степень (от 38,6ºС и выше) |
0 |
0 |
0 |
0 |
|
|
Всего лиц с повышенной температурой тела |
6 |
5,7±2,2 |
5 |
5,0±2,1 |
|
|
2. |
Нарушение общего самочувствия |
||||
|
Недомогание |
8 |
7,6±2,6 |
7 |
7,0±2,5 |
|
|
Головная боль |
10 |
9,6±2,8 |
3 |
3,0±1,7 |
|
|
Всего лиц с нарушением общего самочувствия |
18 |
17,2±3,7 |
10 |
10±3,0 |
|
|
II. |
Местные реакции |
||||
|
Боль в месте инъекции |
10 |
9,6±2,8 |
9 |
9,0±2,9 |
|
|
Гиперемия |
0 |
0 |
0 |
0 |
|
|
Припухлость |
0 |
0 |
0 |
0 |
|
|
Увеличение лимфатических узлов (шейные, подмышечные) |
3 |
2,8±1,6 |
0 |
0 |
|
|
Всего лиц с местными реакциями |
13 |
12,5±3,2 |
9 |
9,0±2,9 |
|
Плацебо – раствор натрия хлорида для инъекций изотонический 0,9%
Статистически значимых различий изучаемых величин в сравниваемых группах не выявлено.
Таблица 2
Картина периферической крови у добровольцев, принимающих участие в клинических исследованиях инактивированной вакцины «ОспаВир» при двухэтапном методе вакцинации против натуральной оспы (n=104)
|
Период наблюдения |
Изучаемые показатели |
||||||||
|
Статистические показатели |
Нb г/л |
Эритроциты х 1о12/л |
Лейкоциты х 109/л |
Сегментоядерные, % |
Эозинофилы, % |
Лимфоциты, % |
Моноциты, % |
СОЭ мм/ч |
|
|
Норма |
Х |
125 |
4,05 |
5,4 |
64 |
2,0 |
21,0 |
7,0 |
10,0 |
|
m |
5,3 |
0,25 |
1,6 |
4,0 |
1,7 |
7,0 |
0,1 |
5,0 |
|
|
До проведения |
Х |
129 |
4,19 |
5,47 |
67,98 |
2,05 |
21,0 |
7,86 |
14,2 |
|
вакцинации |
m |
1,44 |
0,03 |
0,15 |
0,49 |
0,17 |
0,39 |
0,25 |
0,75 |
|
На 7-е сутки после |
Х |
125,4 |
4,05 |
6,11 |
64,96 |
3,1 |
23,24 |
6,81 |
13,46 |
|
вакцинации |
m |
1,42 |
0,03 |
0,18 |
0,3 |
0,29 |
0,57 |
0,27 |
0,78 |
Колебания показателей периферической крови не выходят за пределы физиологической нормы.
лись, по-видимому, следствием респираторно-вирусных заболеваний.
При сравнительном анализе количества и степени проявления общих и местных реакций как в основной, так и в контрольной группах статистически значимых отличий отмечено не было.
Результаты гематологических и биохимических анализов крови после вакцинации статистически значимо не изменялись по отношению к фоновым величинам и не выходили за пределы физиологической нормы. Было установлено, что вакцинация оказывает слабое воздействие на уровень гемоглобина в крови вакцинированных. Среднее значение концентрации гемоглобина до вакцинации составляло (129,0±1,44) г/л, на 7-е сутки после вакцинации содержание гемоглобина незначительно уменьшилось до (125,4±1,42) г/л. Со стороны красной крови наблюдалось небольшое снижение количества эритроцитов на 7-е сутки после вакцинации относительно фоновых значений с (4,19±0,03) х 10 12 /л до (4,05± 0,03) х 1012/л. На 7-е сутки после вакцинации отмечалось повышение лейкоцитов с (5,47±0,15) х 109/л до (6,11±0,03) х 109/л. Наблюдались изменения со стороны сегментоядерных лейкоцитов спустя 7 дней после вакцинации. Процентное содержание сег-
(23,24±0,57)%. Количество моноцитов имело тенденцию к снижению с (7,86±0,25)% до (6,81±0,27)%. Изменений со стороны СОЭ отмечено не было, до вакцинации СОЭ соответствовала (14,2±0,75) мм/ч, после – (13,2±0,75) мм/ч. Незначительные изменения в периферической крови привитых свидетельствуют об активации системы неспецифической резистентности организма.
С целью изучения действия инактивированной вакцины «ОспаВир» на функцию печени, миокарда и почек было проведено исследование биохимических показателей крови привитых.
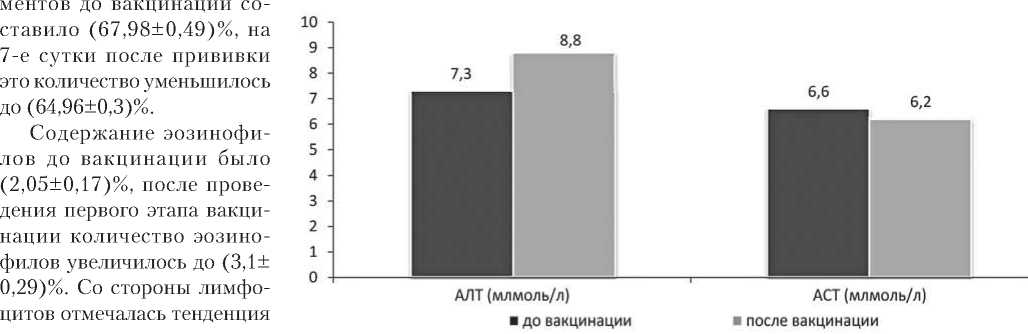
При изучении сывороточных трансаминаз – аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) – на 7-е сутки после вакцинации наблюдалось умеренное изменение уровня трансаминаз. Отмечалось незначительное увеличение активности АЛТ с (7,3±0,48) млмоль/л до (8,8± 0,43) млмоль/л (при норме до 11,3 млмоль/л), показатели активности АСТ на 7-е сутки фактически оставались стабильными. До вакцинации активность фермента АСТ составляла (6,6±0,39) млмоль/л, на 7-е сутки после прививки (6,2±0,41) млмоль/л (при норме до 7,5 млмоль/л) (рис. 1).
Изменения (сывороточных трансаминаз), воз-
-
- к незначительному увели чению на 7-е сутки наблю
Рис. 1. Изучение уровня АЛТ и АСТ в сыворотке крови привитых на 7-е сутки после введения инактивированной вакцины «ОспаВир».
– Показатели АЛТ и АСТ не выходят за пределы физиологической нормы
дения – с (21,0±0,39)% до
никшие в ответ на введение вакцины, не превышали физиологических норм, не приводили к нарушениям метаболизма гепатоцитов, не вызывали субклинических реакций со стороны основных, функциональных систем организма.
В ходе исследования три добровольца самостоя- тельно отказались от дальнейшего участия в качестве волонтеров, поэтому во втором этапе вакцинации принял участие 101 человек.
На 8-й день после первого этапа был проведен второй этап вакцинации – живой оспенной вакциной методом скарификации в область наружной поверхности верхней трети правого плеча (1 надрез). В ходе наблюдения у 98 (97%) привитых постпрививочная реакция протекала по типу первичной вакцинальной реакции, с ускоренным формированием и развитием кожных элементов. У трех (2,9%) вакцинированных развитие постпрививочной реакции произошло по ускоренному типу. Вакцинация двухэтапным методом с применением на втором этапе живой оспенной вакциной сопровождалась последовательным развитием клинических и местных проявлений.
Периоды течения вакцинального процесса:
-
1) скрытый;
-
2) последовательное развитие вакцинального процесса (папула, везикула, пустула, образование ореолы) с 2-го по 8-й день;
-
3) подсыхание и обратное развитие с 8-го по 12-й день;
-
4) образование рубцов на 8-й–13-й дни.
В каждом из этих периодов наблюдались характерные для них местные, общие и температурные реакции. Максимально выраженные местные и об- щие проявления постпрививочных реакций приходились в период развития оспин – с 5-го по 8-й день после вакцинации, период пустулообразования. С 9-го дня после вакцинации отмечалась регрессия всех клинических проявлений (рис. 2).
В ходе анализа и оценки реактогенности вакцины при двухэтапном методе вакцинации против натуральной оспы с использованием на первом этапе вакцинации инактивированной вакцины «ОспаВир» были выявлены допустимые реакции.
Течение вакцинального процесса с нормальной температурой (36-37)°С наблюдалось в 55 (54,5%)
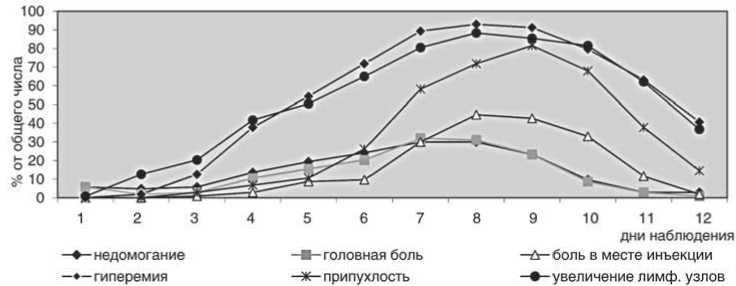
Рис. 2. Динамика клинических симптомов, наблюдаемых у волонтеров после введения живой оспенной вакцины при двухэтапном методе вакцинации против натуральной оспы
Таблица 3
Частота основных симптомов у добровольцев основной группы после проведения второго этапа вакцинации против натуральной оспы
Из местных реакций чаще других регистрировалась болезненность в месте введения вакцины, которая отмечалась у 72 (71,2%) человек. Гиперемия и припухлость в месте скарификации наблюдались у 100 (99%) и 96 (95%) привитых соответственно. Все местные реакции были расценены как легкой и средней степеней проявления и не всегда сопровождались нарушением общего состояния. Течение вакцинального процесса сопровождалось умеренным увеличением подмышечной группы лимфатических узлов справа. Наибольшее количество случаев увеличения лимфатических узлов подмышечной группы справа регистрировалось в период с 6-го по 10-й день со дня вакцинации. Реакция лимфоидной ткани была умеренно выраженной: в 98 (97%) случаях размеры лимфатических узлов не превышали 2 мм, увеличение лимфатических узлов от 2,1 и более мм отмечалось у 1 (0,9%) привитого. В ходе наблюдения каких-либо осложнений и атипичных прививочных реакций не отмечалось.
Постпрививочные реакции имели только легкую и среднюю степени выраженности. Специфическую активность препарата, обусловленную активным компонентом – антигеном вируса вакцины, оценивали по способности вызывать у вакцинированных образование вирус-нейтрализующих антител к вирусу вакцины. При исследовании сывороток крови привитых двухэтапным методом вакцинации против натуральной оспы установлено, что процент лиц, ответивших выработкой специфических антител в РБН и РТГА, составил 100, процент серопротективных волонтеров в РБН и РТГА – 98.
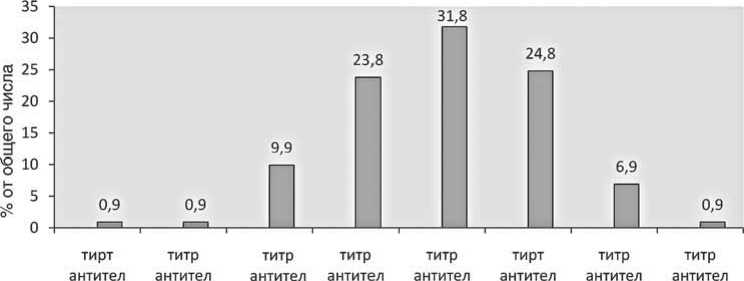
Так как в качестве защитного титра вируснейтра-лизующих антител в РБН был принят титр 1:40, при анализе результатов уровень образования специфических антител к ортопоксвирусам в РБН распределился следующим образом (рис. 3): только один (0,9%) вакцинированный имел уровень антител менее защитного – 1:10; в сыворотке крови еще у одного (0,9%) добровольца обнаружены антитела в титре 1:80; 10 добровольцев (9,9%) имели уровень антител в титре 1:160; 24 (23,8%) – 1:320.
Наибольшее количество – 32 (31,8%) привитых – имели титр антител 1:640, а у 25 (24,8%) добровольцев антитела определялись в разведении 1:1280. Семь человек (6,9%) в ответ на вакцинацию выработали антитела в титре 1:2560 и один (0,9%) – 1:5120. Средний геометрический титр специфических антител в РБН составил (2,804139±0,04) lg, то есть 636,99 (580,95–698,46).
При анализе результатов образования специфиче-
1:10 1:80 1:160 1:320 1:640 1:1280 1:2560 1:5120
Рис. 3. Анализ уровня специфических антител к ортопоксивирусам в сыворотке крови в реакции биологической нейтрализации на ХАО
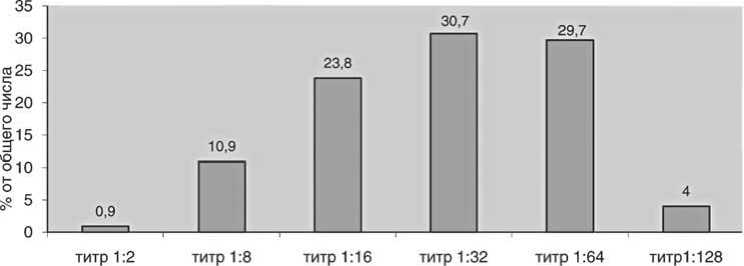
Рис. 4. Анализ уровня специфических антител к ортопоксвирусам в сыворотке крови в РТГА
ских антител к ортопоксвирусам в РТГА было установлено, что титр антител 1:2 наблюдался у 1 (0,9%) привитого, 11 (10,9%) вакцинированных имели антитела в титре 1:8; 24 (23,8%) привитых – 1:16; 31 (30,7%) человек имел титр антител 1:32 и 30 (29,7%) – 1:64. Высокий уровень специфических антител – 1:128 наблюдался у 4 (4%) привитых (рис. 4). Средний геометрический титр специфических антител в РТГА составил (1,484078±0,03) lg, то есть 30,48 (28,45-32,66).
Таблица 4
Сравнительный анализ инфекционной и соматической заболеваемости добровольцев основной и контрольной групп в течение 3 месяцев после проведения второго этапа вакцинации против натуральной оспы
|
Основная группа (n=101) |
Контрольная группа (n=100) |
|
|
Вирусные заболевания |
04.05 г. – 10 человек 05.05 г. – 3 человека 06.05 г. – 7 человек 07.05 г. – 1 человек |
04.05 г. – 12 человек 05.05 г. – 5 человек 06.05 г. – 6 человек 07.05 г. – 1 человек |
|
Всего заболевших лиц: |
21 |
24 |
|
Кожные и аллергические болезни |
0 |
1 |
При анализе полученных данных процент сероконверсии оставил 100, а процент серопротекции равнялся 98. Проведенный корреляционный анализ выявил положительную статистическую линейную взаимосвязь между данными РБН и РТГА – коэффициент корреляции r = 0,638426, с уровнем значимости Р<0,001.
Учитывая то, что вакцинация против натуральной оспы проводилась в весенний период, нами было изучено влияние вакцинации на иммунную систему организма. С целью анализа заболеваемости проводилось наблюдение за лицами основной и контрольной групп в течение трех месяцев. В ходе наблюдения было установлено, что заболеваемость среди вакцинированных была аналогична заболеваемости лиц контрольной группы (табл. 4).
ЗАКЛЮЧЕНИЕ
Результаты проведенных клинических исследований показали, что инактивированная вакцина «ОспаВир» ареактогенна и безвредна. Применение ее при двухэтапном методе вакцинации против натуральной оспы сопровождается образованием грунд-иммунитета, что приводит к снижению степени проявления вакцинального процесса и не влияет на снижение общего иммунитета.
На основании данных, полученных в ходе клинического исследования, была утверждена инструкция по применению. Вакцина «ОспаВир» прошла реги- страцию, а двухэтапный метод вакцинации против натуральной оспы рекомендован Росздравнадзором РФ для практического применения в здравоохранении.
STUDYING REACTOGENEITY AND SAFETY OF INACTIVATED VACCINE «ОSPAVIR» AND THE ANALYSIS OF SPECIFIC ACTIVITY OF 2-STAGE VACCINATION METHOD AGAINST VARIOLA USING LIVING VARIOLA VACCINE
ON THE 2-ND STAGE


