Изучение роли полиморфизма генов репарации ДНК в формировании предрасположенности к развитию тройного негативного рака молочной железы у женщин
Автор: Титов Р.А., Глушков А.Н., Торгунакова А.В., Захарова Я.А., Марущак А.В., Минина В.И.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Генетика
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Обследованы 682 женщины русской национальности, проживающие в Кемеровской обл. России, в том числе 213 больные тройным негативным раком молочной железы и 465 женщин близкого возраста, не имеющих признаков онкологических заболеваний. Проведен сравнительный анализ полиморфных вариантов генов репарации ДНК APEX1 444T>G (rs1130409), ATM 5557G >A (Ars180151), hOGGl 977C>G (rs1052133), XPD 2251T>G (rs13181), XPG 3310G>C (rs17655), ADPRT 2285 T>C (rs11610) у больных раком молочной железы и индивидов, не имеющих онкологических заболеваний, проживающих в той же местности. Анализ однолокусных эффектов показал значимую связь между риском рака молочной железы и вариантами гена XPG 3310G>C (rs17655) (OR = 0.64, CI: 0.47-0.87, p = 0.004) в общей группе и (OR = 0.68, 95% CI: 0.49-0.94; р = 0.019) в некурящей группе, и гена XPD 2251T>G (OR = 0.30, 95% CI: 0.11-0.78 ; р =0.011) в курящей группе. MDR-aнализ межгенных взаимодействий показал, что гены XPD 2251T>G и APEX1 444T>G, XPG 3310G>C и ATM 5557G >A тесно взаимодействуют и взаимно усиливают риск развития рака молочной железы.
Рак молочной железы, тройной негативный, полиморфизм генов apex1, atm, hogg1, xpd, xpg, adprt
Короткий адрес: https://sciup.org/147247249
IDR: 147247249 | УДК: 575.174.015.3 | DOI: 10.17072/1994-9952-2024-4-440-450
Текст научной статьи Изучение роли полиморфизма генов репарации ДНК в формировании предрасположенности к развитию тройного негативного рака молочной железы у женщин
Acknowledgments : the work was carried out within the framework of the state assignment AAAA-A21-121011590009-9 “Immuno-hormonal interactions in breast cancer”.
Рак молочной железы (РМЖ) — наиболее распространенная злокачественная опухоль, возникающая у женщин и занимающая второе место в мировой статистике по смертности [Siegel et al., 2021; Злокачественные…, 2021]. Благодаря новым методам профилактики и лечения смертность из-за этого заболевания постепенно снижается. Данная злокачественная патология характеризуется высокой степенью гетерогенности и дополнительно подразделяется на несколько типов. Классификация РМЖ основана на экспрессии молекулярных маркеров. Тройной негативный рак характеризуется наихудшим прогнозом. Этот тип РМЖ встречается примерно у 15% пациенток. При этом на поверхности опухолевых клеток нет рецепторов эстрогена и прогестерона, а экспрессия рецепторов эпидермального фактора роста (HER-2) нормальная. Это делает их крайне нечувствительными к терапии существующими на сегодняшний день препаратами, включая те, что целенаправленно действуют на HER-2 или гормональные препараты.
Согласно данным исследований известно, что РМЖ появляется в результате генетических и гормональных изменений, возникающих под действием факторов окружающей среды и профессиональной деятельности, тесно связан с неправильным образом жизни (употребление алкоголя и табака, лишний вес и ожирение, физическая инертность) и репродуктивной историей (возраст менархе, возраст первых родов, кормление грудью) [Sun et al., 2017; Obeagu, Obeagu, 2024]. Репарация ДНК является частью барьеров, защищающих от мутаций, увеличивающих риск онкопатологии [Torgovnick, Schumacher, 2015; Kur-furstova et al., 2016]. Репарация ДНК отвечает за поддержание целостности генома путем защиты клеток от генетических и экологически обусловленных нарушений. Гены, связанные с механизмами репарации ДНК, считаются генами-кандидатами предрасположенности к раку, поскольку нарушение механизмов поддержания целостности генома может привести к злокачественной трансформации [Rudolph, Chang-Claude, Schmidt, 2016]. Однако точные молекулярные механизмы развития рака молочной железы все еще находятся на стадии интенсивного изучения.
В нашем исследовании мы сосредоточились на оценке роли однонуклеотидных полиморфизмов генов (SNP) репарации ДНК в формировании наследственной предрасположенности к РМЖ у женщин, проживающих в промышленно развитом регионе. Основными задачами нашей работы было выявление активно изучаемых вариантов в генах репарации ДНК: APEX1 444T>G (rs1130409), ATM 5557G >A (Ars180151), hOGG1 977C>G (rs1052133), XPD 2251Т>G (rs13181), XPG 3310G>C (rs17655), ADPRT 2285 T>C (rs11610) у женщин Кемеровской обл. и оценка их эффектов относительно риска формирования онкопатологии. Результаты нашего исследования помогут наилучшим образом раскрыть молекулярную основу предрасположенности к РМЖ и лечь в основу профилактики данного типа рака.
Целью нашего исследования была оценка риска развития тройного негативного РМЖ у женщин Кемеровской обл. в соответствии с носительством полиморфных вариантов генов репарации ДНК.
Материалы и методы исследований
Были обследованы 682 женщины (русские по этнической принадлежности), проживающие на территории Кемеровской обл. РФ. От каждого человека было получено информированное согласие на участие в исследовании. Исследование выполнено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации: этические принципы проведения медицинских исследований с участием человека с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Министерством здравоохранения Российской Федерации 19.06.2003 г. Проведение исследования было утверждено комитетом по этике Института экологии человека Федерального исследовательского центра угля и углехимии СО РАН.
Группы формировались по принципу «случай–контроль» с учетом возраста, пола, этнической принадлежности и влияния факторов среды. Критерии включения: русские женщины, проживающие в Кемеровской обл. с момента рождения, возраст старше 40 лет. Критерии исключения: наличие наслед- ственных, аутоиммунных, аллергических, психических заболеваний, родственников с онкозаболеваниями, ранее диагностированный рак других органов. В первую группу вошли 217 впервые выявленных больных РМЖ (средний возраст 58.9±10.5). Диагноз РМЖ устанавливался по результатам клинического, эндоскопического и морфологического обследования на базе Кузбасского областного онкологического диспансера. Контрольную группу составили 465 не родственных женщин без онкозаболеваний в анамнезе, проживающих в той же местности (средний возраст 54.79±8.2). Все здоровые доноры, включенные в контрольную группу (онкопатология молочных желез была исключена по результатам маммографии и обследования у маммолога), не принимали препаратов с известным мутагенным действием и не проходили рентгенологических процедур в течение трех месяцев до участия в исследовании. ДНК выделяли из венозной крови с использованием стандартной методики фенольно-хлороформной экстракции [Sambrook, Fritsch, Maniatis, 1989]. После выделения клетки крови подвергались лизированию, белковая компонента разрушалась протеиназой К (SibEnzyme, Новосибирск, Российская Федерация). С учетом анализа данных литературы нами были выбраны полиморфные локусы генов APEX1 444T>G (rs1130409), ATM 5557G >A (Ars180151), hOGG1 977C>G (rs1052133), XPD 2251Т>G (rs13181), XPG 3310G>C (rs17655), ADPRT 2285 T>C (rs11610). Частота редкого аллеля в популяциях европеоидов учитывалась по данным доступного ресурса National Center for Biotechnology Information . Типирование полиморфных маркеров проводилось с помощью ал-лель-специфической ПЦР (ООО “Литех НПП”, Москва, Россия). Амплификацию проводили на термоциклере “Терцик” по программе, рекомендованной производителем наборов реагентов. Продукты ПЦР анализировали методом электрофореза в 3%-ном агарозном геле наличием бромистого этидия. Последующая визуализация фрагментов ДНК осуществлялась в камере с УФ-светом. Статистическую обработку результатов проводили с использованием пакетов прикладных программ: SNPstat , STATISTICA 10.0, MDR . Проводили оценку частоты аллелей и генотипов; анализировали соответствие распределения частот генотипов равновесию Харди–Вайнберга; оценивали статистическую значимость различий между группами по частотам аллелей и генотипов с учетом теста X2 на гомогенность выборок (статистически значимыми считали различия при p <0.05). Логистическую регрессию использовали для выявления ассоциации полиморфных локусов в различных моделях наследования (аддитивной, доминантной, сверхдоминантой, рецессивной, лог-аддитивной) c коррекцией на возраст, статус курения. Для выбора лучшей модели использовали информационный критерий Акайке (AIC). Исследование эффектов межгенных взаимодействий проводили в программе MDR – Multifactor Dimensionality Reduction .
Результаты
Частоты генотипов и аллелей исследованных полиморфных локусов показали соответствие равновесию Харди–Вайнберга как в группе больных РМЖ, так и в группе здоровых (табл. 1).
Таблица 1
Распределение частот генотипов и аллелей полиморфных локусов генов репарации ДНК [The genotype and allele frequency distribution at the polymorphic DNA repair gene loci]
|
Локусы и генотипы |
Генотипы и аллели |
Больные РМЖ (Case) |
Здоровые женщины (Control) |
χ2 |
p |
|
APEX1 444 T>G rs1130409 |
TT TG GG |
80 (36.9%) 108 (49.8%) 29 (13.4%) |
159 (34.3%) 232 (50.1%) 72 (15.6%) |
0.54 |
0.69 |
|
T/G |
268(0.62)/166(0.38) |
550(059)/376(0.41) |
|||
|
p HWE |
0.47 |
0.44 |
|||
|
ATM 5557G >A Ars180151 |
GG GA AA |
149 (73%) 46 (22.6%) 9 (4.4%) |
352 (75.7%) 105 (22.6%) 8 (1.7%) |
3.1 |
0.15 |
|
G/A |
344(0.84)/64(0.16) |
809(0.87)/121(0.13) |
|||
|
p HWE |
0.6 |
1 |
|||
|
hOGG1 977 C>G rs1052133 |
CC CG GG |
130 (59.9%) 79 (36.4%) 8 (3.7%) |
289 (62.8%) 147 (32%) 24 (5.2%) |
1.3 |
0.4 |
|
C/G |
339(0.78)/95(0.22) |
725(0.79)/195(0.21) |
|||
|
p HWE |
0.43 |
0.33 |
Окончание табл. 1
|
Локусы и генотипы |
Генотипы и аллели |
Больные РМЖ (Case) |
Здоровые женщины (Control) |
χ2 |
p |
|
XPD 2251 T>G rs13181 |
TT TG GG |
98 (45.2%) 93 (42.9%) 26 (12%) |
211 (45.4%) 198 (42.6%) 56 (12%) |
0.01 |
0.995 |
|
T/G |
289(0.67)/145(0.33) |
620(0.67)/310(0.33) |
|||
|
p HWE |
0.65 |
0.4 |
|||
|
XPG 3310 G>C rs17655 |
GG GC CC |
72 (47.7%) 67 (44.4%) 12 (8%) |
257 (60.8%) 147 (34.8%) 19 (4.5%) |
7.4 |
0.015 |
|
G/C |
211(0.7)/91(0.3) |
661(0.78)/185(0.22) |
|||
|
p HWE |
0.57 |
0.89 |
|||
|
ADPRT 2285 T>C rs11610 |
TT TC CC |
137 (70.6%) 50 (25.8%) 7 (3.6%) |
309 (66.6%) 144 (31%) 11 (2.4%) |
1.7 |
0.31 |
|
A/C |
324(0.84)/64(0.16) |
762(0.82)/166(0.18) |
|||
|
p HWE |
0.43 |
0.27 |
Примечание. pHWE – значимость отличий распределения частот генотипов от равновесия Харди–Вайнберга (exact test for Hardy–Weinberg equilibrium); p – значимость отличий частоты встречаемости генотипа в группе больных и здоровых, критерий χ2 с поправкой Йетса.
При сравнении изученных групп жительниц Кемеровской области больных РМЖ и здоровых было выявлено отличие частот по вариантам гена XPG3310G>C ( rs17655 ).
Расчеты соотношения шансов для различных моделей наследования (табл. 2) показали, что для полиморфного варианта XPG 3310 G>C ассоциации с риском РМЖ наиболее значимо проявлялись в сверхдоминантной модели наследования в общей группе (ORadj = 0.64, 95% CI: 0.47-0.87; рadj = 0.004, AIC 657.3) и в лог-аддитивной модели в группе некурящих (ORadj = 0.68, 95% CI: 0.49-0.94; рadj = 0.019, AIC 552.2).
Таблица 2
Результаты анализа ассоциаций полиморфных локусов генов-кандидатов с риском РМЖ [Results of the analysis of polymorphic loci associations of candidate gene with the risk of breast cancer]
|
Локусы и генотипы |
Группа |
Модель |
OR adj |
p |
AIC |
|
APEX1 |
Общая |
Лог-аддитивная |
1.11 (0.87-1.41) |
0.4 |
854.9 |
|
444 T>G |
Курящие |
Доминантная |
2.49 (0.94-6.57) |
0.064 |
111.3 |
|
rs1130409 |
Некурящие |
Лог-аддитивная |
1.20 (0.92-1.56) |
0.18 |
695.9 |
|
ATM |
Общая |
Рецессивная |
0.38 (0.14-1.00) |
0.051 |
823.5 |
|
5557G >A |
Курящие |
Сверхдоминантная |
0.76 (0.26-2.16) |
0.6 |
110.5 |
|
Ars180151 |
Некурящие |
Рецессивная |
0.35 (0.12-1.03) |
0.056 |
673.7 |
|
hOGG1 |
Общая |
Сверхдоминантная |
0.82 (0.58-1.15) |
0.25 |
852 |
|
977 C>G |
Курящие |
Сверхдоминантная |
0.61 (0.24-1.54) |
0.3 |
113.6 |
|
rs1052133 |
Некурящие |
Сверхдоминантная |
0.86 (0.59-1.25) |
0.43 |
694.5 |
|
XPD |
Общая |
Сверхдоминантная |
0.99 (0.72-1.37) |
0.96 |
857.2 |
|
2251 T>G |
Курящие |
Доминантная |
0.30 (0.11-0.78) |
0.011 |
108.2 |
|
rs13181 |
Некурящие |
Доминантная |
1.19 (0.83-1.70) |
0.33 |
698.4 |
|
XPG |
Общая |
Лог-аддитивная |
0.64 (0.47-0.87) |
0.004 |
657.3 |
|
3310 G>C |
Курящие |
Доминантная |
0.36 (0.11-1.14) |
0.08 |
75.7 |
|
rs17655 |
Некурящие |
Лог-аддитивная |
0.68 (0.49-0.94) |
0.019 |
552.2 |
|
ADPRT |
Общая |
Сверхдоминантная |
1.30 (0.89-1.89) |
0.17 |
800.2 |
|
2285 T>C |
Курящие |
Сверхдоминантная |
3.55 (1.06-11.84) |
0.27 |
97.6 |
|
rs11610 |
Некурящие |
Рецессивная |
0.61 (0.21-1.80) |
0.38 |
659.9 |
Примечание. OR adj – показатель отношения шансов для редкого аллеля с поправкой на возраст. P – значимость различий между группами. AIC – критерий Акайке.
Для гена XPD2251 T>G наиболее значимые ассоциации проявлялись в доминантной модели наследования в группе пациентов, характеризующихся употреблением табачных изделий (ORadj = 0.30, 95% CI: 0.11-0.78 ; рadj =0.011, AIC 108.2).
Связи риска развития злокачественных новообразований молочной железы с полиморфизмами других генов системы репарации ДНК выявлено не было.
В результате анализа межгенных взаимодействий методом MDR были определены две треxлокусные модели, связанные с риском развития РМЖ у женщин (табл. 3).
Таблица 3
Анализ межгенных взаимодействий при формировании РМЖ у женщин [Analysis of intergenic interactions in the formation of breast cancer in women]
|
XPD 2251Т>G* APEX1444 T>G XPG 3310G>C (курящие) |
0.8484 |
0.622 |
0.0001 |
0.9375 |
0.7381 |
10/10 |
0.5769 |
|
XPG 3310G>C* ATM5557G >A XPD 2251Т>G (некурящие) |
0.6182 |
0.509 |
0.0001 |
0.5891 |
0.6398 |
8/10 |
0.3958 |
Примечание. Tr.Bal.Acc. – тренировочная сбалансированная точность; Test.Bal.Acc. – тестируемая сбалансированная точность; Sign Test – тест на значимость; Se – чувствительность; Sp – специфичность; CVС – повторяемость результата; Pre. (Precision) – точность модели; *алгоритм полного поиска (Exhaustive search algoritm).
Первая модель включала в себя полиморфизмы XPD 2251Т>G, APEX 1444 T>G и XPG 3310G>C. Кластерный анализ позволил установить тесное взаимодействие и взаимное усиление эффектов (синергизм) между полиморфными локусами XPD 2251Т>G и APEX1444 T>G, данный кластер взаимодействует с геном XPG 3310G>C с дублирующим эффектом.
Вторая модель ген-генного взаимодействия, ассоциированная с развитием РМЖ у некурящих женщин, включала полиморфные варианты генов XPG 3310G>C, ATM 5557G>A и XPD 2251Т>G. Выявлен кластер тесно взаимодействующих генов XPG 3310G>C и ATM 5557G>A , эффекты которых синонимичны. Данный кластер образовывал единый блок с геном XPD 2251Т>G с дублирующим эффектом данных генов (рис. 1).
XPG(3310G>C)
XPD(22511>G)
APEX1 (444T>G)
Модель 1. Курящие женщины

Модель 2. Некурящие женщины
Рис. 1. Дендрограмма межгенных взаимодействий у женщин больных РМЖ.
Короткие линии указывают на сильное взаимодействие генных локусов, длинные – на слабую связь; черным цветом указывается синергизм, т.е. взаимное усиление эффектов между локусами, серым– дублирование эффектов между локусами
[Dendrogram of intergenic interactions in women with breast cancer.
Short lines indicate strong interaction of gene loci, long lines indicate weak connection; black color indicates synergism, i.e. mutual enhancement of effects between loci, gray color indicates duplication of effects between loci]
Анализ комбинаций всех возможных вариантов модели в таблицах сопряженности позволил выявить 9 благоприятных и 9 негативных эффектов у курящих женщин и 10 благоприятных и 12 негативных у некурящих женщин комбинаций для развития тройного негативного РМЖ (рис. 2 и 3).
cc
XPD(2251DG)
GG TG TT
XPG(3310G>C) GC GG
XPD(22511>G) XPD(2251DG)
GG TG TT GG TG TT
0
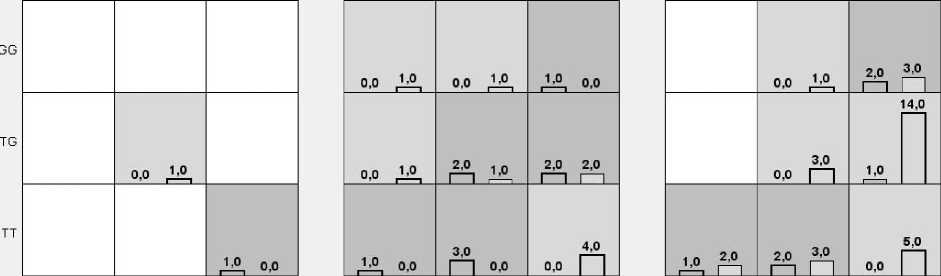
Рис. 2. Сочетания вариантов генов XPD 2251Т>G, APEX1444 T>G и XPG 3310G>C, указывающих на предрасположенность к возникновению онкозаболеваний молочной железы у курящих женщин.
Сочетания вариантов генов, указывающих на повышенный риск развития заболевания – темно-серые ячейки, на пониженный риск – светло-серые ячейки, отсутствующие сочетания генотипов – белые ячейки (столбики в ячейках слева – пациентки с РМЖ, правые – здоровые женщины)
[Combinations of gene variants XPD 2251T>G, APEX1444 T>G and XPG 3310G>C indicating a predisposition to breast cancer in women who smoke.
Combinations of gene variants indicating a high risk of developing the disease - dark gray cells, lower risk - light gray cells, missing combinations of genotypes - white cells (bars in the cells on the left - patients with breast cancer, on the right - healthy women]
AA
XPD(2251DG)
GG TG TT
ATM(5557G>A) GA GG
XPD(22511>G) XPD(2251DG)
GG TG TT GG TG TT
(□ACDO 爾 adx
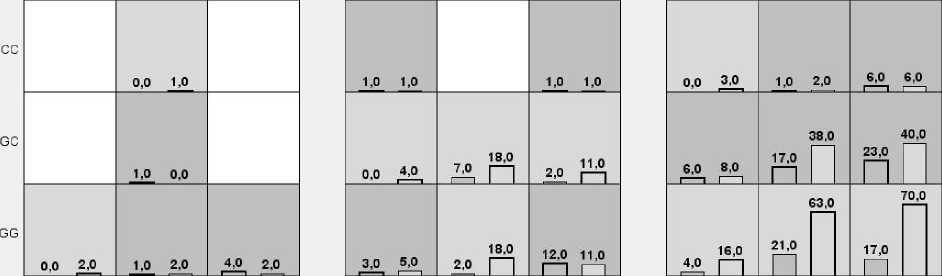
Рис. 3. Сочетания вариантов генов XPG 3310G>C, ATM 5557G >A и XPD 2251Т>G, указывающих на предрасположенность к возникновению онкозаболеваний молочной железы у некурящих женщин [Combinations of gene variants XPG 3310G>C, ATM 5557G>A and XPD 2251T>G indicating a predisposition to breast cancer in non-smoking women ]
Обсуждение
Рак молочной железы является наиболее распространенным злокачественным заболеванием у женщин. По оценкам GLOBOCAN 2020 каждая четвертая женщина страдает раком молочной железы, а каждая восьмая женщина умирает от рака молочной железы. Женщины старшего возраста имеют высокий уровень заболеваемости раком молочной железы. В 2018 г. 645 000 против 1–4 млн случаев рака молочной железы и 130 000 против 490 000 смертей были зарегистрированы в пременопаузальной и постменопаузальной группах соответственно [Sung et al., 2021]. В метааналитическом исследовании было отмече- но, что ранняя беременность и более длительное грудное вскармливание снижают ER (рецептор эстрогена) положительный и ER отрицательный риск развития рака молочной железы [Anstey et al., 2017; Fortner et al., 2019]. Поздний возраст вступления в брак и рождения ребенка приводит к недостаточной дифференциации тканей молочной железы, большему воздействию неэстрогенных мутагенов и генотоксичности эстрогенов, тем самым увеличивая риск РМЖ [Dey et al., 2009].
Кроме того, ожирение является еще одним сильным фактором риска развития рака молочной железы у женщин в постменопаузе, а также ассоциируется с плохим исходом заболевания у женщин всех возрастов [Picon‐Ruiz et al., 2017, Guo et al., 2018]. Также продолжает расти количество данных, что курение сигарет связано с повышенным риском развития рака молочной железы [Reynolds, 2013; Reiner et al., 2022]. В исследовании Gram показано, что женщины, которые курили более 5 лет до родов по сравнению с теми, кто никогда не курил, имели более высокий риск развития рака молочной железы в целом на 42% (95% CI: 1.13–1.78). [Gram et al., 2019].
Тройной негативный тип рака молочной железы представляет собой большой интерес для фундаментальных исследований генетики в виду его агрессивного течения. Его клетки характеризуются большим пролиферативным и метастатическим потенциалом в другие органы. Данный тип РМЖ может дополнительно подразделяться на другие подтипы, учитывая особенности экспрессии генов и молекул РНК, а также белков в составе опухолей. В итоге различают шесть подтипов: базальный 1-ого типа, базальный 2-ого типа, мезенхимальный, подтип подобный мезенхимальным стволовым клеткам, люминальный AR и иммунномодуляторный типы [Lehmann et al., 2011]. Тройной негативный тип возникает в 12–17% случаев у молодых женщин, которые также являются носителями мутаций в области генов BRCA . Его спорадическое формирование во многом определяется эпигенетическими изменениями в составе BRCA. В виду своего агрессивного течения, тройной негативный тип РМЖ более чувствителен к химиотерапии, что определяет наилучший прогноз лечения [Liedke et al., 2008]. В особенности наилучшую выживаемость среди пациентов обеспечивает неоадьювантная терапия.
В результате проведенного настоящего исследования были выявлены ассоциации между унаследованными вариантами ряда генов ферментов репарации ДНК и риском тройного негативного РМЖ. Была показана статистическая значимость вариантов гена XPG 3310G>C (rs17655 ) в общей и группе некурящих пациентов, и гена XPD 2251Т>G (rs13181 ) в группе курящих пациентов с риском формирования тройного негативного РМЖ у женщин, проживающих в промышленном регионе. По генам APEX1 444T>G (rs1130409), ATM 5557G >A (Ars180151), hOGG1 977C>G (rs1052133), ADPRT 2285 T>C (rs11610) статистически значимых ассоциаций выявлено не было.
Ген XPG кодирует белок, представляющий собой эндонуклеазу, которая вырезает поврежденный участок ДНК. XPG взаимодействует с комплексом TFIIH и обеспечивает прикрепление хеликаз для правильного разъединения цепей ДНК, делая их доступными для действия эндонуклеаз. Нарушение взаимодействия XPG–TFIIH приводит к диссоциации хеликаз и нарушению белкового комплекса, прерывая процесс репарации [Ito et al., 2007]. Adolf с соав. в своей работе показал, что генотип His/His XPG увеличивает риск РМЖ в 1.2 раза у молодых пациенток (<40 лет) (р = 0.028). Наличие генотипов Asp/His+His/His в 1.3 раза повышало риск развития РМЖ у пациенток с PR+ и в 1.1 раза снижало риск развития РМЖ у пациенток с люминальным-A типом РМЖ (p = 0.014, p = 0.020 соответственно) [Adolf et al., 2023]. Еще несколько ранее произведенных исследований также показали связь гена XPG с раком молочной железы [Na et al., 2015; Malik et al., 2018].
Ген XPD ( ERCC2 ) кодирует АТФ-независимую хеликазу. Это ключевой белок эксцизионной репарации нуклеотидов (NER), который узнает и исправляет различные мутации, образующиеся, например, после УФ-облучения или оксидативного стресса. В составе комплекса транскрипционных факторов (TFIIH) хеликаза XPD раскручивает цепь ДНК, обеспечивая доступ эндонуклеаз к поврежденному участку [Broughton, Steingrimsdottir, Lehmann, 1996]. Полиморфизм Lys751Gln (rs13181) является одним из наиболее широко изученных генетических маркеров XPD, и его роль в развитии рака очевидна [Ben-hamou, Sarasin, 2002]. В работах Smolarz с соав. генотип Gln/Gln гена XPD был связан с повышенным риском РМЖ и с тройным негативным РМЖ [Smolarz et al., 2014, 2019]. Samson и др. также сообщали, что генотип XPD Gln/Gln значительно связан с повышенным риском рака молочной железы у женщин Южной Индии [Samson et al., 2011]. Точно также Roberts с коллегами пришли к выводу, что варианты генов BER и NER могут влиять на риск развития рака молочной железы у человека [Roberts et al., 2011].
В рамках настоящего исследования проведено моделирование межгенных взаимодействий методом MDR. Для оценки межгенных взаимодействий с помощью MDR-анализа в отношении риска развития РМЖ у женщин использовали алгоритм всестороннего поиска (Exhaustive search algorithm), который оценивал все возможные комбинации исследованных полиморфных локусов. В результате анализа были выявлены наиболее информативные модели межгенных взаимодействий, детерминирующих формирование тройного негативного РМЖ у женщин: XPD 2251Т>G, APEX 1444 T>G, XPG 3310G>C и XPG 3310G>C, ATM 5557G>A, XPD 2251Т>G . Первая модель межгенных взаимодействий включала в себя гены XPD 2251Т>G, APEX 1444 T>G, XPG . Между генами XPD и APEX был выявлен сильный синергизм.
Ген XPG представляет собой локус с дублирующим эффектом. Вторую модель межгенных взаимодействий, связанную с развитием тройного негативного РМЖ у некурящих женщин, составили полиморфные локусы XPG 3310G>C, ATM 5557G>A, XPD 2251Т>G. Между генами XPG 3310G>C и ATM 5557G>A было выявлено взаимно усиливающее действие, а ген XPD 2251Т>G образовывал единый кластер с дублирующим эффектом данных генов.
Заключение
Подводя итог, можно сказать, что это исследование способствует раскрытию молекулярной основы тройного негативного рака молочной железы. Наши результаты указывают на гены репарации ДНК и их полиморфизмы, которые могут быть вовлечены в формирование рака молочной железы у женщин Кемеровской обл. Они могут найти практическое применение для улучшения диагностики рака на ранних стадиях развития и привести к снижению заболеваемости и смертности больных тройным негативным раком молочной железы.
Список литературы Изучение роли полиморфизма генов репарации ДНК в формировании предрасположенности к развитию тройного негативного рака молочной железы у женщин
- Злокачественные новообразования в России в 2020 году (заболеваемость и смертность) / под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М., 2021. 252 с.
- Adolf I.C. et al. The interplay between XPG-Asp1104His polymorphism and reproductive risk factors elevates risk of breast cancer in Tanzanian women: A multiple interaction analysis // Cancer Medicine. 2023. Vol. 12. P. 472-487.
- Anstey E.H. et al. Breastfeeding and breast cancer risk reduction: implications for black mothers // American journal of preventive medicine. 2017. Vol. 53, № 3. P. S40-S46.
- Benhamou S., Sarasin A. ERCC2/XPD gene polymorphisms and cancer risk // Mutagenesis. 2002. Vol. 17. P. 463-469. DOI: 10.1093/mutage/17.6.463.
- Broughton B.C., Steingrimsdottir H., Lehmann A.R. Five polymorphisms in the coding sequence of the Xeroderma pigmentosum group D gene // Mutat. Res.1996. Vol. 362. P. 209-211.
- Dey S. et al. Risk factors according to estrogen receptor status of breast cancer patients in Trivandrum, South India // International journal of cancer. 2009. Vol. 125(7). P. 1663-1670. DOI: 10.1002/ijc.24460.
- Fortner R.T. et al. Parity, breastfeeding, and breast cancer risk by hormone receptor status and molecular phenotype: results from the Nurses' Health Studies // Breast Cancer Research. 2019. Vol. 21, № 1. P. 1-9.
- Gram I.T. et al. Smoking and breast cancer risk by race/ethnicity and oestrogen and progesterone receptor status: the Multiethnic Cohort (MEC) study // Int. J. Epidemiol. 2019. Vol. 48, № 2. P. 501-511.
- Guo W. et al. Adiposity and breast cancer risk in postmenopausal women: results from the UK Biobank prospective cohort // International journal of cancer. 2018. Vol. 143, № 5. P. 1037-1046.
- Ito S. et al. XPG stabilizes TFIIH, allowing transactivation of nuclear receptors: Implications for Cockayne syndrome in XP-G/CS patients // Mol. Cell. 2007. Vol. 26. Art. 231.
- Kurfurstova D. et al. DNA damage signalling barrier, oxidative stress and treatment-relevant DNA repair factor alterations during progression of human prostate cancer // Mol. Oncol. 2016. Vol. 10. P. 879-894. DOI: 10.1016/j.molonc.2016.02.005.
- Lehmann B.D. et al. Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies // Journal of Clinical Investigation. 2011. Vol. 121, № 7. P. 2750-2767. DOI: 10.1172/jci45014.
- Liedke C. et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer // J. Clin. Oncol. 2008. Vol. 26. P. 1275-1281.
- Malik S.S. et al. An insight into clinical outcome of XPG polymorphisms in breast cancer // Molecular Biology Reports. 2018. Vol. 45(6). P. 2369-2375. DOI: 10.1007/s11033-018-4401-7.
- Na N. et al. Association between ERCC5 gene polymorphisms and breast cancer risk // Int. J. Clin. Exp Pathol. 2015. Vol. 8, № 3. Art. 3192.
- Obeagu E.I., Obeagu G.U. Breast cancer: A review of risk factors and diagnosis // Medicine (Baltimore). 2024. Vol. 103, № 3. Art. e36905. DOI: 10.1097/MD.0000000000036905.
- Picon-Ruiz M. et al. Obesity and adverse breast cancer risk and outcome: mechanistic insights and strategies for intervention // CA: a cancer journal for clinicians. 2017. Vol. 67, № 5, P. 378-397.
- Reiner A.S. et al. Smoking, Radiation Therapy, and Contralateral Breast Cancer Risk in Young Women // JNCI: Journal of the National Cancer Institute. 2022. Vol. 114(4). P. 631-634. DOI: 10.1093/jnci/djab047.
- Reynolds P. Smoking and Breast Cancer // J. Mammary Gland. Biol. Neoplasia. 2013. Vol. 18, № 1. P. 15-23.
- Roberts M.R. et al. Singlenucleotide polymorphisms in DNA repair genes and association with breast cancer risk in the web study // Carcinogenesis. 2011. Vol. 32. P. 1223-1230.
- Rudolph A., Chang-Claude J., Schmidt M.K. Geneenvironment interaction and risk of breast cancer // Br. J. Cancer. 2016. Vol. 114, № 2. P. 125-133.
- Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning. A Laboratory Manual. N.Y.: Cold Spring Harbor Lab., 1989. 1659 p.
- Samson M. et al. XPD Lys751Gln increases the risk of breast cancer // Oncol. Lett. 2011. Vol. 2. P. 155-159.
- Siegel R.L et al. Cancer Statistics // CA Cancer J. Clin. 2021. Vol. 71, № 1. P. 7-33.
- Smolarz B. et al. Single nucleotide polymorphisms (SNPs) of ERCC2, hOGG1, and XRCC1 DNA repair genes and the risk of triple-negative breast cancer in Polish women // Tumour Biol. 2014. Vol. 35, № 4. P. 34953502.
- Smolarz B. et al. Polymorphism of DNA repair genes in breast cancer // Oncotarget. 2019. Vol. 10, № 4. DOI: 10.18632/oncotarget.265688.
- Sun Y.S. et al. Risk Factors and Preventions of Breast Cancer // Int. J. Biol. Sci. 2017. Vol. 13, № 11. P. 1387-1397. DOI: 10.7150/ijbs.21635.
- Sung H.J. et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries // CA: a cancer journal for clinicians. 2021. Vol. 71, № 3. P. 209-249.
- Torgovnick A., Schumacher B. DNA repair mechanisms in cancer development and therapy // Front Genet. 2015. Vol. 6. Art. 157. DOI: 10.3389/fgene.2015.00157.


