Изучение свойств гидролизатов из вторичного рыбного сырья, полученных сочетанием технологий ферментативного гидролиза и ультразвукового воздействия
Автор: Антонова А.Д., Науменко Н.В., Зайцев В.Г., Калинина И.В.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биотехнология пищевых продуктов и биологически активных веществ
Статья в выпуске: 4-2 т.28, 2025 года.
Бесплатный доступ
Развитие пищевой индустрии требует эффективной переработки сырья с получением сырьевых ингредиентов, обладающих полезными и функциональными свойствами. В качестве одного из таких подходов может быть использован процесс ферментативно-ультразвукового воздействия в технологии гидролиза вторичного рыбного сырья, полученного из остатков филетирования атлантической трески. Целью исследования являлось изучение свойств гидролизатов из вторичного рыбного сырья, полученных как единичным ферментативным гидролизом, так и с предварительной оптимизированной ультразвуковой обработкой. В процессе работы проведены рекогносцировочные исследования с вариацией мощности 120, 240 и 360 Вт и длительности воздействия 1, 3, 5 мин. Определены оптимальные параметры воздействия: мощность 320 Вт и длительность воздействия 3,5 мин до внесения ферментативного препарата. Доказано, что использование ультразвукового воздействия в технологии получения гидролизатов из вторичного рыбного сырья позволяет повысить степень гидролиза в среднем на 4–5 % при частичном снижении количества внесения ферментативного препарата ("Протозим С"). Процесс ферментативного гидролиза протекает более активно, что подтверждают результаты молекулярно-массового распределения белковых фракций гидролизатов; для данного образца характерны полосы размерного ряда 10–15 кДа, относительно 43–95 кДа контрольного образца (не подвергаемого процессу ферментативного гидролиза). В ходе проведения ИК-спектроскопии опытных образцов гидролизатов обнаружены пики, косвенно подтверждающие изменения структуры и частичную дезагрегацию белковых молекул. Таким образом, ферментативно-ультразвуковой гидролиз вторичного рыбного сырья трески атлантической способствует увеличению степени гидролиза, растворимости и антиоксидантной активности полученных гидролизатов, обеспечивая формирование белковых ингредиентов с улучшенными пищевыми и технологическими свойствами.
Вторичное рыбное сырье трески атлантической, ферментативный гидролиз, ультразвуковое воздействие, ферментативно-ультразвуковое воздействие
Короткий адрес: https://sciup.org/142246576
IDR: 142246576 | УДК: 639.3 | DOI: 10.21443/1560-9278-2025-28-4/2-577-587
Текст научной статьи Изучение свойств гидролизатов из вторичного рыбного сырья, полученных сочетанием технологий ферментативного гидролиза и ультразвукового воздействия
DOI:
Антонова А. Д. и др. Изучение свойств гидролизатов из вторичного рыбного сырья, полученных сочетанием технологий ферментативного гидролиза и ультразвукового воздействия. Вестник МГТУ. 2025. Т. 28, № 4/2. С. 577–587. DOI:
e-mail: , ORCID:
Antonova, A. D. et al. 2025. Study of the properties of hydrolysates from secondary fish raw materials obtained by a combination of enzymatic hydrolysis and ultrasonic treatment technologies. Vestnik of MSTU, 28(4/2), pp. 577–587. (In Russ.) DOI:
В настоящее время как в Российской Федерации, так и в мировом масштабе активно развивается направление глубокой переработки рыбы и нерыбных морепродуктов. В 2024 г. было произведено более полумиллиона тонн (529,7 тыс. т) рыбного филе и фарша, данный показатель на 9,4 % превышает объемы производства 2023 г. По данным Росстата объемы мороженого рыбного филе в 2024 г. составили 232,8 тыс. т, что на 5 % больше, чем в 2023 г. Несмотря на сокращение объемов вылова трески атлантической и тихоокеанской в первой половине 2025 г., масштабы переработки данного вида сырья стабильно высоки и за январь - июнь 2025 г. составили более 110 тыс. т. На сегодняшний день более 90 % рыбного сырья реализуется конечному потребителю в виде замороженного филетированного полуфабриката без кожи, при этом вторичное рыбное сырье (хребтовые кости с прирезями мяса, кожа, хвосты, плавники), образующееся в больших количествах, имеет достаточно высокую пищевую ценность, и может быть переработано в сырьевые ингредиенты для пищевой промышленности ( Мезенова и др., 2025а; Деркач и др., 2024 ).
Одним из способов переработки вторичных рыбных сырьевых ресурсов является ферментативный гидролиз, который позволяет выделять ценные белки и создавать конечные пищевые продукты с высокой биологической ценностью ( Вилкова и др., 2024; Мезенова и др., 20256; Деркач и др., 2024 ). Применение ферментативных препаратов в данном процессе открывает новые возможности для разработки технологий переработки и повышения ценности продукции на основе рыбного сырья, почти 80 % общего количества белка можно извлечь в виде пептидов и свободных аминокислот из вторичного рыбного сырья ( Ramakrishnan et al., 2013 ). Однако традиционный ферментативный гидролиз по-прежнему может быть затруднен многими составляющими факторами, такими как низкая конверсия субстрата, низкое использование ферментов и низкая эффективность ферментативного гидролиза ( Ramakrishnan et al., 2013; Li et al., 2021 ). При этом комплексный подход в технологии получения гидролизатов (использование современных методов воздействия с последующим проведением гидролиза) может способствовать более полному извлечению белковых ингредиентов ( Hong et al., 2019 ). Одним из таких экологически чистых и эффективных подходов может быть ультразвуковое воздействие.
Согласно ряду исследований ( Naumenko et al., 2022; Cropotova et al., 2024 ) ультразвуковое воздействие оказывает положительное влияние на эффективность протекания ферментативных реакций в процессе гидролиза. Так, использование ультразвукового воздействия повышает степень гидролиза, биологическую и антиоксидантную активность сырьевых ингредиентов, полученных из животных и растительных белков, а также формирует функциональные свойства молочных гидролизатов. Оптимально подобранные режимы ультразвукового воздействия могут обеспечить положительное воздействие кавитационных эффектов, заключающееся в улучшении растворимости белков, повышении адсорбционной способности на границе раздела фаз, при этом гидрофобные группы белка становятся более доступны ферментативному гидролизу ( Krasulya et al., 2022; Тинамбунан и др., 2025 ).
Данный подход был эффективно применен при переработке вторичных рыбных ресурсов и увеличении выхода белка из скумбрии и побочных продуктов из форели, также использование ультразвука подтверждено многочисленными исследованиями ( Chemat et al., 2017) . Авторы отмечают, что ультразвук может применяться в ферментативном гидролизе тремя основными подходами: ультразвуковая обработка ферментов, ультразвуковая обработка во время протекания процесса ферментации и ультразвуковая предварительная обработка. Кавитационные эффекты при предварительной обработке ультразвуковым воздействием могут разворачивать структуры субстратов и изменять их конформацию для более легкого ферментативного воздействия ( Pu et al., 2017 ). Кроме того, уменьшение размера частиц может усилить массоперенос и ускорить реакции ферментативного гидролиза ( Wang et al., 2018 ). Таким образом, исследование возможности использования предварительного воздействия ультразвука для интенсификации и повышения эффективности процесса ферментативного гидролиза является актуальным.
Цель исследования - изучить свойства гидролизатов из вторичного рыбного сырья (остатков филетирования трески атлантической), полученных как единичным ферментативным гидролизом, так и с предварительной оптимизированной ультразвуковой обработкой.
Материалы и методы
Для получения белковых гидролизатов было использовано следующее сырье:
-
- вторичное рыбное сырье, полученное из остатков филетирования атлантической трески ( Gadus morhua ) (хребтовые кости с прирезями мяса, кожа, хвосты, плавники);
-
- ферментный препарат: протеаза щелочная грибная ( Fungal protease ) "Протозим С", полученная путем культивирования штамма гриба Acremonium chrysogenum с последующей очисткой и концентрированием, заявленная активность фермента 50 000 ед/г., РФ.
Для получения белковых гидролизатов подмороженное вторичное рыбное сырье измельчали на волчке с диаметром отверстий на решетке 2-3 мм, заливали раствором 1%-й уксусной кислоты и выдерживали в течение 30 мин при постоянном перемешивании с последующим промыванием в течение 5 мин под проточной водой и формированием водно-сырьевой смеси в соотношении вторичное рыбное сырье : вода 1 : 4,5 с добавлением раствора гидрооксида натрия до достижения значений рН 8,5–9,0. Далее вносили фермент "Протозим С", процесс ферментативного гидролиза проводили при температуре 50 °С, затем процесс ферментации останавливали нагреванием до 80 °С, систему гидролизата центрифугировали при 4 000 об/мин, фильтровали и высушивали до влажности не более 8 %.
Дополнительно перед внесением фермента проводили ультразвуковую обработку вторичного рыбного сырья в водно-сырьевой смеси. Для этого был использован прибор "Волна Модель УЗТА-0,4/22-ОМ" (частота 22 ± 1,6 кГц, интенсивность 10 Вт/см², максимальная мощность 400 Вт).
Для проведения исследований были определены следующие образцы:
-
– контроль – порошок, полученный высушиванием распылительной сушкой концентрированного рыбного бульона из вторичного рыбного сырья трески атлантической (процесс ферментативного гидролиза не проводился);
-
– образец 1 – гидролизат, полученный созданием водно-сырьевой смеси и проведением процесса ферментации с использованием фермента "Протозим С" в количестве 3,5 % к массе сухого сырья, процесс ферментативного гидролиза проводили по описанной выше технологии;
-
– образец 2 – гидролизат, полученный созданием водно-сырьевой смеси и проведением процесса ферментации с использованием фермента "Протозим С" в количестве 2,5 % к массе сухого сырья с предварительной (до внесения фермента) ультразвуковой обработкой при мощности 320 Вт и длительности воздействия 3,5 минуты.
Степень гидролиза (СГ) определяли методом титрования формалином как долю (%) свободных аминогрупп по отношению к общему содержанию азота в образце, предварительно определенному методом Кьельдаля согласно ГОСТ 7636-851. Степень гидролиза определялась согласно методикам, описанным в ( Zinina et al., 2023 ) и рассчитывалась по формуле
СГ =l N AA - N AA 0 |x i00%, (1)
I N oa - N AA 0 )
где N ОА – содержание общего азота, %; N AA0 – аминный азот в негидролизованном образце, %; N АА – содержание аминного азота в гидролизате после гидролиза в течение определенного периода времени, %.
Для идентификации структурных особенностей гидролизатов по спектру их поглощения в инфракрасной области проводили измерения FTIR с использованием ИК-Фурье. Для этого из высушенных гидролизатов формировались ИК-прозрачные кремниевые пластины по 0,0002 ± 0,2 г. Измерения FTIR проводились с использованием ИК-Фурье спектрометра IRAffinity-1S (Shimadzu, Япония). Спектры регистрировались в диапазоне от 4 000 до 400 см-1 со спектральным разрешением 4 см-1 и апертурой 5,0 мм. Для каждого спектра было собрано и усреднено 20 интерферограмм.
Для исследования распределения белковых фракций исследуемых образцов гидролизатов был применен денатурирующий электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) с использованием вертикальной электрофорезной камеры Mini-PROTEAN Tetra Cell, источник питания – PowerPac Basic Power Supply (Bio-Rad, США). Визуализация результатов осуществлялась с помощью высокочувствительных методов окрашивания (Кумасси G-250 по Neuhoff) с последующим денситометрическим анализом и сравнением с маркерами молекулярной массы.
Определение общей токсичности полученных гидролизатов проводили методом биотестирования на простейших Paramecium caudatum . Подсчет инфузорий осуществляли на приборе "БиоЛаТ-3.2" с использованием программы Auto Ciliata XP.
Массовую долю влаги, золы, гидролизатов определяли по ГОСТ 31795-20122.
Общую антиоксидантную активность (ОАО, % (DPPH)) определяли в 1%-х растворах гидролизатов с использованием 2,2-дифенил-1-пикрилгидразила (DPPH), светопоглощение измеряли при 515 нм.
Для определения растворимости навеску гидролизата массой 10 г растворяли в 100 см3 дистиллированной воды, нагретой в термостате до 24 °С, перемешивали в лабораторном смесителе в течение 90 с, переносили раствор во взвешенные центрифужные пробирки и центрифугировали в течение 5 мин при 4 000 об/мин. Затем декантировали верхний слой жидкости и взвешивали пробирки с осадком. Растворимость (Р) вычисляли по формуле
P = 100 -
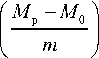
x 100%,
где М р – масса раствора в пробирке, г; М о – масса осадка в пробирке, г; m – масса навески гидролизата, г.
Все результаты исследований проводились в трехкратной повторности и обрабатывались на основе методов математической статистики с использованием Microsoft Excel и MathCad 14.0. Полученные данные представлены с доверительным коэффициентом 0,95.
Результаты и обсуждение
Ультразвуковое воздействие, основанное на кавитационных эффектах, может увеличить проницаемость пищевых систем и обеспечить более эффективное внедрение водной фазы в клеточную матрицу, что в конечном счете будет способствовать взаимодействию раствора фермента с рыбным сырьем. Эффективность ферментационных процессов может значительно возрастать благодаря улучшению массопереноса и динамики внутренней диффузии. При этом механические эффекты, возникающие в результате ультразвуковой предварительной обработки, могут разрыхлять структуру субстратов и частично менять их конформацию, облегчая взаимодействие с растворами ферментов. Снижение размеров частиц сформированной системы способствует улучшению массопереноса и ускорению ферментационных процессов.
На начальном этапе исследования с целью определения оптимальных параметров предварительного воздействия ультразвука на эффективность процесса ферментации использовали следующие параметры варьирования мощности: 120, 240 и 360 Вт и длительности воздействия: 1, 3, 5 мин. Воздействие осуществляли методом погружения рабочего элемента грибкового типа в водно-сырьевую смесь с вторичным рыбным сырьем при постоянном перемешивании. Полученные результаты двухфакторного планирования эксперимента по сочетанию параметров представлены на рис. 1.
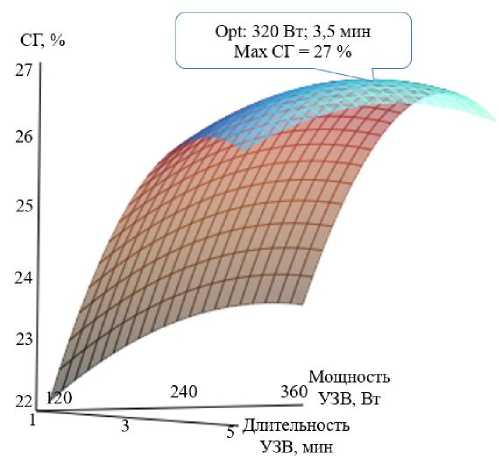
Y = –2,685 ⋅ 10–4 ⋅ X 2 – 0,242 ⋅ X 2 – 2,49 ⋅ 10–3 ⋅ X 1 ⋅ X 2 + 0,17 ⋅ X 1 + 2,471 ⋅ X 2 – 4,143.
Рис. 1. Результаты оптимизации процесса гидролиза вторичного рыбного сырья по показателю "Степень гидролиза, %" от мощности и длительности ультразвукового воздействия
Fig. 1. Results of the optimization of the hydrolysis process of secondary fish raw materials by the "Degree of hydrolysis, %" indicator depending on the power and duration of ultrasonic exposure
Полученные данные позволяют сказать, что использование ультразвукового воздействия повышает степень гидролиза при частичном снижении количества внесения ферментативного препарата. Так, при использовании 3,5 % фермента к массе сухого сырья (образец 1) степень гидролиза на конец проведения процесса составила 22 %, тогда как с предварительной ультразвуковой обработкой значения данного показателя повышаются до 26–27 %.
Повышение степени гидролиза Ji et al. (2021) связывают со структурными повреждениями и денатурацией белковых субстратов, обусловленными ультразвуковой кавитацией, за счет которой наблюдается уменьшение размера частиц субстратов и, следовательно, белковые молекулы подвергаются большему воздействию ферментативных препаратов. Однако необходимо отметить, что по мере увеличения мощности ультразвука с 120 до 360 Вт показатель "Степень гидролиза, %" постоянно возрастает и достигает максимального значения 26,8 % при мощности 320 Вт. При использовании мощности более 320 Вт значения степени гидролиза снижаются, поскольку водно-сырьевая смесь с вторичным рыбным сырьем может перегреваться, а создаваемое кавитационным эффектом ультразвука давление пара имеет слишком высокие значения и оказывает негативное воздействие на структуру белка. Другой возможной причиной может являться наличие эффекта "акустического экранирования" (Wang et al., 2016; Zhou et al., 2017). Высокая интенсивность ультразвукового воздействия способствует образованию микропузырьков при их повышенной плотности. При этом их кластеры могут препятствовать проникновению ультразвука в глубинные слои обрабатываемой системы, что обусловливает непрямую зависимость между увеличением мощности кавитационного воздействия и степени гидролиза (Zhou et al., 2017).
Проводимый в исследовании ферментативный гидролиз белка протеолитическим ферментом катализирует гидролиз пептидных связей. Данная реакция может приводить к образованию C-концевых групп (COO–), N-концевых групп (NH3+) и изменению первичной и вторичной структуры белка, а также образованию полипептидов и пептидов. Результаты FTIR-анализа, используемого для идентификации структурных особенностей гидролизатов по спектру их поглощения в инфракрасной области, представлены на рис. 2.
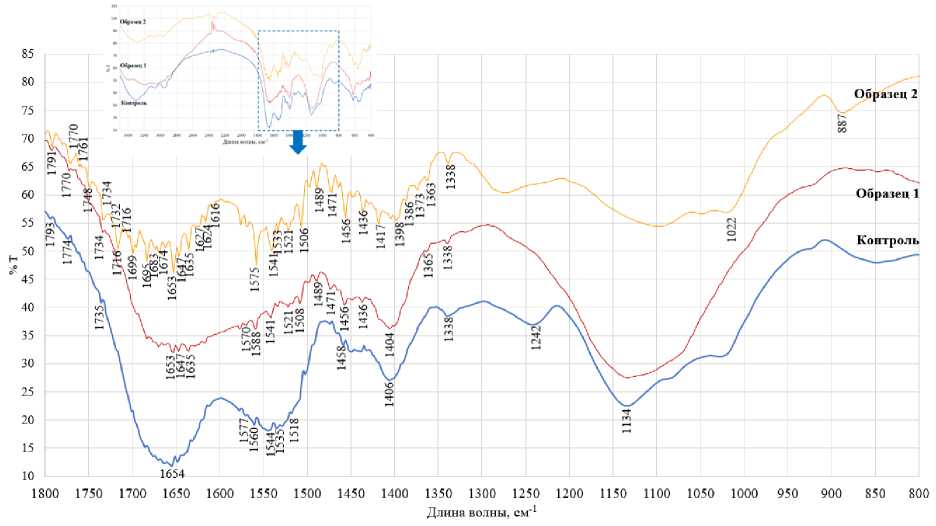
Рис. 2. Характерный вид ИК-спектров гидролизатов, полученных согласно FTIR-анализа Fig. 2. Characteristic appearance of the IR spectra of hydrolysates obtained by FTIR analysis
Полученные спектры исследуемых образцов, снятые в диапазоне волновых чисел от 3 500 до 400 см–1, имеют схожее химическое строение. ИК-спектры гидролизатов включают две характерные области: коротковолновый диапазон (3 500–2 800 см–1) и длинноволновый диапазон электромагнитного спектра (1 800–800 см–1) ( Соколов, 2021 ). Коротковолновый диапазон (3 500–2 800 см–1) содержит полосы валентных колебаний связей С–Н, N–H и O–H, положение и интенсивность которых для контрольного и опытных образцов несколько отличаются. Для контрольного образца идентифицированы пики при 2960 и 2937 см–1, что, возможно, свидетельствует о наличии разноупорядоченных метил- и метильных соединений –СО–NH–, характерных для белков.
Согласно ряду исследований ( Quan et al., 2019; Вилкова и др., 2024 ) колебания связей атомов, входящих в состав функциональных групп белковых молекул, пептидов, а также низкомолекулярных продуктов гидролиза, характерны поглощениям в длинноволновой области электромагнитного спектра (1 800–800 см–1).
Наличие значительных пиков в диапазоне 1 800–1 600 см–1 может быть обусловлено присутствием карбоксильных групп. У образцов 1 и 2 наблюдается значительное количество пиков: 1 338–1 430 см–1, что соответствует наличию соединений типа (NH 4 +-группа в аминах); 1 489–1 539 см–1, что, вероятно, соответствует наличию ОН-группы в составе СООН-групп; 1 506–1 616 см–1 – соответствует соединениям типа (CH 3 , С–H); регистрируются пики 1 647 см–1, 1 653 см–1, 1 645 см–1, 1 653 см–1, связанные с растяжением связи С=О. Причем для образца 2 математическая обработка данных выявила гораздо большее количество пиков в диапазоне 1 800–1 300 см–1.
Выявленные пики 1 521 см–1, 1 539 см–1, 1 541 см–1, 1 539 см–1, 1 558 см–1 могут быть связаны с деформацией связи N–H ( Соколов, 2021 ). Представленные изменения в характеристиках ИК-спектров в зависимости от вида используемого сырья и процесса проведения гидролиза согласуются с разрушением амидной основы и образованием амино- и карбоксилатных концов. Полосы при 1 516 см -1 (–NH 3+ ) и ∼1 400 см -1 (–COO - ) – это некоторые из наиболее последовательных маркеров времени гидролиза.
Рядом авторов доказано ( Quan et al., 2019; Вилкова и др., 2024; Zaky et al., 2020; Fadimu et al., 2022 ), что ферментативный гидролиз оказывает значительное влияние на распределение размерного ряда пептидов и полученных гидролизатов. Также ( Quan et al., 2019 ) отмечается, что ультразвук может вызывать конформационные изменения белка, уменьшая межмолекулярные взаимодействия и улучшая расщепляемость пептидных связей. Для формирования доказательной базы изменения молекулярно-массового распределения белковых фракций был использован метод одномерного электрофореза в полиакриламидном геле (рис. 3).
кДа250
130 ^^95 ^a95 70 кДа70
I ___• 55 кДа
43 кДа
34 -
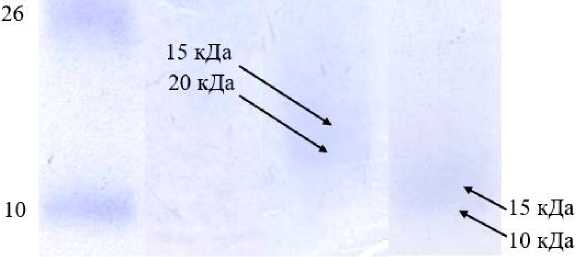
Стандарт Контроль Образец 1 Образец 2
Рис. 3. Характерный вид одномерной электрофореграммы распределения белковых фракций исследуемых образцов гидролизатов
Fig. 3. Typical appearance of a one-dimensional electrophoregram of the distribution of protein fractions in the studied hydrolysate samples
У контрольного образца (высушенного рыбного бульона) отмечается наличие высокомолекулярных белковых фракций размерного ряда 43–95 кДа. Для образца 1 визуализируются полосы 15–20 кДа, что подтверждает наличие низкомолекулярных белков в полученном гидролизате. Использование комбинированного ферментативно-ультразвукового воздействия в гидролизе вторичного рыбного сырья позволяет получить более мелкие пептидные фракции. Так, для образца 2 характерны полосы размерного ряда 10–15 кДа, что подтверждает эффективность предложенного подхода. Ряд исследователей ( Zaky et al., 2020; Fadimu et al., 2022 ) в своих работах отмечают, что после ультразвукового воздействия рыбные белки становятся более восприимчивыми к расщеплению протеиназой. Данные результаты они связывают с разрушением пептидных связей, что подтверждается повышением значения степени гидролиза растворов гидролизатов (Zaky et al., 2020) . Данный эффект Fadimu и его коллеги объясняют способностью ультразвука размягчать вторичное рыбное сырье, делать его более доступным для проникновения ферментативных растворов, что позволяет протеиназе расщеплять высокомолекулярные белки на низкомолекулярные пептиды (Fadimu et al., 2022) .
Важное значение имеет безопасность полученных гидролизатов, так как дальнейшее их использование в технологии пищевых продуктов должно позволить получить безопасные изделия повышенной пищевой ценности. Безопасность полученных гидролизатов была подтверждена с использованием простейших Paramecium caudatum на приборе "БиоЛаТ-3.2", результаты представлены на рис. 4.
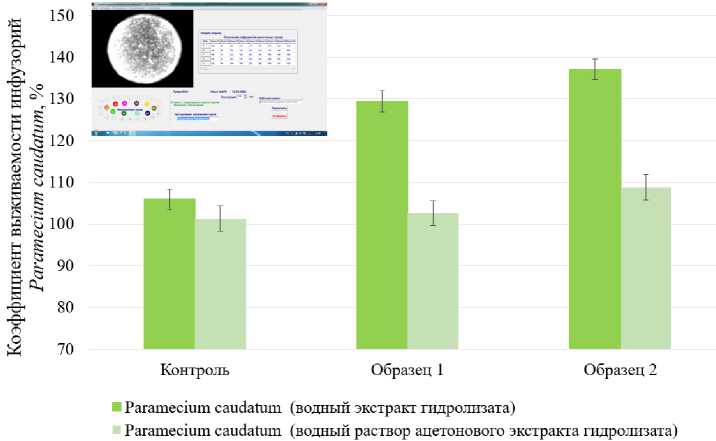
Рис. 4. Результаты определения безопасности полученных гидролизатов с использованием простейших Paramecium caudatum
Fig. 4. Results of determining the safety of the obtained hydrolysates using the protozoan Paramecium caudatum
Полученные данные позволяют сказать, что разработанные исследуемые образцы гидролизатов безопасны, так как в процессе проведения эксперимента (2 ч) при их внесении в культуру простейших наблюдается выраженный прирост как в водных, так и в ацетоновых экстрактах. Для опытных образцов наблюдается значительное увеличение колонии простейших на конец эксперимента. Прирост для водных экстрактов составил в среднем у образца 1 – 23,5 %, у образца 2 – 31,0 %; для ацетоновых экстрактов в среднем 1,5–7,5 %, что позволяет говорить о повышении потенциальной биодоступности полученных образцов гидролизатов.
На следующем этапе исследования были определены органолептические и физико-химические показатели качества полученных гидролизатов, представленные в таблице.
Таблица. Органолептические и физико-химические показатели качества гидролизатов Table. Organoleptic and physicochemical quality indicators of hydrolysates
|
Наименование показателя |
Наименование образца |
||
|
Контроль |
Образец 1 |
Образец 2 |
|
|
Фото образца |
|||
|
Внешний вид |
Порошок с включениями крупных агломератов |
Мелкодисперсный однородный порошок |
|
|
Запах |
С выраженным запахом рыбы |
Со слабым запахом рыбы |
|
|
Цвет |
Желтый |
Светло-желтый |
Светло-желтый |
|
Консистенция |
Умеренно сыпучая |
Умеренно сыпучая |
Умеренно сыпучая |
|
Массовая доля влаги, % |
9,9 ± 0,4 |
7,9 ± 0,4 |
7,8 ± 0,4 |
|
Массовая доля белка, % |
70,2 ± 0,5 |
89,2 ± 0,5 |
90,5 ± 0,5 |
|
Массовая доля золы, % |
3,9 ± 0,3 |
2,9 ± 0,3 |
3,1 ± 0,3 |
|
Степень гидролиза, % |
– |
23,7 ± 0,4 |
27,0 ± 0,3 |
|
Растворимость, % |
82,4 ± 2,1 |
92,6 ± 2,3 |
96,4 ± 2,2 |
|
АОА, % (DPPH) |
23,4 ± 0,5 |
59,4 ± 0,3 |
64,8 ± 0,6 |
Результаты оценки органолептических и физико-химических показателей исследуемых образцов гидролизатов показали выраженные различия между контрольным образцом и продуктами, полученными с применением ферментативного и ферментативно-ультразвукового воздействия. Контрольный образец, представлявший собой высушенный концентрат рыбного бульона без проведения процесса гидролиза, характеризовался наличием крупных агломератов в порошке и выраженным запахом рыбы. Цвет имел интенсивно-желтый оттенок, консистенция – умеренно сыпучая. Массовая доля влаги составляла 9,9 ± 0,4 %, а содержание белка – 70,2 ± 0,5 %, что отражает неполное разрушение белковых структур и сохранение высокомолекулярных соединений. Содержание золы (3,9 ± 0,3 %) свидетельствует о присутствии минеральных веществ, характерных для исходного сырья. Образец 1, полученный ферментативным гидролизом с использованием 3,5 % ферментного препарата, отличался более равномерной дисперсностью и светложелтым цветом порошка с ослабленным рыбным запахом. Снижение влажности до 7,9 ± 0,4 % обеспечило лучшую сыпучесть и стабильность при хранении. Уровень белка повысился до 89,2 ± 0,5 %, что подтверждает высвобождение низкомолекулярных пептидов в водно-сырьевую смесь. Степень гидролиза составила 23,7 ± 0,4 %, что подтверждает активное протекание ферментативных реакций. Повышение растворимости до 92,6 ± 2,3 % и рост антиоксидантной активности до 59,4 ± 0,3 % свидетельствуют о формировании пептидных фракций, способных проявлять восстановительные свойства. Образец 2, для которого использовалась предварительная ультразвуковая обработка при мощности 320 Вт и длительности 3,5 мин, имел наиболее однородную структуру и светло-желтый цвет. Его органолептические показатели характеризовались слабым специфическим запахом и высокой однородностью порошка. Физико-химический анализ показал увеличение массовой доли белка до 90,5 ± 0,5 %. Значения золы (3,1 ± 0,3 %) оставались в пределах статистической погрешности, однако степень гидролиза достигала 27,0 ± 0,3 %, что в среднем на 3,3 % выше по сравнению с образцом 1. Растворимость возросла до 96,4 ± 2,2 %, подтверждая образование низкомолекулярных пептидов с высокой водорастворимостью. Наибольшая антиоксидантная активность (64,8 ± 0,6 %) и высокая степень гидролиза указывают на усиление биологической ценности гидролизата, что согласуется с ранее представленными данными о положительном влиянии ферментативноультразвукового воздействия на разрушение пептидных связей и генерацию свободных аминогрупп.
Таким образом, полученные данные подтверждают эффективность интеграции ультразвуковой предобработки в процесс ферментативного гидролиза вторичного рыбного сырья трески атлантической, что обеспечивает получение безопасных и функционально активных белковых ингредиентов с улучшенными технологическими свойствами.
Заключение
Результаты проведенных исследований подтвердили, что использование ультразвукового воздействия в технологии получения гидролизатов из вторичного рыбного сырья позволяет повысить степень гидролиза при частичном снижении количества внесения фермента. Оптимальными параметрами ультразвукового воздействия определены мощность 320 Вт и длительность 3,5 мин, при которых степень гидролиза увеличивалась в среднем на 4–5 % по сравнению с традиционным ферментативным методом. Для образца, подвергнутого ультразвуковой обработке (образец 2), степень гидролиза составила 27,0 ± 0,3 % по сравнению с 23,7 ± 0,4 % у образца 1. Процесс ферментативного гидролиза протекает более активно, что подтверждают результаты молекулярно-массового распределения белковых фракций гидролизатов, так для данного образца характерны полосы размерного ряда 10–15 кДа относительно 43–95 кДа контрольного. В ходе проведения ИК-спектроскопии опытных образцов гидролизатов обнаружены пики, косвенно подтверждающие изменения структуры и частичную дезагрегацию белковых молекул. Данный факт позволяет говорить об эффективности ферментативно-ультразвукового воздействия в технологии получения гидролизатов из вторичного рыбного сырья и обусловливает перспективность дальнейших исследований.


