Изучение толерантности энтеробактерий к хлорсодержащим биоцидным средствам в экспериментальных моделях с использованием хромогенных индикаторных тест-систем
Автор: Ефимочкина Н.Р., Быкова И.Б., Короткевич Ю.В., Маркова Ю.М., Минаева Л.П., Шевелева С.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Экспериментальные модели и инструментальные исследования для оценки риска в гигиене и эпидемиологии
Статья в выпуске: 3 (11), 2015 года.
Бесплатный доступ
Изучен видовой состав микроорганизмов - контаминантов растительного сырья и оборудования, используемого в производстве биотехнологических продуктов и напитков брожения; выделено и изучено 85 культур энтеробактерий, из них идентифицировано до вида 46 штаммов родов Enterobacter, Pantoea, Citrobacter, Serratia, Escherichia, Cronobacter; наиболее часто обнаруживали представителей родов Enterobacter и Pantoea (около 50 %). Впервые разработана и апробирована хромогенная модель in vitro на основе индикаторной тест-системы, позволяющая проводить количественную оценку степени ингибирования грамотрицательной микрофлоры под воздействием антимикробных средств в зависимости от концентраций биоцидов и плотности бактериальных популяций. Сделан сравнительный анализ толерантности штаммов энтеробактерий, выделенных из различных биотопов; проведено тестирование чувствительности к обработке хлорсодержащими биоцидами 26 штаммов энтеробактерий из растительного сырья и 9 штаммов Escherichia coli, выделенных из кишечника крыс - самцов линии Вистар. Энтеробактерии из растительного сырья и смывов были более устойчивы к антимикробному действию хлора, нежели представители популяций нормальной кишечной микробиоты животных. Установлено, что концентрации активного хлора 50-100 мг/дм 3, наиболее часто используемые при обработке растительного сырья, неэффективны для бактерий семейства Enterobacteriaceae, если плотность микробной популяции составляет 10 5-7 клеток/см 3 и выше. При исходном уровне контаминации энтеробактериями не более 10 3 клеток/см 3 обработка растворами с концентрацией активного хлора 75-100 мг/дм 3 может обеспечить эффективное обеззараживание сырья, оборудования или инвентаря. Экспериментальная хромогенная модель in vitro, предложенная для оценки воздействия хлорсодержащих средств на степень ингибирования энтеробактерий, может быть использована для обоснования и подбора концентраций рабочих растворов антимикробных средств, эффективных в отношении других групп микробных контаминантов, что позволит оптимизировать применение режимов дезинфекции сырья и санитарной обработки оборудования на предприятиях пищевой промышленности.
Энтеробактерии, хромогенная модель in vitro, растительное сырье, хлорсодержащие биоцидные средства, толерантность
Короткий адрес: https://sciup.org/14237922
IDR: 14237922 | УДК: 576.8.097.29
Текст научной статьи Изучение толерантности энтеробактерий к хлорсодержащим биоцидным средствам в экспериментальных моделях с использованием хромогенных индикаторных тест-систем
Современные эволюционные теории формирования механизмов патогенности бактерий, обеспечивающих взаимодействие возбудителя со средой обитания в соответствующих экологических нишах и сообщающих устойчивость к неблагоприятным условиям существования, являются основой для разработки новых подходов к изучению поведения пищевых бактериальных патогенов под воздействием физико-химических, технологических и иных параметров производства и хранения пищевых продуктов.
Влияние неблагоприятных воздействий внешней среды на жизненно важные функции бактериальной клетки происходит на различных регуляторных уровнях, что может приводить к появлению индуцированной толерантности микроорганизмов к воздействию тех или иных бактерицидных факторов. В природных условиях, а также при санитарной обработке воды и оборудования толерантность бактерий может формироваться под влиянием различных антибактериальных агентов, в том числе хлора, кислот, щелочей, консервантов, антиоксидантов, бактериофагов, колицинов, акрилатов, ионов металлов [1, 6, 12].
В пищевой промышленности в качестве меры, снижающей обсемененность патогенными микроорганизмами, в настоящее время достаточно широко применяют хлорсодержащие средства [4, 10, 11, 13]. Свободный хлор и выделяющие его соединения (гипохлорит натрия, кальция, магния, хлорная известь, хлорамин, диоксид хлора, дихлоризоцианураты натрия и калия), обладая высокой антимикробной активностью против большинства болезнетворных микроорганизмов, широко используются для целей дезинфекции в медицине и ветеринарии, обеззараживания питьевой воды и очистки сточных вод, а также в производстве пищевых продуктов для обработки оборудования и снижения микробной контаминации используемого сырья.
Обработка хлорсодержащими биоцидами обеспечивает предупреждение перекрестного обсеменения продукции возбудителями пищевых инфекций и токсикоинфекций, позволяет продлить сроки годности продукции. Однако применение хлора связано с рядом негативных эффектов, одним из которых является образование тригалометанов, обладающих токсическим и канцерогенным действием: хлороформа, дихлорбромметана, дибромхлорметана и бромоформа [5, 7–9]. В целом соблюдение установленных для них максимально допустимых уровней позволяет избегать прямого риска для здоровья в виде токсических, аллергических и других реакций при употреблении пищевых продуктов и напитков с остатками таких веществ. Однако в настоящее время доказана потенциальная возможность появления как приобретенной пониженной чувствительности к биоцидам, так и устойчивости к лекарственным антимикробным средствам у микроорганизмов – контаминантов пищи и напитков [11]. С биоцидами сегодня связывают также такие негативные последствия, как ускорение эволюции бактериальных патогенов и появление новых инфекций, опасных для человека [1].
Распространение этих явлений свидетельствует о недооценке отдалённых рисков применения антимикробных средств в технологических целях. Безопасность традиционных концентраций биоцидов, используемых в пищевой индустрии, формирование толерантности к ним у различных видов контаминантов, изменение фенотипических признаков наиболее значимых групп микроорганизмов в настоящее время изучены недостаточно.
Для снижения риска негативных воздействий активного хлора важной задачей является обоснованный подбор эффективных концентраций рабочих растворов хлорсодержащих средств и оптимизация используемых режимов деконтаминации сырья и санитарной обработки оборудования на предприятиях пищевой промышленности.
В связи с изложенным проведены исследования по оценке чувствительности микроорганизмов – контаминантов биотехнологических пищевых производств к хлору и хлорсодержащим веществам на основе подбора оптимальных концентраций и технологических режимов хлорирования с целью подавления роста или уничтожения бактериальной микрофлоры семейства Enterobacteriaceae .
Для проведения исследований разработана экспериментальная хромогенная модель оценки in vitro степени ингибирования грамотрица-тельной микрофлоры под воздействием хлорсодержащих биоцидных средств, позволяющая количественно определять чувствительность энтеробактерий к антимикробной обработке в зависимости от концентраций хлора и плотности бактериальных популяций.
Материалы и методы. Оценку воздействия хлорсодержащих средств проводили, используя различные концентрации растворов активного хлора и суспензий тест-штаммов энтеробактерий. Эффективность антимикробного действия хлора оценивали по наличию или отсутствию роста штаммов в глюкозопептонной среде (ГПС) после внесения хлора и 18-часового культивирования проб при температуре 37 °С. В качестве контроля применяли те же разведения тест-культуры без добавления хлора, а также пробы неинокулиро-ванной среды ГПС.
Для обеспечения возможности варьирования двух факторов – концентрации хлора и плотности бактериальной суспензии – использовали 96-луночные стерильные иммунологические планшеты; общий объем пробы в каждой лунке составлял 200 мкл.
Предварительно во все лунки планшета вносили по 180 мкл стерильной среды ГПС, далее в первый вертикальный ряд лунок с использованием 8-канального дозатора вносили по 20 мкл суточной суспензии тест-штамма (109–1011 клеток/см3), получая первое десятикратное разведение; аналогичным образом культуру раститровывали до 11-го десятикратного разведения. Двенадцатый вертикальный ряд использовали в качестве отрицательного контроля. В горизонтальные ряды лунок вносили равные количества раствора активного хлора до получения расчетных концентраций в среде от 200 до 10 мг/дм3. В последний ряд планшета (Н) раствор хлора не вносили.
Для визуальной оценки роста тест-штам-мов в среду ГПС добавляли раствор индикатора бромтимолового синего (2 см3 1,6%-ного спиртового раствора индикатора на 1 дм3 среды), о наличии роста судили по помутнению среды и изменению ее цвета от сине-зеленого до желтого. Оптическую плотность сред измеряли с использованием автоматического планшетного фотометра «Sunrise» с длиной волны 450 нм.
Количественно чувствительность штаммов энтеробактерий к действию хлора оценивали, определяя степень ингибирования роста тест-штаммов в зависимости от дозы активного хлора и исходной плотности популяции, которую выражали как разницу в титрах (количество лунок с признаками роста) в контрольных и опытных рядах планшета:
Δi=TK – TN, где TK – титр культуры без добавления хлора, TN – титр культуры с соответствующей дозой хлора (N).
В качестве хлорсодержащего препарата использовали дезинфицирующее средство, содержащее натриевую соль дихлоризоциануро-вой кислоты. Рабочие растворы с различными концентрациями активного хлора готовили непосредственно перед экспериментом.
Для разработки модели применяли тест-штаммы Salmonella enteritidis 874 из коллекции ФГБНУ «Научно-исследовательский институт питания», S.typhimurium NCTC 00074 и Escherichia coli 1330 серотипа О157: Н7 из коллекции ГИСК им. Л.А.Тарасевича. Объектами исследований в хромогенных моделях in vitro являлись штаммы бактерий семейства Entero-bacteriaceae, выделенные из растительного сырья (картофеля, зерновых культур, солода) и смывов с поверхностей оборудования пивоваренного производства. Видовую принадлежность выделенных штаммов энтеробактерий устанавливали при использовании биохимических тест-систем «АРI 20Е», «Rapid 20E», «API 10S», («БиоМерье», Франция ). Кроме того, в качестве модельных тест-объектов были использованы штаммы E.coli , выделенные из кишечника лабораторных животных (крыс-самцов линии Вистар). Видовую принадлежность выделенных штаммов устанавливали при использовании биохимических тест-систем «АРI 20Е», «Rapid 20E», «API 10S» («БиоМерье», Франция). Всего в эксперименте было протестировано 87 культур энтеробактерий.
Результаты и их обсуждение. Схема двухфакторного модельного эксперимента с тестированием коллекционного штамма E.coli 1330 приведена в табл. 1. В данном случае in vitro было показано, что концентрации активного хлора 50 и 100 мг/дм3, наиболее часто используемые для обеззараживания питьевой воды и обработки растительного сырья, неэффективны для патогенных бактерий семейства Enterobacteriaceae , если плотность микробной популяции составляет (1–5)⋅107 клеток/см3 и выше. При этом сальмонеллы выживали и при исходной концентрации 105–106 клеток/см3 (рис. 1).
С использованием хромогенной модели была изучена чувствительность к хлору у тест-штаммов кишечных палочек, выделенных из нормальной микрофлоры кишечника лабораторных животных. Для исследований было отобрано 9 типичных штаммов E.coli , идентифицированных по комплексу культуральных и биохимических тестов с использованием наборов API 10S. Толерантность к воздействию хлора у культур E.coli , выделенных из микробиоты лабораторных животных (табл. 3), была сопоставима с чувствительностью коллекционного штамма E.coli серотипа О157: Н7, тогда как степень ингибирования сальмонелл в тех же условиях была значительно ниже (табл. 2).
Таблица 1
|
Дозы активного хлора, мг/дм 3 |
Оптическая плотность проб, 450 нм |
|||||||||||
|
1р |
2р |
3р |
4р |
5р |
6р |
7р |
8р |
9р |
10р |
11р |
ОК |
|
|
200 |
0,495 |
0,492 |
0,424 |
0,416 |
0,426 |
0,405 |
0,412 |
0,420 |
0,414 |
0,417 |
0,412 |
0,460 |
|
150 |
1,120 |
0,480 |
0,395 |
0,388 |
0,392 |
0,385 |
0,392 |
0,391 |
0,413 |
0,404 |
0,396 |
0,442 |
|
100 |
0,965 |
0,805 |
0,381 |
0,346 |
0,352 |
0,360 |
0,337 |
0,349 |
0,354 |
0,359 |
0,351 |
0,370 |
|
75 |
1,089 |
0,889 |
0,376 |
0,336 |
0,345 |
0,342 |
0,339 |
0,345 |
0,334 |
0,332 |
0,324 |
0,364 |
|
50 |
1,051 |
0,828 |
0,589 |
0,341 |
0,356 |
0,338 |
0,330 |
0,325 |
0,321 |
0,309 |
0,306 |
0,335 |
|
25 |
0,954 |
0,710 |
0,652 |
0,627 |
0,612 |
0,598 |
0,323 |
0,394 |
0,301 |
0,290 |
0,287 |
0,315 |
|
10 |
0,908 |
0,745 |
0,625 |
0,620 |
0,641 |
0,619 |
0,613 |
0,642 |
0,269 |
0,265 |
0,261 |
0,291 |
|
К |
1,034 |
0,753 |
0,663 |
0,659 |
0,675 |
0,639 |
0,645 |
0,488 |
0,465 |
0,288 |
0,272 |
0,284 |
Оценка воздействия хлора на культуру Escherichia coli 1330
П р и м е ч а н и е: цветом выделены лунки планшета / значения ОП, в которых регистрировали увеличение мутности и изменение цвета среды.

S. enteritidis

S. typhimurium
Рис. 1. Рост коллекционных тест-штаммов сальмонелл в экспериментальной хромогенной модели с использованием 96-луночного планшета
Таблица 2Степень ингибирования тест-штаммов E. coli при различных концентрациях активного хлора
|
Номер штамма |
Исходный титр культуры |
Концентрация активного хлора в среде, мг/дм 3 |
||||||
|
200 |
150 |
100 |
75 |
50 |
25 |
10 |
||
|
6к |
8 |
8 |
8 |
1 |
1 |
0 |
0 |
0 |
|
14к |
9 |
9 |
8 |
2 |
2 |
2 |
1 |
1 |
|
16к |
9 |
8 |
3 |
2 |
1 |
2 |
2 |
0 |
|
22к |
8 |
7 |
8 |
3 |
1 |
0 |
0 |
0 |
|
23к |
8 |
8 |
8 |
8 |
1 |
0 |
0 |
0 |
|
41к |
9 |
8 |
6 |
1 |
0 |
1 |
1 |
1 |
|
49к |
9 |
8 |
9 |
2 |
0 |
1 |
1 |
0 |
|
60к |
11 |
10 |
10 |
4 |
4 |
3 |
3 |
0 |
|
62к |
8 |
7 |
2 |
1 |
0 |
0 |
0 |
0 |
|
( М ) ± стд. ошибка среднего |
8,78 ± 0,32 |
8,11 ± 0,31 |
6,89 ± 0,90 |
2,67 ± 0,75 |
1,11 ± 0,42 |
1,00 ± 0,37 |
0,89 ± 0,35 |
0,22 ± 0,15 |
|
Медиана |
9,00 |
8,00 |
8,00 |
2,00 |
1,00 |
1,00 |
1,00 |
0,00 |
В данном эксперименте in vitro показано, что концентрации активного хлора 150–200 мг/дм3 обладают выраженным бактерицидным действием в отношении E. coli , приводя к практически полной инактивации живых клеток при их содержании до 108 КОЕ/см3. При дозировке активного хлора в растворе 75–100 мг/дм3 происходит снижение числа живых клеток на 1,1–2,7 порядка, а внесение хлора в дозах менее 50 мг/дм3 было малоэффективным при любой плотности бактериальных суспензий.
Микробиологические исследования растительного сырья и санитарных условий пищевых биотехнологических производств включали оценку количественных уровней бактериальной контаминации, анализ видового состава, изучение фенотипических свойств выделенных штаммов и чувствительность их к антимикробным воздействиям.
При исследовании 13 образцов солода, зерна и смывов с оборудования предприятий по производству напитков брожения было выделено 32 культуры грамотрицательных аэробных и факультативно анаэробных бактерий, подвергнутых идентификации по расширенному перечню культуральных и биохимических тестов. Из общего числа выделенных штаммов 27 культур были идентифицированы; 26 штаммов принадлежали к различным родам в составе семейства Enterobacteriaceae , 1 культура – Pseudomonadoceae . В пробах были обнаружены бактерии родов Enterobacter, Pantoea, Citrobacter, Serratia, Pseudomonas, Klebsiella, Escherichia . Из общего числа выделенных штаммов видовая принадлежность была установлена для 17 культур, которые относились к видам Enterobacter cloacae, E. amnigenus, E.aerogenes, Serratia fonti-cola, S. ficaria, Citrobacter freundii, Klebsiella pneumoniae, Escherichia coli, Pseudomonas aeruginosa . Анализ видового состава изолятов показал, что наибольшее число штаммов – 11 культур (42 %) – было представлено бактериями рода Pantoea . Микроорганизмы рода Pantoea обнаруживались в большинстве исследованных проб. Второй по частоте обнаружения группой микроорганизмов, выделенных из смывов и сырья, были бактерии рода Enterobacter (29,6 % всех штаммов). Сопоставление данных о частоте обнаружения колиформных лактозоположительных бактерий и других грамотрицательных микроорганизмов позволило выявить существенные различия в составе контаминантов сырья и смывов: колиформы значительно чаще обнаруживались в смывах, а энтеробактерии растительного происхождения – в солоде.
При изучении видового состава микрофлоры, контаминирующей крахмалсодержащее сырье для спиртового производства (пробы цельного и дробленого зерна пшеницы, ячменя, овса, клубни картофеля, полученные из нескольких регионов Российской Федерации, а также по импорту, всего 17 проб), было выделено 53 штамма грамотрицательных, ферментирующих глюкозу бактерий. По результатам идентификации принадлежность семейству Enterobacteriaceae подтверждена для 29 штаммов, в том числе были обнаружены условно-патогенные бактерии родов Enterobacter, Pantoea, Citrobacter, Serratia, Escherichia. В двух случаях выделены патогенные микроорганизмы рода Cronobacter. Наиболее часто обнаруживали представителей родов Enterobacter (38,0 %) и Pantoea (27,6 %). Колиформные лактозоположительные бактерии (БГКП) фиксировали как в зерне, так и в картофеле, а энтеробактерии растительного происхождения Pantoea spp. были выделены только из зернового сырья.
Перечень штаммов энтеробактерий, отобранных для тестирования в экспериментальной хромогенной модели in vitro, приведен в табл. 3.
Результаты сравнительной оценки чувствительности к хлору 26 штаммов бактерий, выделенных из растительного сырья и смывов с производственного оборудования, приведены в табл. 4.
Анализ полученных данных показал, что все исследованные штаммы энтеробактерий в той или иной степени были чувствительны к использованным в эксперименте концентрациям активного хлора. Дозы 200 и 150 мг/дм3 полностью подавляли рост 7 из 26 исследованных штаммов (26,9 %). При концентрации активного хлора 75–100 мг/дм3 наблюдали значительное ингибирование роста штаммов с 108–9 клеток/cм3 до 105–6 клеток/cм3, то есть на 3,5–4,7 логарифмических порядка. При меньших концентрациях хлора ингибирования практически не происходило – плотность популяций снижалась лишь в 5–10 раз (менее 1,0 lg кле-ток/cм3).
Сравнение чувствительности к хлору бактерий семейства Enterobacteriaceae, выделенных из смывов и растительного сырья, и штаммов E. coli из кишечника крыс показало, что при концентрациях хлора 75–100 мг/дм3 бактерии, выделенные из растительного сырья, были менее чувствительны к антимикробному действию хлорсодержащих средств (рис. 2).
Таблица 3Видовая принадлежность исследованных штаммов энтеробактерий
|
Номер штамма |
Видовая принадлежность |
Источник выделения |
|
Лактозоположительные энтеробактерии (БГКП) |
||
|
5/6 |
Escherichia coli |
Солод ржаной неферментированный |
|
1 |
Citrobacter freundii |
Пшеница |
|
6/4 |
Citrobacter freundii |
Смыв (разливочный аппарат) |
|
24 |
Citrobacter freundii |
Пшеница |
|
50 |
Citrobacter braakii |
Картофель |
|
1/3 |
Klebsiella pneumonia |
Солод ячменный |
|
14 |
Enterobacter spp |
Пшеница |
|
7/4 |
Enterobacter cloacae |
Смыв с дозатора (укупорка) |
|
7/6 |
Enterobacter cloacae |
Смыв с дозатора (укупорка) |
|
16 |
Enterobacter cloacae |
Овес |
|
22 |
Enterobacter cloacae |
Пшеница |
|
41 |
Enterobacter cloacae |
Картофель |
|
48 |
Enterobacter cloacae |
Картофель |
|
52 |
Enterobacter cloacae |
картофель |
|
47 |
Cronobacter spp (E. sakazakii) |
Картофель |
|
51 |
Cronobacter spp (E. sakazakii) |
Картофель |
|
Лактозонегативные энтеробактерии |
||
|
2/1 |
Pantoea spp. |
Рожь |
|
2/3 |
Pantoea spp. |
Рожь |
|
3/1 |
Pantoea spp. |
Солод пшеничный |
|
20 |
Pantoea spp. |
Ячмень |
|
30 |
Pantoea spp. |
Пшеница |
|
33 |
Pantoea spp. |
Пшеница |
|
38 |
Serratia ficaria |
Картофель |
|
45 |
Serratia marcescens |
Картофель |
|
35 |
Leclercia adecarboxylata |
Пшеница |
|
Другие виды лактозонегативных бактерий |
||
|
6/6 |
Pseudomonas aeruginosa |
Смыв (разливочный аппарат) |
Таблица 4
Степень ингибирования штаммов, выделенных из растительного сырья и смывов (Δi)
|
Номер штамма |
Исходный титр культуры |
Концентрация активного хлора в среде, мг/дм 3 |
||||||
|
200 |
150 |
100 |
75 |
50 |
25 |
10 |
||
|
Лактозоположительные энтеробактерии (БГКП) |
||||||||
|
5/6 |
9 |
9 |
9 |
6 |
2 |
2 |
0 |
0 |
|
1 |
9 |
9 |
9 |
8 |
8 |
3 |
2 |
1 |
|
6/4 |
9 |
8 |
8 |
6 |
1 |
1 |
0 |
0 |
|
24 |
9 |
9 |
9 |
8 |
9 |
1 |
2 |
0 |
|
50 |
8 |
7 |
7 |
2 |
1 |
1 |
0 |
0 |
|
1/3 |
8 |
7 |
7 |
6 |
6 |
0 |
0 |
0 |
|
14 |
9 |
9 |
8 |
7 |
7 |
1 |
0 |
0 |
|
7/4 |
9 |
8 |
7 |
5 |
3 |
1 |
1 |
0 |
|
7/6 |
9 |
7 |
7 |
6 |
5 |
1 |
0 |
0 |
|
16 |
11 |
10 |
11 |
9 |
10 |
3 |
2 |
2 |
|
22 |
10 |
10 |
10 |
8 |
7 |
3 |
0 |
2 |
|
41 |
9 |
8 |
6 |
0 |
0 |
0 |
1 |
0 |
|
48 |
9 |
7 |
0 |
1 |
1 |
1 |
0 |
1 |
|
52 |
10 |
9 |
8 |
2 |
2 |
0 |
2 |
2 |
|
47 |
8 |
6 |
6 |
1 |
1 |
0 |
1 |
0 |
|
51 |
8 |
7 |
7 |
1 |
1 |
0 |
0 |
0 |
|
2/1 |
9 |
7 |
7 |
6 |
5 |
1 |
0 |
0 |
|
( М ) ± стд. ошибка среднего |
9,00 ± 0,19 |
8,06 ± 0,29 |
7,41 ± 0,57 |
4,82 ± 0,72 |
4,06 ± 0,79 |
1,12 ± 0,26 |
0,65 ± 0,21 |
0,47 ± 0,19 |
|
Медиана |
9,0 |
8,0 |
7,0 |
6,0 |
3,0 |
1,0 |
0,0 |
0,0 |
|
Лактозонегативные энтеробактерии и Pseudomonas spp. |
||||||||
|
2/3 |
9 |
8 |
8 |
7 |
7 |
3 |
1 |
1 |
|
3/1 |
8 |
7 |
7 |
5 |
3 |
2 |
0 |
0 |
Окончание табл. 4
|
Номер штамма |
Исходный титр культуры |
Концентрация активного хлора в среде, мг/дм 3 |
||||||
|
200 |
150 |
100 |
75 |
50 |
25 |
10 |
||
|
20 |
9 |
9 |
9 |
9 |
6 |
2 |
1 |
0 |
|
30 |
8 |
8 |
8 |
2 |
2 |
1 |
1 |
1 |
|
33 |
8 |
7 |
8 |
1 |
1 |
1 |
0 |
0 |
|
38 |
8 |
7 |
3 |
0 |
0 |
0 |
0 |
0 |
|
45 |
8 |
7 |
6 |
0 |
0 |
0 |
0 |
0 |
|
35 |
7 |
7 |
4 |
2 |
1 |
1 |
1 |
0 |
|
6/6 |
8 |
3 |
2 |
0 |
0 |
0 |
0 |
0 |
|
( М ) ± стд. ошибка среднего |
8,11±0,20 |
7,00 ± 0,55 |
6,11 ± 0,84 |
2,89 ± 1,11 |
2,22 ± 0,88 |
1,11 ± 0,35 |
0,44 ± 0,18 |
0,22 ± 0,15 |
|
Медиана |
8,0 |
7,0 |
7,0 |
2,0 |
1,0 |
1,0 |
0,0 |
0,0 |
|
( М ) *± стд. ошибка среднего |
8,69±0,22 |
7,80± 0,22 |
6,94 ± 0,42 |
3,77 ± 0,51 |
2,83 ± 0,50 |
1,09 ± 0,18 |
0,66 ± 0,14 |
0,34 ± 0,11 |
|
Медиана |
9,0 |
8,00 |
8,00 |
2,00 |
1,00 |
1,00 |
0,00 |
0,00 |
П р и м е ч а н и е: * – средние значения для всех протестированных штаммов.


Исходный 200 титр культуры (контроль)
150 100 75 50 25 10
Концентрация активного хлора в среде, мг/л
Рис. 2. Степень толерантности к хлору у E.coli и энтеробактерий, выделенных из смывов и растительного сырья
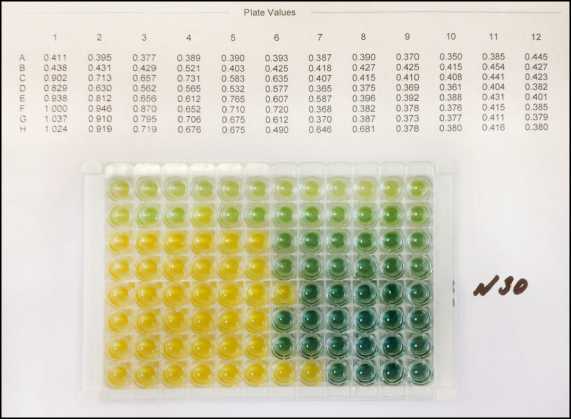
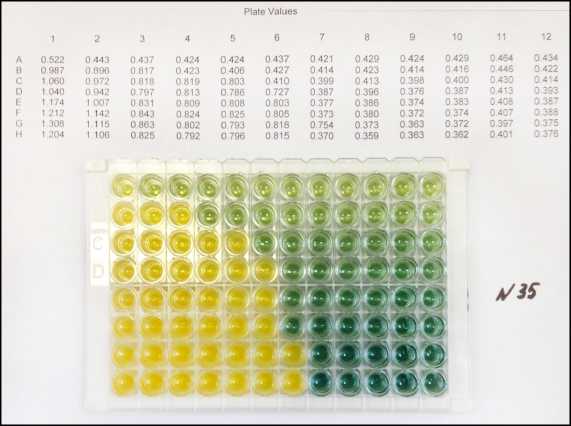
Наиболее выраженной толерантностью к хлору обладали энтеробактерии рода Pantoea , которые обычно персистируют в биотопах растительных и почвенных экосистем, являясь одним из самых распространенных представителей семейства Enterobacteriaceae [2]. Так, выделенные из зерна пшеницы штаммы Pantoea spp. № 30 и № 35 были устойчивы к воздействию 100–150 мг/дм3 активного хлора, степень ингибирования при этих условиях была на 3 логарифмических порядка ниже по сравнению с другими выделенными штаммами (см. табл. 4, рис. 3).
Чувствительность к хлору колиформных бактерий (БГКП) из растительного сырья в сравнении с другими представителями семейства Enterobacteriaceae в некоторых случаях была более выражена, однако достоверной разницы при небольшом объеме выборки выявить не удалось.
Существующая практика обеззараживания питьевой воды предполагает подбор дозировок активного хлора таким образом, чтобы по мик-
б
Рис. 3. Рост Pantoea spp. в хромогенной модели при различных концентрациях активного хлора: а – штамм № 30; б – штамм № 35
робиологическим показателям она соответствовала требованиям СанПиН 2.1.4.1074-01 [3], а содержание остаточного хлора при этом не
превышало 0,3–0,5 мг/дм3. Наиболее часто для этих целей используются концентрации активного хлора от 50 до 100 мг/дм3 при различной продолжительности обработки (экспозиции).
В осуществленном эксперименте при концентрации активного хлора 100 мг/дм3 в модельной среде достигалось снижение плотности бактериальных популяций в среднем на 5 логарифмических порядков, а при 75 мг/дм3 – на 3–4 порядка. Исключение составили данные относительно штамма Ps. aeruginosa 6/6, выделенного из смыва с оборудования: ингибирование культуры достигалось только при содержании активного хлора 150–200 мг/ дм3, штамм был практически нечувствителен к более низким концентрациям.
Выводы:
-
1. Изучен видовой состав микробных кон-таминантов растительного сырья и оборудования, используемого в производстве биотехнологических продуктов и напитков брожения; выделено и изучено по комплексу культурально-биохимических показателей 85 культур энтеробактерий, из них идентифицировано до вида 46 штаммов родов Enterobacter, Pantoea, Citrobacter, Serratia, Escherichia, Cronobacter ; наиболее часто обнаруживали представителей родов Enterobacter и Pantoea (около 50 %).
-
2. Впервые разработана и апробирована в экспериментальных условиях хромогенная модель in vitro на основе индикаторной тест-системы, позволяющая проводить количественную оценку степени ингибирования грамот-рицательной микрофлоры под воздействием антимикробных средств в зависимости от концентраций биоцидов и плотности бактериальных популяций.
-
3. С использованием разработанной модели сделан сравнительный анализ толерантности штаммов энтеробактерий, выделенных из различных биотопов; проведено тестирование чувствительности к обработке хлорсодержащими биоцидными средствами 26 штаммов – конта-минантов растительного сырья и 9 штаммов E. coli , выделенных из кишечника лабораторных животных. Энтеробактерии из растительного сырья и смывов были более устойчивы к антимикробному действию хлора, нежели представители популяций нормальной кишечной микробиоты.
-
4. Показано, что концентрации активного хлора 50–100 мг/дм3, наиболее часто используемые при обработке растительного сырья, неэффективны для бактерий семейства Entero-bacteriaceae , если плотность микробной популяции составляет 105–7 клеток/см3 и выше. При исходном уровне контаминации энтеробактериями не более 103 клеток/см3 обработка растворами с концентрацией активного хлора 75–100 мг/дм3 может обеспечить эффективное обеззараживание сырья, оборудования или инвентаря.
-
5. Экспериментальная хромогенная модель in vitro , предложенная для оценки воздействия хлорсодержащих средств на степень ингибирования энтеробактерий, может быть использована для обоснования и подбора концентраций рабочих растворов антимикробных средств, эффективных в отношении других групп микробных контаминантов, что позволит оптимизировать применение режимов дезинфекции сырья и санитарной обработки оборудования на предприятиях пищевой промышленности.
Список литературы Изучение толерантности энтеробактерий к хлорсодержащим биоцидным средствам в экспериментальных моделях с использованием хромогенных индикаторных тест-систем
- Ефимочкина Н.Р. Микробиология пищевых продуктов и современные методы детекции патогенов. -М.: Изд-во РАМН, 2013. -517 с.
- Изучение особенностей микробной контаминации свежих овощей и листовых салатов промышленного изготовления/Н.Р. Ефимочкина, И.Б. Быкова, С.Ю. Батищева, Л.П. Минаева, Ю.М. Маркова, Ю.В. Короткевич, Г.Ю. Шилов, С.А. Шевелева//Вопросы питания. -2014. -№ 5. -С. 33-42.
- СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения. Санитарно-эпидемиологические правила и нормативы. -М.: Роспотребнадзор, 2001. -112 с.
- Application of Acidified Sodium Chlorite in the Drinking Water to Control Salmonella serotype Typhimurium and Campylobacter jejuni in Commercial Broilers/P. Mohyla, S.F. Bilgili, O.A. Oyarzabal //J. Appl. Poult Res. -2007. -Vol. 16, № 1. -P. 45-51 DOI: 10.1093/japr/16.1.45
- Biodisposition of dibromoacetic acid (DBA) and bromodichloromethane (BDCM) administered to rats and rabbits in drinking water during range-finding reproduction and developmental toxicity studies/M.S. Christian, R.G. York, A.M. Hoberman //International Journal of Toxicology. -2001. -Vol. 20. -P. 239-253.
- Hicks S.J., Rowbury R.J. Resistance of attached Escherichia coli to acrylic acid and its significance for the survival of plasmid-bearing organisms in water//Ann. Inst. Pasteur. -1987. -Vol. 138. -P. 359-369.
- International Life Sciences Institute. An Evaluation of EPA’s Proposed Guidelines for Carcinogen Risk Assessment Using Chloroform and Dichloroacetate as Case Studies. Report of an Expert Panel, ILSI HESI, Washington, DC, November, 1997. -240 с.
- Oral (drinking water) developmental toxicity studies of bromodichloromethane (BDCM) in rats and rabbits/M.S. Christian, R.G. York, A.M. Hoberman //International Journal of Toxicology. -2001. -Vol. 20. -P. 225-237.
- Oral (drinking water) two-generation reproductive toxicity study of bromodichloromethane (BDCM) in rats/M.S. Christian, R.G. York, A.M. Hoberman //International Journal of Toxicology. -2002. -Vol. 21. -P. 115-146.
- Oyarzabal O.A. Reduction of Campylobacter spp. by commercial antimicrobials applied during the processing of broiler chickens: a review from the United States perspective//J. Food Prot. -2005. -Vol. 68. -P. 1752-1760.
- Scientific Opinion of the Panel on Biological Hazards on a request from DG SANCO on the assessment of the possible effect of the four antimicrobial treatment substances on the emergence of antimicrobial resistance//The EFSA Journal. -2008. -Vol. 659. -P. 1-26.
- Whiting G.C., Rowbury R.J. Increased resistance of Escherichia coli to acrylic acid and to copper ions after cold-shock//Letts. Appl. Microbiol. -1995. -Vol. 20. -P. 240-242.
- Yang H., Li Y. Johnson M.G. Survival and death of Salmonella typhimurium and Campylobacter jejuni in processing water and on chicken skin during poultry scalding and chilling//J. Food Prot. -2001. -Vol. 64. -P. 770-776.


