Изучение условий эффективного введения трансгенов в эмбриональные клетки кур с использованием лентивирусной векторной системы
Автор: Волкова Н.А., Фомин И.К., Томгорова Е.К., Ветох А.Н., Меннибаева Э.Р., Брем Г., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Трансгенез у сельскохозяйственной птицы
Статья в выпуске: 4 т.50, 2015 года.
Бесплатный доступ
Перенос генов, опосредованный ретровирусными и лентивирусными векторами, рассматривается в качестве одного из перспективных способов генетической модификации сельскохозяйственной птицы (S.C. Chapman et al., 2005; C.A. Smith et al., 2009; Н.А. Волкова с соавт., 2013). Однако эффективность трансгенеза эмбриональных клеток кур рекомбинантными ретровирусами и лентивирусами лимитируется рядом факторов. Одной из проблем при получении трансгенной птицы остается наличие большого числа эмбриональных клеток (порядка 60000-100000) на начальном этапе инкубации и необходимость применять высококонцентрированные вирусные препараты (около 10 9 вирусных частиц/мл) для достижения относительно приемлемой эффективности введения трансгенов. Целью настоящей работы стало получение вектора на основе модифицированной лентивирусной системы второго поколения и определение оптимальных условий использования лентивирусных векторов для трансгенеза эмбрионов кур. В состав векторной системы входили три различные плазмиды: psPAX2, содержащая гены gag-pol ; pLPG, кодирующая поверхностный гликопротеин G вируса везикулярного стоматита (VVS-G), и pWPXL - самоинактивирующийся лентивирусный вектор, несущий ген eGFP (enhanced green fluorescence protein) под контролем промотора гена фактора элонгации 1 РНК-полимеразы II человека ( hEF1a ). Для получения рекомбинантного вируса и определения титров использовали линию клеток человека 293T. Введение вирусного препарата в куриные эмбрионы проводили в разные сроки после начала инкубации: через 20-24 ч (I группа) и через 50-55 ч (II группа). Эффективность трансформации и число интегрированных копий трансгена оценивали методом real-time PCR (RT-PCR) анализа ДНК, выделенной из эмбрионов на 7-е сут инкубации, на наличие eGFP. Максимальные титры вирусных препаратов были получены при количественном соотношении плазмид psPAX2, pLPG и pWCAG 1:1:3 и составили 2,4x10 7 КОЕ/мл до ультрацентрифугирования и 6,2x10 8 КОЕ/мл - после концентрирования ультрацентрифугированием. Представленные данные показывают, что изменение соотношения между компонентами векторной системы по сравнению со стандартной схемой позволяет значительно увеличить титр получаемого вирусного препарата. Биологические титры вирусных препаратов порядка 10 8 КОЕ/мл достаточны для инфицирования до 78 % клеток на ранних этапах развития эмбриона. Эффективность генетической трансформации, оцененная по доле трансформированных клеток, в I и II группах эмбрионов составила соответственно 78,0 и 31,0 %. Предположительно на более ранних стадиях клетки эмбриона инфицировались большим количеством вирусных частиц, чем и объясняется разница в числе копий вектора в составе клеточного генома в I и II группах. Исходя из полученных результатов, средняя эффективность переноса генов с помощью лентивирусных векторов находилась в пределах 30,0-34,3 % и слабо варьировала при изменении времени введения после начала инкубации эмбрионов. Этот факт указывает на то, что только часть клеток эмбриона обычно доступна для инфицирования вирусом. Инфицирование эмбрионов в разные сроки при использовании вирусных препаратов с одинаковыми титрами позволяет получать популяции эмбриональных клеток с неодинаковым числом копий вектора в составе клеточного генома. Таким образом, эффективность переноса генов в эмбрионы кур с использованием лентивирусных векторов не зависит от стадии развития эмбриона в течение по крайней мере первых 55 ч инкубации и может быть прогнозируемой.
Лентивирусные векторы, молекулярное клонирование, трансфекция, трансгенные животные
Короткий адрес: https://sciup.org/142133607
IDR: 142133607 | УДК: 636.52/.58:573.6.086.83:636.082 | DOI: 10.15389/agrobiology.2015.4.458rus
Текст научной статьи Изучение условий эффективного введения трансгенов в эмбриональные клетки кур с использованием лентивирусной векторной системы
К настоящему времени перспективность использования ретровирусных и лентивирусных векторных систем для генетической модифика-
∗ Работа выполнена при финансовой поддержке государства в лице ФАНО, номер госрегистрации НИР 01201455101. В проведении исследований было использовано оборудование ЦКП «Биоресурсы и биоинженерия сельскохозяйственных животных» ВИЖ им. Л.К. Эрнста.
ции сельскохозяйственной птицы показана в ряде работ (1-6). При этом одной из проблем при получении трансгенной птицы остается наличие большого числа эмбриональных клеток (порядка 60000-100000) на начальном этапе инкубации и необходимость применения высококонцентрированных вирусных препаратов (около 109 вирусных частиц/мл) для достижения относительно приемлемой эффективности введения трансгенов. Использование конститутивных промоторов-энхансеров, таких как промотор-энхансер ранних генов цитомегаловируса человека (CMV), промотор-энхансер гена β -актина птиц, позволяет добиваться значительной экспрессии (до нескольких миллиграммов белка на 1 мл в сыворотке крови и белке яйца) у мозаичных форм (G 0 ), полученных из эмбрионов после введения трансгенов. Однако уже в следующих поколениях (G 1 и G 2 ) экспрессия значительно снижается (5). Причины этого пока не понятны. Возможно, высокая степень экспрессии чужеродного белка в различных органах и тканях действует как селективный фактор. Кроме того, было замечено, что уровень экспрессии прямо коррелирует с дозой гена (числом копий вируса в расчете на клеточный геном), то есть вероятность различных физиологических дефектов у наиболее перспективных продуцентов значительно возрастает (2, 7-9). Предпринимались также попытки добиться тканеспецифического выражения трансгенов с помощью регуляторных элементов, контролирующих синтез яичного овальбумина (10-14). Как указывают авторы, экспрессия трансгенов у нескольких поколений животных была относительно стабильной, тем не менее, достигнутые уровни синтеза белка оказались примерно в 20-50 раз ниже, чем при использовании конститутивных промоторов.
Векторные системы, полученные на основе интегративных вирусов, таких как ленти- и ретровирусы, представляют собой эффективный инструмент для введения и выражения генов вследствие ряда уникальных характеристик: представители этого семейства способны стабильно интегрировать в геном клетки-хозяина; относительно небольшие размеры генома позволяют легко манипулировать с ним in vitro; внутренние последовательности генома могут быть удалены таким образом, что все функции, необходимые для репликации, будут предоставлены in trans; используя поверхностные гликопротеины вируса, тропные к широкому спектру хозяев, можно инфицировать гибридными вирионами практически любой вид и тип клеток позвоночных.
В предпринятом нами исследовании особенностей введения и выражения генов в клетках сельскохозяйственной птицы первым этапом стала оптимизация стандартного протокола получения векторов на основе ленти-вирусной системы, что позволило значительно увеличить титр используемого вирусного препарата. Также наши данные по изучению условий инфицирования куриных эмбрионов лентивирусными препаратами дают основания предположить, что его результат можно прогнозировать.
Цель представляемой работы заключалась в оценке влияния количества и соотношения между компонентами лентивирусной векторной системы на физический и биологический титр продуцируемого вируса, а также времени введения полученного лентивирусного вектора в эмбрионы кур на результативность трансгенеза in vivo.
Методика. Объектом исследований служили эмбрионы кур кросса Птичное. В работе использовалась модифицированная лентивирусная векторная система второго поколения, в состав которой входили три различные плазмиды: psPAX2, содержащая гены gag-pol ; pLPG, кодирующая поверхностный гликопротеин G вируса везикулярного стоматита (VVS-G);
pWPXL — самоинактивирующийся лентивирусный вектор, несущий ген eGFP (enhanced green fluorescence protein) под контролем промотора гена фактора элонгации 1 РНК-полимеразы II человека (hEFla) (15). Плазмида pWPXL была использована для конструирования вектора pWCAG. Вирусный вектор конструировали с помощью стандартных методов молекулярного клонирования (16).
Для получения рекомбинантного вируса, а также определения вирусных титров использовали линию клеток человека 293T. Клетки этой линии обладают способностью к быстрому делению, а также могут с высокой эффективностью трансфицироваться плазмидной ДНК. Клетки культивировали в среде DMEM (Dlbecco’s Modified Eagle’s Medium), содержащей эмбриональную телячью сыворотку (10 %), L-глутамин (2 мМ), пенициллин (100 ЕД/мл), стрептомицин (100 мкг/мл) в атмосфере 5 % СО 2 при температуре 37 °С. Лентивирусный вектор вводили в клеточную линию 293T посредством кальций-фосфатной преципитации (16). При этом 1,7½106 клеток помещали во флакон с площадью субстрата 25 см2 за 1 сут до постановки эксперимента. На 2-е сут среду культивирования заменяли 1 мл свежей среды, содержащей ДНК всех трех плазмид векторной системы в различных соотношениях, и инкубировали в течение 6 ч в присутствии кальций-фосфатного буфера. Затем клетки подвергали химическому шоку, обрабатывая 20 % DMSO (диметилсульфоксид) в течение 5 мин, далее отмывали и помещали в свежую среду. На следующий день культуральную среду заменяли на свежую и продолжали инкубировать в течение 48 ч, после чего культуральный супернатант, содержащий вирус, собирали, очищали центрифугированием и аликвоты замораживали при -80 °С. Для концентрирования вирусных препаратов культуральные супернатанты подвергали ультрацентрифугированию (70000 g, 120 мин, +4 °С) и осадки ресуспендировали при +4 °С в небольшом объеме буфера TNE (Трис-HCl — 50 мM, pH 7,8; NaCl — 130 мМ; Na 2 -EDTA — 1 мМ).
Для определения физического титра вирусных векторов из аликвот (5-50 мкл) культуральных супернатантов, содержащих вирус, была выделена вирусная РНК с использованием набора фирмы «Qiagen» (США). Вирусная РНК служила матрицей для синтеза кДНК с обратным праймером, специфичным к последовательностям гена eGFP . Далее определяли количество вектора в real-time PCR (RT-PCR), используя синтезированную кДНК и праймеры, специфичные к гену eGFP . Стандартом для оценки числа копий гена служила серия 2-кратных разведений плазмидной ДНК вирусного вектора в нужном диапазоне. RT-PCR проводили на приборе MiniOpticonTM («Bio-Rad», США). Биологический титр вируса определяли согласно описанию G. Tiscornia с соавт. (17). Супернатант, собранный при культивировании клонов клеток 293T, трансфицированных ретровирусными векторами, центрифугировали для удаления клеток и дебриса (10 мин, 3000 g). Инфицирование осуществляли немедленно после сбора вируса. Реципиентные клетки 293T высевали с плотностью 3½105 на чашки Петри диаметром 60 мм за 1 сут до инфицирования. На 2-е сут среду заменяли на 1 мл свежей среды, содержащей полибрен (8 мкг/мл) и аликвоты тестируемого вируса. Инкубировали в течение 6 ч, после чего среду заменяли на свежую. Через 48-72 ч инкубации клетки снимали с субстрата трипсином, ресуспендировали в PBS и измеряли интенсивность флуоресценции еGFP на проточном цитофлуориметре FACSCanto («BD», США) с набором фильтров 480-490 нм (возбуждение) и 510 нм (эмиссия).
Хромосомную ДНК из эмбрионов кур выделяли солевым методом (16). Концентрацию ДНК измеряли спектрофотометрически (прибор Hi-460
tachi U-1100, Япония) при X = 260 нм (ОЕ 260 = 1 соответствует 50 мкг двухнитевой ДНК). Чистоту препаратов ДНК оценивали, рассчитывая соотношение оптической плотностей при длине волны 260 и 280 нм. Нормализацию образцов ДНК проводили с использованием RT-PCR с праймерами и гибридизационной пробой, специфичными к ДНК, кодирующей 18S-рРНК у Gallus gallus . Число копий ДНК векторов определяли с праймерами и гибридизационными пробами, специфичными к eGFP . Для приготовления стандартов использовали плазмидную ДНК вирусного вектора, переведенную в линейную форму по уникальному сайту рестрикции и рас-титрованную в определенном ранее диапазоне. PCR-продукты получали в реакционной смеси объемом 25 мкл, содержащей 1½ буфер (Tрис-HCl — 10 мМ, pH 8,8, KCl — 50 мМ, Nonidet P400 — 0,08 %), MgCl 2 (2 мМ), dNTPs (0,2 мМ), праймеры (для каждого 0,25 мкМ), гибридизационную пробу (0,125 мкМ), Taq-полимеразу (1,25 U, «Fermentas», Литва) и 5 нг матрицы. Условия амплификации: 95 °С, 5 мин; 45 циклов — 94 °С, 30 с; 50 °С (варьирует), 30 с; 72 °С, 1 мин. Количественную RT-PCR и экспериментальный подбор оптимальных температур отжига олигонуклеотидов также проводили на приборе MiniOpticonTM («Bio-Rad», США).
Анализ экспрессии eGFP в тканях эмбрионов выполняли на проточном цитофлуориметре (FACSCanto, «BD», США).
Результаты. Для определения условий эффективного введения трансгенов в эмбриональные клетки кур мы использовали лентивирусную векторную систему. В частности, была выбрана модифицированная система второго поколения, в состав которой, как уже отмечалось, входили три различные плазмиды: одна кодировала поверхностный гликопротеин G вируса везикулярного стоматита (VVS-G), вторая представляла собой классический «упаковщик» и содержала гены gag и pol , третья была самоинактиви-рующимся лентивирусным вектором (SN, self-inactivated) (15).
Для изучения эффективности введения конструкции и экспрессии генов в клетках птицы использовали ген eGFP в качестве структурного и гибридный энхансер-промотор CAG, содержащий энхансер ранних генов цитомегаловируса человека (hCMV, human cytomegalovirus) и промотор р-актина птицы (chiken β -actin promoter). Используя эти последовательности, на основе самоинактивирующегося лентивирусного вектора получили конструкцию с геном eGFP под контролем промотора CAG.
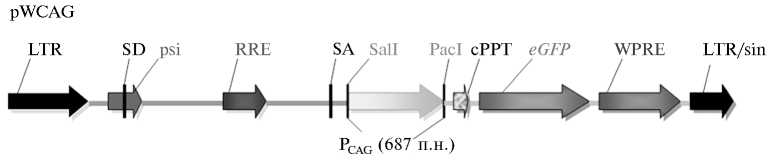
Структура лентивирусного экспрессирующего вектора pWCAG . Описание конструирования вирусного вектора приведено в тексте. LTR, LTR/sin (LTR, long terminal repeat; sin, selfinactivating), длинные концевые повторы лентивирусов: 5 ' -LTR — дикого типа, 3 ' -LTR/sin — самоинактивирующийся вариант. SD, SA (splice donor, splice acceptor) — донорный и акцепторный сайты сплайсинга; psi — область, ответственная за упаковку вирусной геномной РНК в вирион; RRE (rev responsible element) — сайт связывания Rev-белка, осуществляющего транспорт геномной молекулы РНК из ядра в цитоплазму; cPPT (central polypurine tract) — центральный полипуриновый тракт, принимающий участие в транспорте прединтегративного комплекса в ядро клетки; eGFP (enhanced green fluorescence protein) — ген зеленого флуоресцирующего белка; WPRE (woodchuck post-transcriptional regulatory element) — посттранскрипционный регуляторный элемент вируса гепатита древесного сурка. P CAG — гибридный регуляторный элемент, содержащий энхансер ранних генов цитомегаловируса человека и промотор гена р -астина птицы. Sall, PacI — сайты рестрикции, которые были использованы для клонирования регуляторных элементов.
Структура лентивирусного вектора показана на рисунке. Для получения вектора pWCAG фрагмент размером 687 п.н., содержащий гибридный энхансер-промотор CAG в составе плазмиды psPAX2 (13), был ам-плифицирован, очищен из геля и клонирован по SalI-PacI сайтам рестрикции в составе плазмиды pWPXL (15).
Соотношение между компонентами при трансфекции оптимизировали экспериментально.
Как уже отмечалось, при получении вирусного препарата плазмиды psPAX2, pLPG и pWCAG, образующие трехкомпонентную векторную систему, вводили в клетки человека (линия 293T) посредством CaPO 4 -преципитации. Используя плазмиды в разной пропорции, а также изменяя их общее количество (при сохранении пропорции) и состав компонентов среды, подобрали условия, обеспечивающие выход вирусных частиц в высоком титре.
В таблице 1 приведены данные, иллюстрирующие влияние различного соотношения между компонентами векторной системы на физический и биологический титр вируса. Как видно, 2-кратное уменьшение либо увеличение количества всех трех плазмид по отношению к исходному варианту не оказывало значительного воздействия на титр вируса (изменения не более чем в 2 раза). В то же время увеличение количества упаковщика (pLPG) и вектора (pWCAG) по сравнению со стандартным вариантом (1:2:3, psPAX2: pLPG:pWCAG) приводило более чем к 10-кратному падению титра. Интересно отметить, что 2-кратное уменьшение количества упаковщика позволило повысить титр более чем в 4 раза по отношению к стандарту. Этот вариант был использован нами в дальнейших экспериментах для получения вирусных препаратов.
1. Титр вирусного препарата, применяемого для трансформации клеток птицы in vivo, в зависимости от количественного соотношения между компонентами векторной системы, которая использовалась для его получения
Титр вируса I 1:2:331 (1:2:3)/2 □ 1:4:3 1:4:6 □ 2:2:3 1:1:3
Физический, число копий РНК/мл 5,6½109 2,9½109 6,9½108 5,1½108 5,2½109 1,9½1010
Биологический, КОЕ/мл 6,7½106 3,4½106 8,3½105 5,8½105 6,3½106 2,4½107
П р и м еч а ни е. Приведены количественные соотношения плазмид (соответственно psPAX2, pLPG и pWCAG).
В результате для вектора с CAG-промотором мы получили титры 2,4½107 КОЕ/мл. Биологический титр вируса был определен на клетках 293T по флуоресценции eGFP. Количество вируса в препарате оценивали по содержанию специфической РНК в RT-PCR («Bio-Rad», США). После концентрирования препарата ультрацентрифугированием титр для вектора составил 6,2½108 КОЕ/мл.
Полученный вирусный препарат использовали для введения в эмбриональные клетки в разные сроки: в I группе куриные эмбрионы инфицировали на 20-24-й ч инкубации, во II — на 50-55-й ч (табл. 2). На 7-е сут инкубации яйца вскрыли, и у развившихся эмбрионов были взяты фрагменты ткани в качестве образцов для выделения хромосомной ДНК и анализа экспрессии eGFP. Образцы ДНК со значением OE 260/280 не менее 2 служили эталонными для нормализации остальных образцов. Все расчеты производили, исходя из того, что молекулярная масса диплоидного генома Gallus gallus составляет 2,5 пг.
По данным RT-PCR, в I группе средняя эффективность введения лентивирусного вектора в эмбриональные клетки кур составила 0,78 копии на диплоидный клеточный геном, то есть 78,0 % эмбриональных 462
клеток содержали интегрированную копию ДНК вектора. Во II группе показатель был в 2,5 раза ниже — 31,0 %. При этом в I группе эмбрионов на клеточный геном приходилось от 0,10 до 5,52 копии, причем у четырех из 10 образцов этот показатель составлял не менее одной копии провируса в расчете на диплоидный геном, тогда как для II группы диапазон значений был намного меньше — от 0,00 до 0,70 копии ДНК провируса. Изучение экспрессии маркерного гена eGFP в тканях эмбрионов при помощи проточного цитофлуориметра выявило ее в среднем в 34,3 % клеток эмбрионов в I группе и в 30,0 % эмбриональных клеток во II группе. Таким образом, во II группе показатели эффективности введения векторов, полученные с использованием RT-PCR и проточной цитофлуорометрии, практически совпадали (соответственно 31,0 и 30,0 %), тогда как в I группе они различались в 2,3 раза (соответственно 78,0 и 34,3 %; см. табл. 2).
2. Оценка эффективности введения лентивирусного вектора pWCAG in vivo в эмбриональные клетки кур кросса Птичное в зависимости от возраста эмбрионов
|
Группа (время после начала инкубации, ч) |
Номер образца |
Число копий вектора в расчете на диплоидный клеточный геном |
Доля клеток эмбриона, экспрессирующих eGFP, % |
|
I группа (20-24) |
1-1 |
0,96 |
|
|
1-2 |
1,86 |
||
|
1-3 |
0,33 |
||
|
1-4 |
0,10 |
||
|
1-5 |
0,36 |
||
|
1-6 |
0,14 |
||
|
1-7 |
5,52* |
||
|
1-8 |
0,68 |
||
|
1-9 |
0,44 |
||
|
1-10 |
2,20 |
||
|
средняя эффективность |
0,78 (78 %) |
||
|
1-11 |
44,8 |
||
|
1-12 |
33,1 |
||
|
1-13 |
28,4 |
||
|
1-14 |
32,8 |
||
|
1-15 |
32,5 |
||
|
средняя эффективность |
34,3 |
||
|
II группа (50-55) |
2-4 |
0,30 |
|
|
2-5 |
0,30 |
||
|
2-6 |
0,38 |
||
|
2-7 |
0,00 |
||
|
2-8 |
0,70 |
||
|
2-9 |
0,34 |
||
|
2-10 |
0,15 |
||
|
средняя эффективность |
0,31 (31 %) |
||
|
2-11 |
15,9 |
||
|
2-12 |
42,7 |
||
|
2-13 |
13,7 |
||
|
2-14 |
37,8 |
||
|
2-15 |
39,7 |
||
|
средняя эффективность |
30,0 |
||
|
П р и м еч а ни е. При определении средней эффективности образец, помеченный звездочкой (*), не |
|||
|
учитывали. |
|||
Исходя из полученных результатов, средняя эффективность переноса генов с помощью лентивирусных векторов составила 30,0-34,3 % и слабо варьировала при изменении времени введения после начала инкубации эмбрионов, то есть, вероятно, только часть клеток эмбриона доступна для инфицирования вирусом. Поскольку в оба срока инкубации использовались вирусные препараты с одинаковыми титрами, отмеченная разница в числе копий вектора в составе клеточного генома в I и II группах эмбрионов, по-видимому, объясняется тем, что на более ранних стадиях в клетки эмбриона проникало больше вирусных частиц (см. табл. 2). Это 463
позволяет предположить, что куриные эмбрионы можно инфицировать лентивирусными препаратами с прогнозируемой эффективностью, варьируя титр вирусного препарата и время введения после начала инкубации эмбриона, тем самым добиваясь получения трансгенной птицы с ожидаемой «дозой» (числом копий) гена в зависимости от экспериментальных целей. Таким образом, эффективность переноса генов в эмбрионы кур с использованием лентивирусных векторов не зависит от стадии развития эмбриона, по крайней мере, в течение первых 55 ч инкубации и может быть прогнозируемой.
Итак, изучение условий введения лентивирусного вектора в эмбриональные клетки птицы показало, что биологические титры вирусных препаратов порядка 108 КОЕ/мл вполне достаточны для инфицирования до 78 % клеток на ранних этапах развития эмбриона. Изменяя соотношение между компонентами векторной системы по сравнению со стандартной схемой, удается значительно увеличить титр получаемого вирусного препарата. В дальнейших экспериментах подобранные условия предполагается использовать как инструмент для изучения факторов, оказывающих влияние на уровень и стабильность экспрессии трансгенов в клетках птицы в условиях in vivo.
Список литературы Изучение условий эффективного введения трансгенов в эмбриональные клетки кур с использованием лентивирусной векторной системы
- Mizuarai S., Ono K., Yamaguchi K., Nishijima K-I., Kamihira M., Iijima S. Production of transgenic quails with high frequency of germ-line transmission using VSV-G pseudotyped retroviral vector. Biochem. Biophys. Res. Commun., 2001, 286: 456-463 ( ) DOI: 10.1006/bbrc.2001.5422
- McGrew M.J., Sherman A., Ellard F.M., Lillico S.G., Gilhooley H.J., Kingsman A.J., Mitrophanous K.A., Sang H. Efficient production of germline transgenic chickens using lentiviral vectors. EMBO Rep., 2004, 5: 728-733 ( ) DOI: 10.1038/sj.embor.7400171
- Chapman S.C., Lawson A., Macarthur W.C., Wiese R.J., Loechel R.H., Burgos-Trinidad M., Wakefield J.K., Ramabhadran R., Mauch T.J., Schoenwolf G.C. Ubiquitous GFP expression in transgenic chickens using a lentiviral vector. Development, 2005, 132: 935-940 ( ) DOI: 10.1242/dev.01652
- Smith C.A., Roeszler K.N., Sinclair A.H. Robust and ubiquitous GFP expression in a single generation of chicken embryos using the avian retroviral vector, RCASBP. Differentiation, 2009, 77(5): 473-482 ( ) DOI: 10.1016/j.diff.2009.02.001
- Волкова Н.А., Волкова Л.А., Фомин И.К., Зиновьева Н.А., Горелик Л.Ш., Лоцманова Н.С. Интеграция и экспрессия маркерных генов в эмбрионах кур при использовании ретровирусных экспрессирующих векторов. Сельскохозяйственная биология, 2013, 2: 58-61 ( , 10.15389/agrobiology.2013.2.58eng) DOI: 10.15389/agrobiology.2013.2.58rus
- Волкова Н.А., Томгорова Е.К., Багиров В.А., Белоглазов Д.В., Зиновьева Н.А., Волкова Л.А., Эрнст Л.К. Генетическая трансформация клеток кур in vitro и in vivo с использованием ретровирусных векторов. Сельскохозяйственная биология, 2009, 6: 44-48.
- Kamihira M., Ono K., Esaka K., Nishijima K., Kigaku R., Komatsu H., Yamashita T., Kyogoku K., Iijima S. High-level expression of single-chain Fv-Fc fusion protein in serum and egg white of genetically manipulated chickens by using a retroviral vector. J. Virol., 2005, 79(17): 10864-10874 ( ) DOI: 10.1128/JVI.79.17.10864-10874.2005
- Scott B.B., Velho T.A., Sim S., Lois C. Applications of avian transgenesis. ILAR J., 2010, 51(4): 353-361 ( ) DOI: 10.1093/ilar.51.4.353
- Furlan-Magaril M., Rebollar E., Guerrero G., Fernandez A., Moltai E., Gonzalez-Buenda E., Cantero M., Montoliu L., Recillas-Targa F. An insulator embedded in the chicken β-globin locus regulates chromatin domain configuration and differential gene expression. Nucl. Acids Res., 2011, 39(1): 89-103 ( ) DOI: 10.1093/nar/gkq740
- Scott B.B., Lois C. Generation of tissue-specific transgenic birds with lentiviral vectors. PNAS, 2005, 102(45): 16443-16447 ( ) DOI: 10.1073/pnas.0508437102
- Dougherty D.C., Sanders M.M. Estrogen action: revitalization of the chick oviduct model. Trends Endocrinol. Metab., 2005, 16: 414-419 ( ) DOI: 10.1016/j.tem.2005.09.001
- Shimizu M., Losos J.K., Gibbins A.M. Analysis of an approach to oviduct-specific expression of modified chicken lysozyme genes. Biochem. Cell Biol., 2005, 83(1): 49-60 ( ) DOI: 10.1139/o04-122
- Lillico S.G., Sherman A., McGrew M.J., Robertson C.D., Smith J., Haslam C., Barnard P., Radcliffe P.A., Mitrophanous K.A., Elliot E.A., Sang H.M. Oviduct-specific expression of two therapeutic proteins in transgenic hens. PNAS, 2007, 104(6): 1771-1776 ( ) DOI: 10.1073/pnas.0610401104
- Byun S.J., Kim S.W., Kim K.W., Kim J.S., Hwang I.S., Chung H.K., Kan I.S., Jeon I.S., Chang W.K., Park S.B., Yoo J.G. Oviduct-specific enhanced green fluorescent protein expression in transgenic chickens. Biosci. Biotechnol. Biochem, 2011, 75(4): 646-649 ( ) DOI: 10.1271/bbb.100721
- Schomber T., Kalberer C.P., Wodnar-Filipowicz A., Skoda R.C. Gene silencing by lentivirus-mediated delivery of siRNA in human CD34+ cells. Blood, 2004, 103(12): 4511-4513 ( ) DOI: 10.1182/blood-2003-07-2397
- Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory manual. 2nd edn. Cold Spring Harbor, NY, 1989.
- Tiscornia G., Singer O., Verma I.M. Production and purification of lentiviral vectors. Nat. Protoc., 2006, 1(1): 241-245 ( ) DOI: 10.1038/nprot.2006.37


