Изучение устойчивости к антибиотикам бактерий рода Bacillus методом серийных разведений
Автор: Донкова Н.В., Донков С.А., Кадетова М.Ю.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 5, 2019 года.
Бесплатный доступ
Цель исследований - изучение устойчивости к антибиотикам бактерий рода Bacillus методом серийных разведений. Представлены результаты исследований по изучению чувствительности пробиотических микроорганизмов Bacillus subtilis, Bacillus cereus и Bacillus licheniformis к антибиотикам. Чувствительность микроорганизмов определяли к левометицину, тетрациклину и гентамицину. Активность антибиотика устанавливали по величине его минимальной подавляющей концентрации, вызвавшей полную ингибицию прорастания спор. В качестве питательной среды использовали стерильный отвар пшеничных отрубей. Готовили основной раствор антибиотика в концентрации 160,0 мкг/мл, а рабочие растворы - с 2-кратным уменьшениемконцентрации антибиотика в каждом последующем разведении. Установлено, что наибольшей устойчивостью к антибиотикам обладает Bacillus subtilis, а наименьшей - Bacillus licheniformis. Минимальная подавляющая концентрация левомицетина для всех исследованных видов микроорганизмов составила 20 мкг/мл, у тетрациклина она составила 40 мкг/мл, а у гентамицина - 80 мкг/мл...
Пробиотик, чувствительность пробиотических микроорганизмов, антибиотик
Короткий адрес: https://sciup.org/140243462
IDR: 140243462 | УДК: 663.18
Текст научной статьи Изучение устойчивости к антибиотикам бактерий рода Bacillus методом серийных разведений
Введение . Основным этиологическим фактором в возникновении желудочно-кишечных заболеваний у сельскохозяйственных животных является группа энтеропатогенных бактерий. К этой группе относятся такие микроорганизмы, как кишечная палочка, сальмонелла, синегнойная палочка, клебсиелла, шигелла, протей и другие. С целью подавления их роста применяют антибиотики, но при этом от антибиотиков в желудочно-кишечном тракте гибнут не только патогенные, но и полезные микроорганизмы, которые заселяют желудочно-кишечный тракт в норме и участвуют в процессах пищеварения. Поэтому нередко после применения антибиотиков у животных наблюдается дисбактериоз – расстройство пищеварения, связанное с гибелью в желудочно-кишечном тракте полезных микроорганизмов.
Для преодоления этой проблемы для лечения животных в последние годы одновременно с антибиотиками внутрь стали применять препараты, содержащие в своем составе полезные микроорганизмы. Эти микроорганизмы заселяют желудочно-кишечный тракт и тем самым восстанавливают его нормальную микрофлору и пищеварение. Такие микроорганизмы получили название «пробиотики» (pro – для, bios – жизнь). Кроме участия в пищеварительных процессах, пробиотики являются антагонистами по отношению к энтеропатогенным бактериям, чем обусловлен их лечебно-профилактический эффект. Совместное применение антибиотиков с пробиотиками позволяет наряду с уничтожением патогенных микроорганизмов сохранить микробиоценоз в кишечнике, не нарушая его функционирования. Поэтому одним из критериев отбора штаммов микроорганизмов с целью использования их в пробиотических препаратах является определение их устойчивости к антибиотикам.
Применяемые в настоящее время в ветеринарии пробиотические препараты содержат в своем составе живые микроорганизмы из семейства Lactobacillus или Bifidobacterium [1], но в последние годы в пробиотические препараты стали вводить спорообразующие микроорганизмы из рода Bacillus, такие как Bac. subtilis, Bac. cereus, Bac. licheniformis [2].
Особенностью пищеварения у жвачных животных является то, что поедаемый растительный корм накапливается в рубце, а вместе с кормом в рубец в большом количестве попадают микроорганизмы, которые становятся его постоянными обитателями. Стенка рубца не выделяет пищеварительных ферментов, ферменты продуцируют микроорганизмы рубца. Для жвачных животных особенно актуальны спорообразующие микроорганизмы из рода Bacillus . Споры в рубце прорастают и при этом они выделяют амилолитические и целлюлозолитические ферменты, которые расщепляют крахмал и целлюлозу растений до глюкозы.
Основное предназначение пробиотических микроорганизмов – это восстановление нормальной микрофлоры желудочно-кишечного тракта после перенесенного заболевания. В опытах на сельскохозяйственных животных и птице было установлено, что скармливание пробиотиков увеличивает у них молочную продуктивность и приросты живой массы [3–6]. В связи с этим для животноводства актуальным является вопрос о способах применения пробиотиков – либо совместно с кормовыми антибиотиками, либо в составе кормовых добавок как с лечебно-профилактической целью, так и с целью увеличения у них продуктивности.
На сегодняшний день активность антибиотиков в отношении бацилл, применяемых в пробиотических препаратах, изучена недостаточно, между тем как оценка чувствительности бацилл к антибиотикам позволяет получить необходимую информацию для обоснования рационального применения антибиотиков совместно с пробиотиками при сохранении жизнеспособности последних. Об эффективности совместного применения антибиотиков с пробиотиками сообщают авторы [7].
Цель исследований : изучение устойчивости к антибиотикам бактерий рода Bacillus методом серийных разведений.
Для достижения цели были поставлены следующие задачи: 1) изучить устойчивость к антибиотикам микроорганизмов рода Bacillus; 2) определить минимальные подавляющие концентрации антибиотиков (МПК) к различным видам микроорганизмов рода Bacillus; 3) установить оптимальные сочетания антибиотиков с пробиотиками (in vitro) для их совместного эффективного использования.
Материал и методы исследований . Объектом исследований являлись споры микроорганизмов Bacillus subtilis , Bacillus cereus и Bacillus licheniformis . Микроорганизмы выделены и идентифицированы из предоставленного нами материала в ГосНИИ генетика (г. Москва). Микроорганизмы используются нами для производства кормовой патоки посредством гидролиза крахмала. Одновременно эти микроорганизмы, входящие в состав патоки, проявляют свойства пробиотиков [8].
Изучение чувствительности микроорганизмов к антибиотикам проводили методом серийных разведений. За основу были взяты методические указания [9]. Чувствительность микроорганизмов определяли к следующим антибиотикам – левомицетину, тетрациклину и гентамицину.
Активность антибиотика устанавливали по величине его минимальной подавляющей концентрации, вызвавшей полную ингибицию прорастания спор.
Метод серийных разведений осуществляли в пробирках объемом по 10 мл. В качестве питательной среды использовали стерильный отвар пшеничных отрубей. Готовили основной раствор антибиотика в концентрации 160,0 мкг/мл, из него готовили рабочие растворы с 2-кратным уменьшением концентрации антибиотика в каждом последующем разведении. В каждую пробирку вносили споры определенного микроорганизма в количестве 100 тыс. спор/мл. Для каждого микроорганизма готовили по 5 серий разведений одного из антибиотиков.
Заключение об устойчивости микроорганизмов к антибиотикам делали на основании подсчета разницы между количеством спор испытуемого микроорганизма, внесенных в начале эксперимента, и количеством проросших спор по окончании культивирования в присутствии заданной концентрации антибиотика. Подсчет микроорганизмов проводили согласно методике, описанной в [10], с использованием микроскопа МИКМЕД-5 и камеры Горяева. Параллельно ставили контрольную пробу со спорами, но без антибиотика. Пробирки инкубировали в термостате при t = 39 °С в течение одних суток.
Для получения статистически достоверных результатов все исследования проводили с 3-кратной повторяемостью.
Статистическую обработку полученных результатов проводили с использованием t-критерия Стьюдента в программном пакете MS Excel 2010. Различия считали достоверными при p < 0,05.
Результаты исследований . В контрольных пробирках без антибиотика наблюдали 100 %-е прорастание спор каждого изучаемого вида микроорганизма.
Из данных, представленных в таблице 1, следует, что прорастание спор всех исследуемых видов бацилл начиналось при содержании левомицетина в пробирке в концентрации, равной 10 мкг/мл.
Таблица 1
|
Содержание левомицетина в пробирке, мкг/мл |
Количество проросших спор/мл |
||
|
Bac. subtilis |
Bac. cereus |
Bac. licheniformis |
|
|
80 |
- |
- |
- |
|
40 |
- |
- |
- |
|
20 |
- |
- |
- |
|
10 |
50000±12,3 |
40000±9,1 |
25000±7,2 |
|
5 |
85000±16,7 |
70000±14,5 |
55000±11,8 |
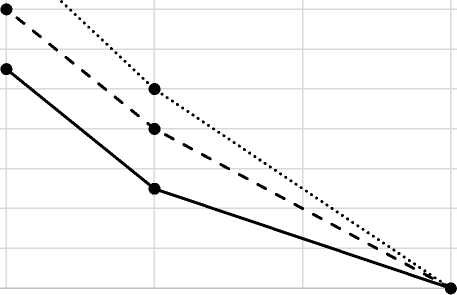
Количество проросших спор бацилл в среде с левомицетином
На графике, представленном на рисунке 1, видно, что с увеличением в пробирке концентрации левомицетина количество проросших спор в среде уменьшалось, при содержании левомицетина в концентрации 20 мкг/мл споры не прорастали.
§■ 70
§ 60
X к a 50 о
40 о
С 30
? 20 о W 10
«
5 10 15 20
Кол-во левомицитина, мкг/мл
••"••■• Bac.subtilis
Рис. 1. Динамика прорастания спор бацилл при левомицетине
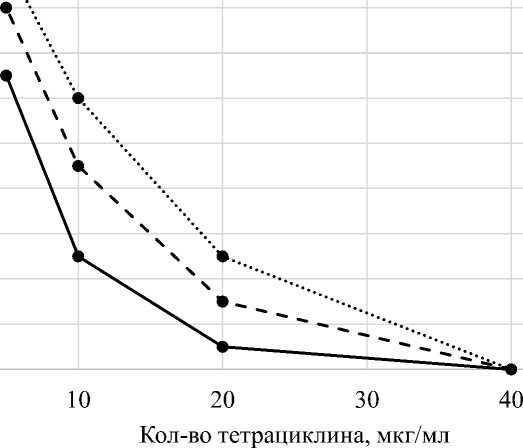
Из данных, представленных в таблице 2, рациклина в пробирке в концентрации, равной видно, что прорастание спор всех исследуемых 20 мкг/мл.
видов бацилл начиналось при содержании тет-
Количество проросших спор в среде с тетрациклином
Таблица 2
|
Содержание тетрациклина в пробирке, мкг/мл |
Количество проросших спор/мл |
||
|
Bac. subtilis |
Bac. cereus |
Bac. licheniformis |
|
|
80 |
- |
- |
- |
|
40 |
- |
- |
- |
|
20 |
25000±11,5 |
15000±12,4 |
5000±8,7 |
|
10 |
60000±14,8 |
45000±13,8 |
25000±14,1 |
|
5 |
90000±15,7 |
80000±16,7 |
65000±15,9 |
На графике, представленном на рисунке 2, видно, что с увеличением в пробирке концентрации тетрациклина количество проросших спор в среде уменьшалось, при содержании тетрациклина в концентрации 40 мкг/мл споры не прорастали.
0х 80
§70
s 60
g 50
м 30
£20
•—•••• Bac.subtilis
Рис. 2. Динамика прорастания спор бацилл при тетрациклине
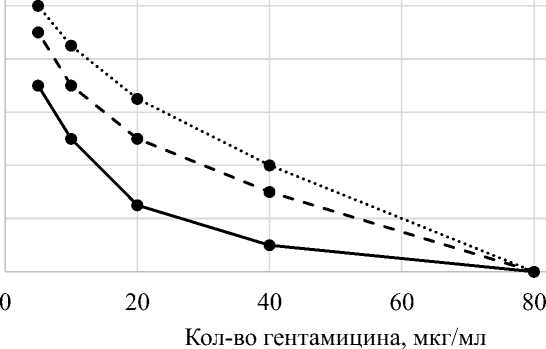
Из данных, представленных в таблице 3, видно, что прорастание спор всех исследуемых видов бацилл начиналось при содержании гентамицина в пробирке в концентрации, равной 40 мкг/мл.
На графике рисунка 3 видно, что с увеличением в пробирке концентрации гентамицина количество проросших спор в среде уменьшалось, при содержании левомицетина в концентрации 80 мкг/мл споры не прорастали.
Количество проросших спор бацилл в среде с гентамицином
Таблица 3
|
Содержание гентамицина в пробирке, мкг/мл |
Количество проросших спор/мл |
||
|
Bac. subtilis |
Bac. cereus |
Bac. licheniformis |
|
|
80 |
- |
- |
- |
|
40 |
40000±16,8 |
30000±14,7 |
10000±8,6 |
|
20 |
65000±18,4 |
50000±17,6 |
25000±12,4 |
|
10 |
85000±21,4 |
70000±19,4 |
50000±16,8 |
|
5 |
100000±22,5 |
90000±21,6 |
70000±20,5 |
X s a
И I
■■•■••■■ Bac.subtilis
Рис. 3. Динамика прорастания спор бацилл при гентамицине
Выводы . На основании результатов проведенных исследований по изучению устойчивости к антибиотикам пробиотических микроорганизмов можно заключить следующее: по устойчивости к антибиотикам микроорганизмы располагались в следующем убывающем порядке – Bac. subtilis , Bac. cereus , Bac. licheniformis .
Минимальная подавляющая концентрация левомицетина для всех исследованных видов микроорганизмов составила 20 мкг/мл, у тетрациклина – 40 мкг/мл, а у гентамицина – 80 мкг/мл. При этом наиболее устойчивым к изучаемым антибиотикам оказался микроорганизм Bacillus subtilis , его споры прорастали лучше, чем споры других видов бацилл при наличии в среде одного и того же антибиотика в одинаковых концентрациях. Хуже всего в присутствии антибиотиков прорастали споры микроорганизма Bacillus licheniformis .
Наибольшая устойчивость у всех испытуемых микроорганизмов оказалась к гентамицину, а наименьшая – к левомицетину.
Данные по устойчивости пробиотиков к антибиотикам необходимо учитывать при отборе штаммов микроорганизмов для применения их совместно с антибиотиками.
Для повышения эффективности пробиотического препарата, содержащего в своем составе споры микроорганизма Bacillus subtilis , его целесообразно применять совместно с гентамицином, так как при таком сочетании прорастает наибольшее количество спор этого пробиотического микроорганизма.
Наименьшая устойчивость ко всем антибиотикам была установлена у Bac. licheniformis , поэтому применять данный микроорганизм в качестве пробиотика следует после завершения ан-тибиотикотерапии.
Список литературы Изучение устойчивости к антибиотикам бактерий рода Bacillus методом серийных разведений
- Смирнов В.В., Коваленко Н.К., Подгорский В.С. и др. Пробиотики на основе живых культур микроорганизмов // Микробиологический журнал. - 2002. - Т. 64, № 4. - С. 62-78.
- Похиленко В.Д., Перелыгин В.В. Пробиотики на основе спорообразующих бактерий и их безопасность // Химическая и биологическая безопасность. - 2007. - № 2. - С. 32-33.
- Андреева А.В., Кадырова Д.В. Влияние пробиотика «Споровит комплекс» на динамику роста и развития телят // Вопросы нормативно-правового регулирования в ветеринарии. - 2010. - № 4. - С. 125-128.
- Белик С.Н., Чистяков В.А., Крючкова В.В. и др. Эффективность использования пробиотического препарата на основе Bacillus subtilis при выращивании цыплят-бройлеров // Изв. Нижневолжского агроуниверситетского комплекса. - 2014. - № 4 (36). - С. 151-156.
- Мурленков Н.В., Абрамкова Н.В. Эффективность применения биопрепаратов на основе бактерий рода Bacillus в технологии выращивания молочных телят // Вестн. аграр. науки. - 2018. - № 3 (72). - С. 92-100.
- Смирнова Е.А. Технология производства пробиотика КД-5 и его использование в свиноводстве: автореф. дис. … канд. биол. наук. - М., 2009. -23 с.
- Володченко В.Ф., Садуллоева Т.И. Оценка перспектив комплексного применения антибиотиков и пробиотиков при лечении инфекционных заболеваний // Российский иммунологический журнал. - 2017. - Т. 11 (20), № 2. - С. 269-270.
- Донкова Н.В., Донков С.А. Антагонистическая активность амилолитических штаммов бактерии Bacillus subtilis // Вестн. КрасГАУ. - 2016. - № 7. - С. 173-179.
- Определение чувствительности микроорганизмов к антибактериальным препаратам: метод. указания / Федер. центр госсанэпиднадзора Минздрава России. - М., 2004. - 91 с.
- ОФС.1.7.2.0008.15. Определение концентрации микробных клеток [Электрон. ресурс]. - URL: http://docs.cntd.ru/document/420339016 (дата обращения: 01.02.2019).


