Извлечение ионов тяжелых металлов клетками Rhodococcus ruber ИЭГМ 231
Автор: Костина Л.В., Куюкина М.С., Ившина И.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2013 года.
Бесплатный доступ
Подобраны оптимальные условия аккумуляции ионов тяжелых металлов клетками Rhodococcus ruber ИЭГМ 231, с учетом физико-химических (исходная концентрации ионов металла, температура, диапазон активной кислотности, источник углерода и энергии) и био -логических (стадия роста и исходная концентрация клеток родококков) факторов, обеспечивающих до 95.0% извлечения ионов тяжелых металлов из среды культивирования родокок-ков.
Тяжелые металлы, родококки, аккумуляция
Короткий адрес: https://sciup.org/147204635
IDR: 147204635 | УДК: 579.22+579.695
Текст научной статьи Извлечение ионов тяжелых металлов клетками Rhodococcus ruber ИЭГМ 231
В последние годы большое внимание исследователей привлекает способность микроорганизмов накапливать ионы тяжелых металлов (ТМ), что обусловлено их важной ролью в биогеохимической циркуляции вещества и энергии [Fredrickson, Romine, 2005]. Металлы и радионуклиды эффективно сорбируются широким кругом микроорганизмов: микроводорослями [Cai et al., 1995, 1999], грибами [Magyarosy et al., 2002; Wang, Chen, 2009] и бактериями [Gadd, 1990; Peitzsch et al., 1998], принадлежащими к различным систематическим группам [Wang, Chen, 2009].
Проблема взаимодействия ТМ с клетками микроорганизмов исследуется в нескольких направлениях, связанных с изучением изменений биохимических, физиологических и генетических особенностей микроорганизмов при контакте с металлами. Достаточно подробно исследованы способы проникновения и места локализации ТМ в бактериальных клетках, влияние физиологических параметров культуры и внешних условий на накопление ионов ТМ [Dopson et al., 2003; Harms, 2007]. Выявлено, что на процесс извлечения ионов ТМ из среды культивирования влияют изменения параметров окружающей среды: температура, диапазон активной кислотности, источник углерода и другие факторы [Perkins, Gadd, 1995].
Все большую экологическую значимость приобретают представители класса Actinobacteria
[Stackebrandt, Rainey, Ward-Rainey, 1997], биологической особенностью которых является способность к окислению углеводородов. Они занимают доминирующее положение в экстремальных местообитаниях и обладают широкими метаболическими возможностями. Несмотря на то, что биология алканотрофных актинобактерий сейчас находится в центре внимания исследователей, работы, касающиеся изучения особенностей процесса потребления ТМ клетками актинобактерий рода Rhodococcus, единичны [Пешкур, Ившина, 2003; Dabbs, Sole, 1988; Mirimanoff, Wilkinson, 2000; Bell et al., 2004].
Цель настоящего исследования - оценка основных физико-химических и биологических факторов, определяющих условия поглощения ионов ТМ клетками родококков. Конкретные задачи исследования - подбор оптимальных условий эффективного извлечения ионов ТМ с учетом температуры, pH, концентрации ТМ, источника углерода, а также возраста и концентрации исходной культуры.
Материалы и методы
В качестве модельного объекта исследования использовали штамм R. ruber ИЭГМ 231 из Региональной профилированной коллекции алканотрофных микроорганизмов (акроним ИЭГМ, No. 768 во Всемирной федерации коллекций культур; Каталог штаммов..., 1994; , выделенный из грунтовых вод в районе Ольховского нефте-
промысла, Пермской области, Россия. Выбор данного бактериального штамма обусловлен его высокой устойчивостью к ионам ТМ [Костина, Куюкина, Ившина, 2010]. Предварительные исследования показали, что минимальные ингибирующие бактериальный рост концентрации ионов ТМ составляют 2.5 и 5.0 мМ для ионов МоО42" и Ni2+, соответственно, при выращивании культуры в мясопептонном бульоне, а также 10.0 и 20.0 мМ для ионов МоО42" и Ni2+, соответственно, при выращивании культуры в минеральной среде с н-гексадеканом.
Родококки выращивали в жидкой минеральной среде, содержащей (в г/л): КН2РО4 - 1.0; (МН4)2НРО4 - 1.5; MgSO,*H2O - 0.2; FeSO4*H2O -0.01; ZnSO4"$H2O - 0.002. Компоненты питательной среды растворяли в водном растворе солей ТМ: (МН4)6Мо7О24х4Н2О или NiSO4x7H2O, в концентрации 0.6-10.0 мМ, приготовленных на бидистилли-рованной воде. В качестве единственного источника углерода использовали ацетат аммония - 2.0 г/л, глюкозу -5.0 г/л, н-гексадекан или н-додекан, в концентрации 3.0 об.%. При изучении влияния диапазона активной кислотности на процесс аккумуляции ТМ применяли буферные растворы: 20 мМ янтарная кислота - NaOH (pH 4.5-5.5); 20 мМ Na-фосфатный (pH 6.0-8.5) и 20 мМ боратный (pH 9.010.0).
Посевным материалом служила бактериальная культура, предварительно выращенная в мясопептонном бульоне в течение 2 сут. Из полученной биомассы готовили инокулят, который вносили в количестве, обеспечивающем начальную оптическую плотность суспензии 0.1-3.0х109 клеток/мл. Родококки выращивали в условиях периодического культивирования в колбах Эрленмейера объемом 250 мл на орбитальном шейкере (120 об/мин), при температуре 18-28W в течение 2 сут. Пробы для измерений отбирали по 5 мл через 1, 3, 6, 9, 12, 22, 24 и 48 ч. Клеточную биомассу отделяли центрифугированием (20 мин, 3000 об/мин) в лабораторной стационарной центрифуге, после чего дважды отмывали деионизированной водой.
В экспериментах по изучению механизма поглощения ионов ТМ использовали живые и инактивированные путем автоклавирования (0.5 атм., 20 мин) бактериальные клетки. Контролем служил раствор металла без внесения исследуемой культуры, а также бактериальная культура, выращенная в питательной среде без добавления ионов металла.
О поглощающей способности родококков судили по степени исчезновения ионов ТМ из среды, определяемой по формуле: (СНач-СКон/СНач)'*00%, где Снач - исходная; Скон - конечная концентрация ТМ в среде культивирования. Одновременно регистрировали количество МоО42" и Ni2+, поглощенных клеточной биомассой. Для этого суспензию клеток осаждали центрифугированием (3000 об/мин; 20 мин), тщательно отмывали (до отсутствия ионов ТМ в промывных водах) бидистиллятом и разрушали ультразвуком (23 кГц; 0.7 А) с помощью низкочастотного гомогенизатора (Soniprep 150, Sanyo, Япония), в течение 15 мин в условиях охлаждения суспензии. Гомогенаты бактериальных клеток центрифугировали при 3000 об/мин в течение 20 мин. Полученные супернатанты анализировали на присутствие ионов МоО42" или Ni2+. Коэффициент биоаккумуляции определяли по формуле Свнугр/Скнеш, где С,, „я, - количество внутриклеточного металла, мкг/г; СВнеш - количество металла в культуральной среде, мкг/мл.
Физиологическое состояние бактериальной культуры контролировали по изменению оптической плотности клеточной суспензии и приросту биомассы. Оптическую плотность (ОП6оо) измеряли спектрофотометрически (/=600 нм) с помощью спектрофотометра (Lambda EZ201 (UV/Vis), Perkin-Elmer, США), кюветы с толщиной поглощающего слоя /=10 мм. Накопление биомассы фиксировали весовым и нефелометрическим методом. Контроль чистоты использованной в работе культуры родококков осуществляли методом прямого высева на МПА и визуально, просматривая препараты в световом фазово-контрастном микроскопе (Axiostar plus, CARL ZEISS, Германия).
Количественное определение молибдена проводили фотометрическим роданидным методом, никеля диметилглиоксимным - с помощью спектрофотометра при длине волны Х=470 нм [Лурье, 1984].
Все эксперименты проводили в трех- или пятикратной повторностях в зависимости от условий проведения эксперимента. Математическую обработку полученных результатов осуществляли традиционными методами с вычислением среднего арифметического, среднеквадратичного отклонения, стандартной ошибки и доверительного интервала с использованием пакета компьютерных программ Statistica, версия 6.0 для Windows (StatSoft Inc., 2001), и Excel 2003 (Microsoft Inc., 2003).
Результаты и их обсуждение
По нашим данным, коллекционный штамм R. ruber ИЭГМ 231 обладает способностью к извлечению ионов ТМ. Уровень потребления ионов ТМ зависит как от их исходной концентрации в среде культивирования, так и источника углерода (таблица). Как видно из таблицы, ТМ, присутствующие в среде культивирования в форме катионов извлекаются в среднем в 1.2 раза более эффективно по сравнению с таковыми анионной формы. Максимальное извлечение МоО42" и Ni2+ родокок-ками выявляется при исходной концентрации ТМ в среде культивирования от 0.6 до 2.5 мМ. Следует отметить, что аккумулирующая активность сохраняется и при повышенных (до 10.0 мМ) концентрациях ионов ТМ в среде культивирования. Из дан- ных, представленных в таблице, следует, что родо-кокки при росте на углеводородсодержащих питательных средах, а также в присутствии глюкозы более эффективно извлекают ионы ТМ по сравнению с ацетатом аммония в качестве единственного источника углерода и энергии. Несмотря на то. что степень извлечения ТМ из среды с углеводородами сопоставима с таковой в присутствии глюкозы.
временной промежуток. за который фиксируется максимум поглощения ТМ бактериальными клетками. в 12-24 раза короче при выращивании в среде с глюкозой. Эго позволяет проводить экспрессные исследования по поиску актинобактерий - активных биоаккумуляторов ионов ТМ с использованием глюкозосодержащей минеральной среды.
Влияние концентраций ТМ и источника углерода на степень (%) извлечения ионов МоО42- и Ni2+ клетками R. ruber ИЭГМ 231
|
Концентрация ТМ. мМ |
Источник углерода |
|||
|
Ацетат аммония |
и-Додекан |
н-Гексадекан |
Глюкоза |
|
|
МоО42 |
||||
|
0.6 |
55.3±2.14 |
80.3±1.20 |
98.3±1.26 |
91.7±0.32 |
|
1.3 |
44.6±1.21 |
73.2±1.14 |
90.3±1.18 |
82.6±0.27 |
|
2.5 |
20.3±1.12 |
58.4±1.26 |
74.6±1.28 |
68.3±1.00 |
|
5.0 |
12.5±0.34 |
32.6±0.86 |
38.7±2.22 |
34.Ш.12 |
|
10.0 |
10.4±0.18 |
28.4:0.44 |
30.2±0.84 |
27.2±0.68 |
|
№2+ |
||||
|
0.6 |
77.2±1.11 |
94.5±2.27 |
100.1±0.08 |
100.2±0.24 |
|
1.3 |
62.8±1.72 |
86.4±1.64 |
98.7±0.88 |
92.2±0.16 |
|
2.5 |
24.7±1.53 |
67.2±2.48 |
91.5±1.10 |
81.3±1.12 |
|
5.0 |
18.3±1.16 |
38.7±1.62 |
54.4±1.88 |
46.4±2.20 |
|
10.0 |
14.4±0.58 |
30.3±0.44 |
36.6±0.68 |
31.3±0.96 |
Примечание. Время культивирования, при котором зафиксирована максимальная степень извлечения ионов МоО42: 6 ч - ацетата аммония, глюкозы, 72 ч - и-додекана, н-гексадекана; Ni2+: 3 ч - ацетата аммония, глюкозы, 72 ч -н-додекана, н-гексадекана.
Изучение влияния температуры культивирования родококков на эффективность процесса аккумуляции ТМ показало, что максимальное извлечение ионов МоОу и Ni* наблюдается при температуре 28°С (рис. 1). Следует отметить, что данные результаты совпадают с температурным оптимумом для извлечения радиоактивных ионов Cs* показанным нами ранее в работе [Ившина. Пешкур. Коробов. 2002].
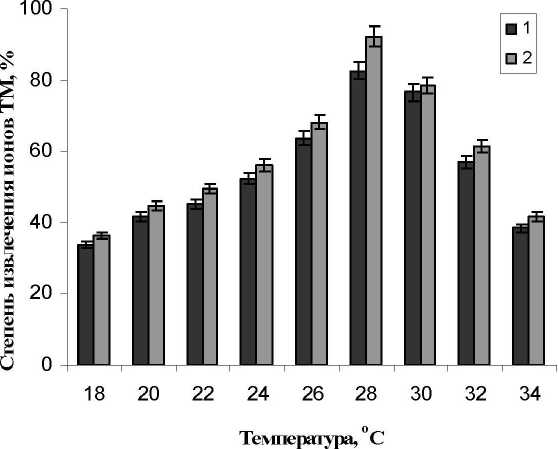
Рис. 1. Влияние температуры на степень извлечения ионов ТМ (1.3 мМ) клетками R. ruber ИЭГМ 231. Варианты опыта: 1 - поглощение ионов МоО42"; 2 - поглощение ионов Ni2*
На рис. 2 приведены результаты экспериментов по изучению влияния диапазона активной кислотности на интенсивность извлечения ионов ТМ. Установлено, что наиболее высокая степень поглощения ионов ТМ родококками получена при близких к нейтральным (6.0-7.5) значениях pH.
Как видно из рис. 3. фазы роста бактериальной культуры в среде, содержащей ионы ТМ. замедляются от 1.3 до 10.0 раз. Так. период лат-фазы, за который культура адаптируется к условиям среды и подготавливается к периоду быстрого размножения в среде без ТМ. составляет 3 ч. тогда как в присутствии ионов ТМ процесс адаптации к среде культивирования удлиняется в 2 раза и составляет 6 ч. Экспоненциальная фаза роста и размножения бактериальной культуры завершается к 10-12 ч при росте в среде без добавления ионов ТМ. тогда как в присутствии ТМ переход культуры в стационарную фазу начинается лишь после 18-22 ч культивирования.
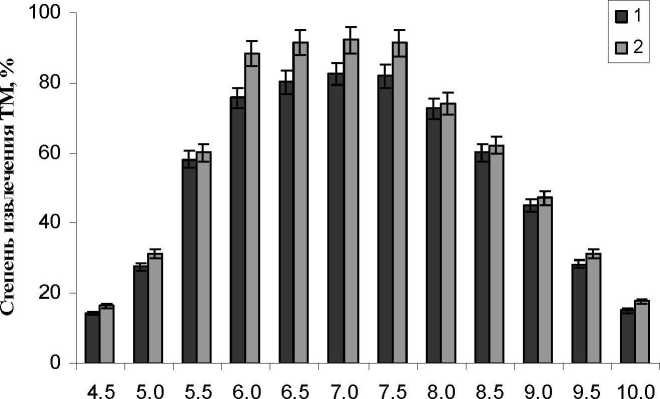
Диапазон акпшной кислотности, pH
Рис. 2. Влияние показателя активной кислотности на степень извлечения ТМ (1.3 мМ) клетками родококков.
Варианты опыта: 1 - поглощение ионов МоОД 2 - поглощение ионов NP*
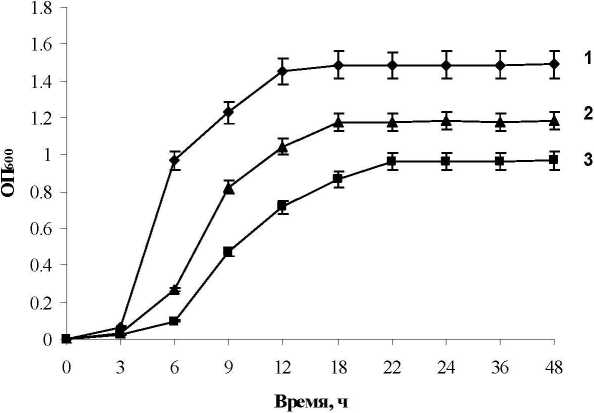
Рис. 3. Влияние ионов ТМ (1.3 мМ) на динамику роста клеток родококков.
Варианты опыта: 1 - контроль (минеральная среда с глюкозой); 2 - среда с ионами Ni2+; 3 - среда с ионами ' МоОг..... '
На рис. 4 представлены результаты опытов по ТМ (МоО42" и Ni2+) клетками R. ruber ИЭГМ 231. определению интенсивности поглощения ионов отобранных в разные стадии роста. По нашим дан- ним. родококки извлекают максимальное (до 92.2%) количество ионов никеля из среды культивирования в случае использования клеток, пребывающих в логарифмической фазе роста. Наибольшее извлечение молибдат ионов регистрируется при использовании клеток, пребывающих в экспоненциальной фазе роста.
На рис. 5 приведены результаты процесса извлечения ионов ТМ в зависимости от плотности бактериальной культуры. Так. при исходной концентрации клеток, равной 2.0 г сухого веса клеток/л среды культивирования, извлечение ионов ТМ достигает максимального (до 95%) уровня. Использование более высокой плотности бактериальных клеток не приводит к значительному увеличению (не более, чем на 0.5%) интенсивности извлечения ионов ТМ. Таким образом, в результате проведенных исследований показано, что максимальный уровень извлечения ионов ТМ наблюдается при посевной дозе 2.0 г сухого веса клеток/л среды.
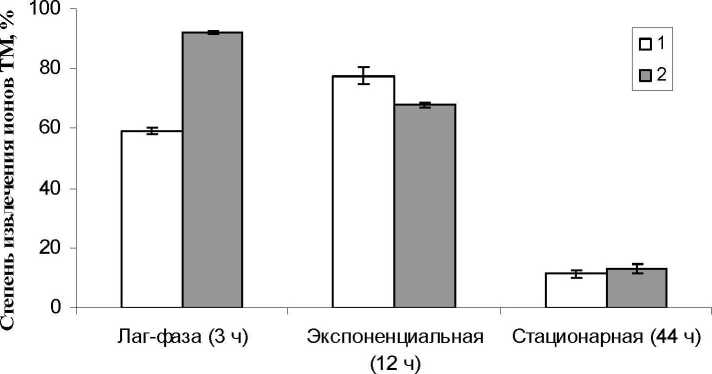
Стадии роста
Рис. 4. Влияние фазы роста клеток родококков на степень поглощения ионов ТМ (1.3 мМ).
В экспериментах использовали эквивалентное количество бактериальных клеток. Варианты опыта: 1 -поглощение ионов МоО4 * 2 - поглощение ионов Ni®
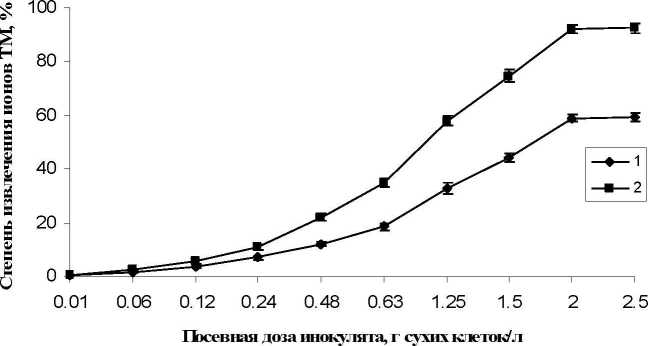
Рис. 5. Влияние исходной концентрации бактериальных клеток/?, ruber ИЭГМ 231 на степень поглощения ионов ТМ (1.3 мМ).
Варианты опыта: 1 - поглощение МоО42" через 6 ч культивирования; 2 - поглощение Ni2+ через 3 ч культивирования
В работе были изучены пути поступления ионов ТМ (МоО42" и Ni*). а также выявлены основные закономерности процесса их накопления живыми и мертвыми клетками родококков (рис. 6). Как видно из рис. 6. коллекционная культура
R. ruber ИЭГМ 231 обладает способностью поглощать как катионы, так и анионы ТМ. По данным сравнительных опытов с живыми и автоклавированными клетками R. ruber ИЭГМ 231. установлено. что уровень аккумуляции ионов ТМ в 9.4-10.0
раз ниже инактивированными, чем живыми клетками. В сравнительных опытах с использованием живых и автоклавированных клеток родококков установлено, что интенсивное поглощение ионов Ni2+ происходит в течение первых 3 ч, тогда как поглощение ионов МоО?" - в течение первых 6 ч эксперимента (рис. 6). В дальнейшем живые клетки начинают постепенно (до 60.0% от накопленного) выбрасывать аккумулированные ранее молиб ден и никель, в то время как инактивированные клетки стабильно удерживают от 6.0 до 13.0% связавшихся с ними ионов ТМ. На основании полученных данных можно заключить, что до 83.2% аккумулирующей активности приходится на способность концентрировать ионы молибдена энергозависимым образом, то есть биоаккумулированием.
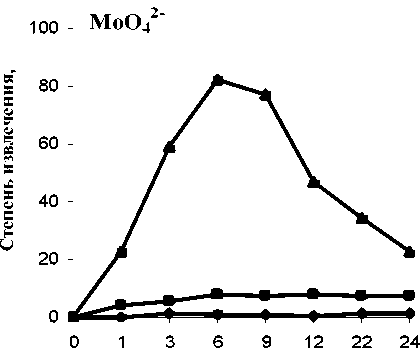
Рис. 6. Аккумуляция ионов ТМ живыми и инактивированными клетками R. ruber ИЭГМ 231
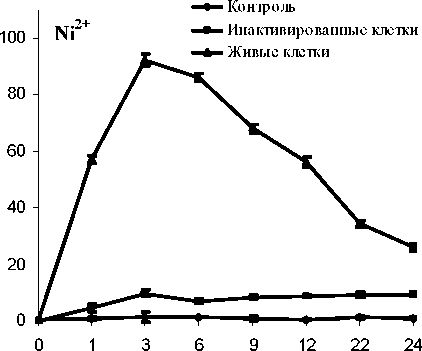
Увеличение времени взаимодействия с ионами ТМ до 48 ч не приводит к возрастанию их содержания в бактериальных клетках. В дальнейшем эта величина или не изменяется, или уменьшается, то есть ионы металла поступают из бактериальных клеток вновь в среду культивирования. При этом концентрация ионов ТМ в родококках снижается до уровня, который наблюдается в результате процесса биосорбции (6.0-13.0%).
Заключение
В результате проведенных исследований установлено, что коллекционный штамм R. ruber ИЭГМ 231 обладает способностью аккумулировать ионы ТМ. Процесс поглощения тяжелых металлов родо кокками является комплексным и осуществляется посредством пассивного связывания клеточными структурами и активного транспорта. Полученные данные позволяют утверждать, что значительная часть процесса поглощения ионов ТМ клетками родококков обеспечивается активным транспортом. Максимальное извлечение катионов ТМ наблюдается в логарифмической, анионов - в экспоненциальной фазе роста родококков. Определены оптимальные условия для эффективного извлечения ионов ТМ клетками родококков: температура, диапазон активной кислотности, источник углерода и энергии, стадия роста и исходная концентрация клеток родококков, обеспечивающие до 95.0-100.0% извлечения ионов тяжелых металлов из среды культивирования. Интенсивное (до 100.0%) извлечение ионов ТМ из среды культивирования происходит при следующих условиях: присутствие ТМ в среде в концентрациях до 10.0 мМ, при 26-30W; pH 6.0-7.5; в присутствии н-гексадекана или глюкозы и при исходной концентрации бактериальной культуры 2.0 г сухого веса клеток/л среды.
Работа выполнена при поддержке программ фундаментальных исследований Президиума РАН «Живая природа» (проект № 12-П-4-1044 ) и «Молекулярная и клеточная биология» (проект № 12-П-4-1052).
Список литературы Извлечение ионов тяжелых металлов клетками Rhodococcus ruber ИЭГМ 231
- Ившина И.Б., Пешкур Т.А., Коробов В.П. Эффективное извлечение цезия клетками бактерий рода Rhodococcus//Микробиология. 2002. Т. 71, № 3. С. 418-423
- Каталог штаммов Региональной профилированной коллекции алканотрофных микроорганизмов/под ред. И.Б. Ившиной. М.: Наука, 1994. 163 с
- Костина Л.В., Куюкина М.С., Ившина И.Б. Биосорбция, аккумуляция и способы извлечения тяжелых металлов. LAP Lambert Academic Publishing, 2010. 254 c
- Лурье А. Аналитическая химия промышленных вод. М.: Химия, 1984. 448 с
- Пешкур Т.А., Ившина И.Б. Особенности аккумуляции цезия бактериальными клетками Rhodococcus ruber при росте на н-гексадекане//Экология. 2003. № 1. С. 84-86
- Bell J.M.L. et al. Methods evaluating vanadium tolerance in bacteria isolated from crude oil contaminated land//J. Microbiol. Methods. 2004. Vol. 58. P. 87-100
- Cai X.H. et al. Application of eukaryotic algae for the removal of heavy metals from water//Molecular Marine Biol. Biotechnol. 1995. Vol. 4. P. 338344
- Cai X.H. et al. Growth and heavy metal binding properties of transgenic algae (Chlamydomonas reinhardtii) expressing a foreign metallothionein gene//Int. J. Phytoremediation. 1999. Vol. 1. P. 53-65
- Dabbs E.R., Sole G.J. Plasmid-borne resistance to arsenate, arsenite, cadmium, and chloramphenicol in a Rhodococcus species//Mol. Gen. Genom. 1988. Vol. 211, № 1. P. 148-154
- Dopson M. et al. Growth in sulfidic mineral environments: metal resistance mechanisms in acidophilic microorganisms//Microbiology. 2003. Vol. 149. P. 1959-1970
- Fredrickson J.K., Romine M.F. Genome-assisted analysis of dissimilatory metal-reducing bacteria//Curr. Opin. Biotechnol. 2005. Vol. 16. P. 269274
- Gadd G.M. Metal tolerance//Microbiol. Extreme Environ. Open University Press, Milton Keynes, 1990. P. 178-210.
- Magyarosy A. et al. Nickel accumulation and nickel oxalate precipitation by Aspergillus niger//Appl. Microbiol. Biotechnol. 2002. Vol. 59. P. 382-388
- Mirimanoff N., Wilkinson K.J. Regulation of Zn accumulation by a freshwater gram-positive bacterium (Rhodococcus opacus)//Environ. Sci. Technol. 2000. Vol. 34. P. 616-622
- Peitzsch N., Eberz G., Nies D.H. Alcaligenes eutrophus as a bacterial chromate sensor//Appl. Environ. Microbiol. 1998. Vol. 64, № 2. P. 453458
- Perkins J., Gadd G.M. The influence of pH and external K+ concentration on cesium toxicity and accumulation in Escherichia coli and Bacillus subtilis//J. Ind. Microbiol. 1995. Vol. 14, № 3-4. P. 218-225
- Stackebrandt E., Rainey F.A., Ward-Rainey N.L. Proposal for a new hierarchic classification system, Actinobacteria classis nov.//Int. J. Syst. Bacteriol. 1997. Vol. 47, № 2. P. 479-491
- Wang J., Chen C. Biosorbents for heavy metals removal and their future//Biotechnol. Advances. 2009. Vol. 27. P. 195-226
- Harms H. Biosensing of heavy metals//Microbiol. Monogr. 2007. Vol. 6. P. 143-157


