Эффективность аблации фибрилляции предсердий при наличии хронического миокардита
Автор: Арчаков Е. А., Баталов Р. Е., Усенков С. Ю., Степанов И. В., Афанасьев С. А., Попов С. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
Цель: сравнение эффективности интервенционного лечения фибрилляции предсердий (ФП) у пациентов с хроническим миокардитом, выявленным по данным эндомиокардиальной биопсии (ЭМБ), и у пациентов без миокардита.Материал и методы. В исследуемую выборку включены 40 пациентов, из них 27 (67,5%) мужчин. Возраст в выборке составил 49 (44; 55) лет. В исследование вошли 25 (62,5%) больных с пароксизмальной формой ФП, 10 (25,0%) - с персистирующей и 5 (12,5%) - с длительно-персистирующей. Всем пациентам было проведено оперативное лечение ФП методом радиочастотной (РЧА) или криобаллонной аблации (КБА). Для верификации диагноза у 18 больных выполняли ЭМБ. Период наблюдения за пациентами составил 12 мес.Результаты: Всем пациентам проведено оперативное лечение ФП, в 7 случаях (17,5%) выполнена КБА легочных вен (ЛВ), в 33 (82,5%) - РЧА. По результатам биопсии признаки миокардита выявлены у 9 больных (22,5%). Очаговый миокардит обнаружен у 7, диффузный - у 2 больных. Эффективность катетерного лечения в общем составила 72,5%, для КБА - 71,5%, для РЧА - 73,5%. Эффективность аблации ФП с наличием выявленного миокардита составила 88,9%, без миокардита - 67,5%.Выводы. Эффективность катетерного лечения ФП у пациентов с признаками миокардита достигала 88,9% и оказалась выше, чем у пациентов без признаков миокардита.
Фибрилляция предсердий, хронический миокардит, катетерная аблация
Короткий адрес: https://sciup.org/149144448
IDR: 149144448 | УДК: 616.12-008.313.2-089.819.1:616.127-002.2 | DOI: 10.29001/2073-8552-2023-38-4-97-105
Текст научной статьи Эффективность аблации фибрилляции предсердий при наличии хронического миокардита
Фибрилляция предсердий (ФП) является широко распространенным нарушением ритма сердца, которое неуклонно прогрессирует, переходя со временем из пароксизмальной в персистирующую и постоянную форму. Известно влияние ФП на развитие и прогрессирование сердечной недостаточности, деменции и на возникновение инсульта [1]. Существующие методы лечения в основном сводятся к интервенционной электрической изоляции легочных вен (ЛВ) в левом предсердии (ЛП). Однако в настоящий момент эффективность аблации устьев ЛВ далеко не всегда бывает высокой, нередко развиваются рецидивы аритмии.
Одним из неблагоприятных факторов, который может влиять на успех интервенционного лечения ФП, является хронический миокардит. До сих пор остается нерешенным вопрос о прижизненной диагностике воспаления миокарда и оценке степени развития фиброза сердца. Хронический вирусный миокардит зачастую сопутствует другим заболеваниям сердца – ишемической болезни сердца (ИБС), гипертонической болезни (ГБ) и другим, может иметь «стертую» клиническую картину, тем самым «маскируется» от внимания врача, что способствует гиподиагностике.
Применение существующих неинвазивных методов диагностики зачастую в той или иной степени ограничено. Тем не менее, известны последствия, к которым прогрессирующий миокардит может привести, – это выраженный гетерогенный фиброз, являющийся арит-могенным субстратом. В настоящее время до конца не изучено влияние хронического вирусного воспаления миокарда на течение ФП и эффективность ее аблации.
Цель исследования: сравнительная оценка эффективности интервенционного лечения ФП у пациентов с миокардитом и без него.
Материал и методы
Все процедуры, выполненные с участием пациентов, соответствуют этическим стандартам Комитета по биомедицинской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям. От каждого из включенных в исследование участников было получено информированное добровольное согласие.
В исследуемую выборку включены 40 пациентов, поступивших в отделение хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции Научно-исследовательского института кардиологии Томского национального исследовательского медицинского центра Российской академии наук, из них 27 (67,5%) мужчин. Возраст в выборке составил 49 (44; 55) лет.
У всех пациентов была диагностирована симптом-ная ФП на основании результатов электрокардиографии (ЭКГ) и суточного мониторирования. В исследование вошли 25 (62,5%) больных с пароксизмальной формой ФП, 10 (25,0%) – с персистирующей и 5 (12,5%) – с длитель-но-персистирующей.
На момент поступления в стационар по основному диагнозу преобладали пациенты с ГБ, в меньшей степени встречались пациенты с ИБС (функциональный класс (ФК) менее 2) и идиопатической ФП. В ходе госпитализации после проведения эндомиокардиальной биопсии (ЭМБ) у 9 больных диагноз идиопатического нарушения ритма сердца был изменен на хронический миокардит. У 21 пациента (52,5%) не было признаков хронической сердечной недостаточности. Остальные показатели клинической характеристики пациентов на момент включения в исследование представлены в таблице 1.
Всем пациентам выполнено эхокардиографическое исследование сердца. Эхокардиографию проводили, используя аппарат Philips HD15 (Нидерланды) из стандартных позиций с оценкой размеров отделов сердца и фракцией выброса левого желудочка (ФВ ЛЖ) по методу Симпсона.
Таблица 1. Общая клиническая характеристика пациентов на момент поступления в стационар
Окончание табл. 1
End of table 1
Table 1. General clinical characteristics of patients at the time of admission to the hospital
|
Показатели Index |
Характеристики Characteristics |
|
Количество пациентов Number of patients |
40 |
|
Мужчины Men |
27 (67,5) |
|
Возраст, лет, Me ( Q 1; Q 3) Age, years, Me ( Q 1; Q 3) |
49 (44,0; 55,0) |
|
Основное заболевание Main disease |
|
|
ИБС Ischemic heart disease |
7 (17,5) |
|
ГБ Hypertonic disease |
24 (60,0) |
|
Идиопатическая ФП Idiopathic AF |
9 (22,5) |
|
Функциональный класс хронической сердечной недостаточности Functional class of chronic heart failure |
|
|
I |
11 (27,5) |
|
II |
5 (12,5) |
|
III |
3 (7,5) |
|
ОНМК в анамнезе A history of stroke |
1 (2,5) |
|
СД Diabetes |
1 (2,5) |
|
Некардиальная сопутствующая патология Non-cardiac comorbidities |
|
|
Патология органов пищеварения Pathology of the digestive system |
16 (40,0) |
|
Патология органов дыхания Pathology of the respiratory system |
3 (7,5) |
|
Патология щитовидной железы Pathology of the thyroid gland |
7 (17,5) |
|
Ожирение Obesity |
14 (35,0) |
|
CHA2DS2VASc |
|
|
0–1 |
23 (57,5) |
|
2–3 |
13 (32,5) |
|
Более 4 More than 4 |
4 (10) |
|
HAS-BLED |
|
|
0 |
30 (75) |
|
1 |
9 (22,5) |
|
2 |
1 (2,5) |
|
Класс EHRA EHRA class |
|
|
I |
6 (15,0) |
|
II |
33 (82,5) |
|
III |
1 (2,5) |
|
Размер ЛП LА size |
41,6 ± 5,1 |
|
ФВ ЛЖ, %, Me ( Q 1; Q 3) LV EF, %, Me ( Q 1; Q 3) |
65 (57,5; 69,0) |
|
ПЖ, мм, Me ( Q 1; Q 3) RV, mm Me ( Q 1; Q 3) |
24 (22,0; 25,5) |
|
ЛП, мм, Me ( Q 1; Q 3) LA, mm, Me ( Q 1; Q 3) |
42 (39,0; 44,5) |
|
МЖП, мм, Me ( Q 1; Q 3) IVS, mm, Me ( Q 1; Q 3) |
10 (9,2; 10,9) |
|
ЗСЛЖ, мм, Me ( Q 1; Q 3) posterior wall of the LV, mm, Me ( Q 1; Q 3) |
10 (9,0; 10,0) |
|
Показатели Index |
Характеристики Characteristics |
|
КСО, мл, Me ( Q 1; Q 3) End systolic volume, ml, Me ( Q 1; Q 3) |
36 (29,0; 49,0) |
|
КДО, мл, Me ( Q 1; Q 3) End diastolic volume, ml, Me ( Q 1; Q 3) |
105 (90,5; 120,5) |
|
КДР, мм, Me ( Q 1; Q 3) End diastolic size, mm, Me ( Q 1; Q 3) |
49 (46,0; 54,0) |
|
КСР, мм, Me ( Q 1; Q 3) End systolic size, mm, Me ( Q 1; Q 3) |
31 (29,0; 36,5) |
|
ИС ЛЖ, мм, Me ( Q 1; Q 3) LV sphericity index, mm, Me ( Q 1; Q 3) |
0,56 (0,52; 0,58) |
|
Пик_Е, см/с, Me ( Q 1; Q 3) Peak_E, sm/s, Me ( Q 1; Q 3) |
78 (61,5; 95,5) |
|
Пациенты с ГЛЖ, n (%) Patients with LVH, n (%) |
2 (5,0) |
|
Антиаритмическая терапия во время госпитализации Antiarrhythmic therapy at the admission |
|
|
Амиодарон Amiodarone |
13 (32,5) |
|
Соталол Sotalol |
12 (30,0) |
|
Пропафенон Propafenone |
8 (20,0) |
|
Бета-блокаторы Beta blockers |
16 (40,0) |
|
Антикоагулянты Anticoagulants |
40 (100) |
Примечание: здесь и далее в таблицах: ИБС – ишемическая болезнь сердца, ГБ – гипертоническая болезнь, ФП – фибрилляция предсердий, ОНМК острое нарушение мозгового кровообращения, СД – сахарный диабет, ФК ХСН – функциональный класс хронической сердечной недостаточности, ЛП – левое предсердие, ФВ ЛЖ – фракция выброса левого желудочка, ПЖ – правый желудочек, МЖП – межжелудочковая перегородка, ЗСЛЖ – задняя стенка левого желудочка, КСО конечный систолический объем, КДО конечный диастолический объем, КДР конечный диастолический размер, КСР конечный систолический размер, ГЛЖ – гипертрофия левого желудочка, EHRA – European Heart Rhythm Association (Европейская ассоциация сердечного ритма), ИС ЛЖ – индекс сферичности левого желудочка.
Note: AF – atrial fibrillation, EHRA – European Heart Rhythm Association, LA – left atrium, LV EF – left ventricular ejection fraction, RV– right ventricle, IVS – interventricular septum, LV – left ventricl, LVH – left ventricular hypertrophy.
Часть пациентов помимо ФП имели другие нарушения сердечного ритма: 3 пациента (7,5%) – желудочковую экстрасистолию, 1 пациент (2,5%) – наджелудочковую экстрасистолию, 2 пациента (5,0%) – атриовентрикулярную блокаду 1-й степени.
Всем пациентам было проведено оперативное лечение ФП методом радиочастотной (РЧА) или криобаллон-ной аблации (КБА) по общепринятой методике. Объем вмешательства включал в себя антральную изоляцию устьев ЛВ под контролем циркулярного электрода до полного блока электрического проведения из вены в предсердие и обратно. При РЧА использовали электрод SmartTouch (Biosense Webster, США) и показатель «индекс аблации».
Для верификации диагноза у 18 больных по общепринятой методике выполняли ЭМБ. Биопсию выполняли по одному из пунктов «показаний к ЭМБ», приведенных в Клинических рекомендациях «Неустановленные причины фибрилляции предсердий» (уровень убедительности рекомендаций – А, уровень достоверности доказательств –
-
5) [2]. ЭМБ проведена всем больным с идиопатическим нарушением ритма сердца и у некоторых больных с ГБ I ст. и ИБС без значимого поражения коронарных сосудов (у которых, по мнению авторов, основное заболевание не оказывало значимого влияния на развитие ФП). Образцы эндомиокарда из верхушки, межжелудочковой перегородки (МЖП) и выводного отдела правого желудочка (ПЖ) фиксировали в 10%-м забуференном нейтральном формалине не более 24 ч. Парафиновые срезы окрашивали гематоксилином и эозином, пикрофук-сином, толуидиновым синим, у пациентов старше 45 лет исключали кардиальный амилоидоз с помощью окраски Конго красным. Исследовали гистологические препараты на светооптическом уровне с использованием микроскопа AxioImager M2 Zeiss. Морфологическую верификацию миокардита проводили в соответствии с модифицированными Всемирной Федерацией сердца Далласкими критериями [3, 4]. Степень активности воспаления (Grading) и выраженности фиброза (Staging) оценивали с использованием полуколичественных гистологических критериев, предложенных C. Basso с соавт. для оценки морфологических изменений при воспалительной кардиомиопатии с учетом консенсуса Европейского общества кардиологов по диагностике и лечению миокардитов [5, 6]. Площадь интерстициального фиброза по отношению к площади среза миокарда определяли с помощью программы обработки и анализа изображения Zeiss Efficient Navigation – ZEN (Carl Zeiss, Германия).
Несмотря на то, что забор биопсийного материала проводится из структур ПЖ, исследование Л.Б. Митрофановой с соавт. позволяет экстраполировать данные, полученные при заборе тканей из ПЖ, на предсердные структуры сердца [6].
Период наблюдения за пациентами составил 12 мес. За это время дважды проведены визиты (через 3 и 12 мес. после операции), в ходе которых проведен сбор анамнеза, запись ЭКГ, проведено суточное мониторирование ЭКГ. Ранними считались рецидивы аритмии, возникшие в срок до 3 мес. после операции, а поздние – рецидивы ФП, документированные от 3 до 12 мес. после вмешательства.
Статистический анализ осуществляли с помощью программы STATISTICA 10. Количественные данные были предварительно проверены на соответствие нормальному закону распределения с помощью критерия Шапиро – Уилка. Так как большая часть исследуемых параметров не соответствовала нормальному закону распределения, то дальнейший анализ проводили с помощью критерия Манна – Уитни, для сравнения нормально распределенных количественных показателей в независимых группах использовали критерий Стьюдента. Различия между категориальными показателями в независимых группах пациентов оценивали с помощью χ 2 -критерия Пирсона или двустороннего точного критерия Фишера. Построено две модели однофакторной логистической регрессии, проведен их ROC-анализ. Пороговый уровень значимости при проверке гипотез был принят равным 0,05.
Результаты
Всем пациентам проведено оперативное лечение ФП, в 7 случаях (17,5%) выполнена КБА ЛВ, в 33 (82,5%) – РЧА. У всех больных все ЛВ были изолированы. Медиана времени операции РЧА составила 87,5 (70,0; 95,0) мин, КБА – 77,5 (70,0; 85,0) мин. Медиана времени рентгеноскопии при РЧА была 7,0 (5,5; 9,0) мин, при КБА –
8,5 (8,0; 9,0) мин. В 15 случаях (37,5%) в конце операции потребовалось проведение электрической кардиоверсии для восстановления синусового ритма. Для уточнения диагноза у 18 пациентов (45%) взята ЭМБ. В качестве осложнений после операции выявлена артериовенозная фистула – у одного (2,5%) пациента, гемоперикард – у одного (2,5%) пациента.
По результатам биопсии признаки миокардита выявлены у 9 больных (22,5%). Очаговый миокардит обнаружен у 7, диффузный – у 2 больных. Остальные полученные показатели представлены в таблице 2.
Таблица 2. Результаты эндомиокардиальной биопсии миокарда
Table 2. Results of endomyocardial myocardial biopsy
|
Показатели Index |
Значение Value |
|
Очаговый, n (%) Focal, n (%) |
7 (38,9) |
|
Диффузный, n (%) Diffuse, n (%) |
2 (11,1) |
|
Общее число активированных Т-лимфоцитов (верхушка ПЖ), Me ( Q 1; Q 3) Total number of activated T-lymphocytes (apex of the right ventricle), Me ( Q 1; Q 3) |
10 (9; 16) |
|
Общее число активированных Т-лимфоцитов (МЖП), Me ( Q 1; Q 3) Total number of activated T-lymphocytes (interventricular septum), Me ( Q 1; Q 3) |
25 (17; 28) |
|
Общее число активированных Т-лимфоцитов (выводной отдел ПЖ), Me ( Q 1; Q 3) Total number of activated T-lymphocytes (right ventricular outflow tract), Me ( Q 1; Q 3) |
19 (16; 23) |
|
Активность воспаления (G), верхушка ПЖ, баллы, Me ( Q 1; Q 3) Inflammatory activity (G), right ventricular apex, points, Me ( Q 1; Q 3) |
1 (1; 2) |
|
Активность воспаления (G), МЖП, баллы, Me ( Q 1; Q 3) Inflammatory activity (G), interventricular septum, points, Me ( Q 1; Q 3) |
2 (2; 2) |
|
Активность воспаления ( G), выводной отдел ПЖ, Me ( Q 1; Q 3) Inflammatory activity (G), right ventricular outflow tract, баллы, Me ( Q 1; Q 3) |
2 (2; 2) |
|
Выраженность фиброза (S), верхушка ПЖ, баллы, Me ( Q 1; Q 3) Fibrosis severity (S), right ventricular apex, points, Me ( Q 1; Q 3) |
1 (1; 1) |
|
Выраженность фиброза (S), МЖП, баллы, Me ( Q 1; Q 3) Fibrosis severity (S), interventricular septum, points, Me ( Q 1; Q 3) |
0 (0; 1) |
|
Выраженность фиброза (S), выводной отдел ПЖ, баллы, Me ( Q 1; Q 3) Fibrosis severity (S), right ventricular outflow department, points, Me ( Q 1; Q 3) |
1 (1; 1) |
Эффективность катетерного лечения: аблация была эффективна у 29 (72,5%) больных (отсутствие аритмии в течение 12 мес.), для КБА – у 5 (71,5%) обследуемых, для РЧА – у 11 (73,5%) пациентов (рис. 1). При этом ранние рецидивы наблюдались чаще после КБА в 2 (28,5%) случаях и у 5 (16,3%) больных – после РЧА.
Среди пациентов с наличием выявленного миокардита операция была эффективной у 8 (88,9%) больных без аритмии в течение 12 мес., без миокардита – у 6 (67,5%) обследуемых в течение 12 мес. наблюдения.
В дальнейшем вся выборка пациентов, у которых взята ЭМБ, была разделена на две группы. В первую вошли больные с рецидивом аритмии, во вторую – без рецидива. Выполнено сравнение двух этих групп между собой по некоторым признакам (табл. 3).
Таблица 3. Сравнение групп пациентов с рецидивом аритмии после аблации и без рецидива (пациенты, у которых взята эндомиокардиальная биопсия)
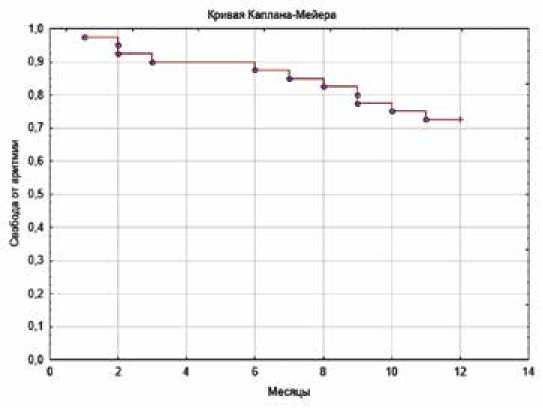
Table 3. Comparison of groups of patients with arrhythmia recurrence after ablation and without relapse (patients who are taken endomyocardial biopsy)
|
Показатели Index |
Есть рецидив, n = 7 Relapse, n = 7 |
Нет рецидива, n = 11 No relapse, n = 11 |
р |
|
Возраст, лет Age, years |
44,28 ± 9,65 |
48,63 ± 12,61 |
0,44 |
|
Индекс массы тела, кг/м2 Body mass index, kg/m2 |
30,88 ± 5,74 |
26,81 ± 2,27 |
0,04 |
|
Общий холестерин, ммоль/л Total cholesterol, mmol/L |
5,24 ± 1,16 |
4,56 ± 1,58 |
0,37 |
|
Триглицериды, ммоль/л Triglycerides, mmol/L |
0,68 ± 1,06 |
0,39 ± 0,72 |
0,51 |
|
Глюкоза, ммоль/л Glucose, mmol/L |
5,63 ± 0,40 |
5,53 ± 0,68 |
0,76 |
|
Креатинин, мкМ/л Creatinine, μmol/L |
75,05 ± 34,39 |
91,09 ± 11,00 |
0,16 |
|
ФВ (В), % EF, % |
48,28 ± 11,60 |
61,63 ± 12,61 |
0,03 |
|
ПЖ, мм RV, mm |
24,71 ± 2,56 |
22,45 ± 3,38 |
0,15 |
|
ЛП, мм LA, mm |
45,85 ± 4,74 |
41,18 ± 2,40 |
0,01 |
|
МЖП, мм IVS, mm |
9,92 ± 0,83 |
9,89 ± 1,02 |
0,93 |
|
ЗСЛЖ, мм PWLV, mm |
9,92 ± 0,60 |
9,54 ± 0,82 |
0,30 |
|
КСО, мл ESV, ml |
73,71 ± 32,10 |
44,36 ± 24,73 |
0,04 |
|
КДО, мл EDV, ml |
136,71 ± 34,56 |
108,81 ± 23,02 |
0,05 |
|
КДР, мм EDV, mm |
54,50 ± 5,33 |
50,27 ± 4,92 |
0,10 |
|
КСР, мм ESD, mm |
41,42 ± 7,87 |
34,09 ± 7,30 |
0,06 |
|
Время операции, мин Operation time, min |
80,66 ± 16,08 |
85,83 ± 16,25 |
0,59 |
|
Время рентгеноскопии, мин Fluoroscopy time, min |
7,16 ± 2,13 |
7,50 ± 1,76 |
0,77 |
Рис. 1. Динамика излечения от аритмии у пациентов с фибрилляцией предсердий после катетерного лечения Fig. 1. Dynamics of arrhythmia recovery in AF patients after catheter treatment
При анализе полученных данных выявлено, что в представленной выборке на успех интервенционной процедуры повлияли следующие факторы: индекс массы тела, размер ЛП и КСО. У пациентов с рецидивом аритмии эти показатели статистически значимо выше, чем у больных без рецидива. ФВ показала обратную корреляцию. Анализ ROC-кривых показал ФВ и КСО как зна- чимые предикторы успешной аблации с площадью под кривой 0,831 и 0,838, чувствительностью 100% в обоих случаях, специфичностью 72,7 и 63,6% соответственно (p = 0,01). Связанные пороговые значения предикторов: для ФВ менее 64%, для КСО более 35 мл (рис. 2).
Проанализированы эти факторы у больных с миокардитом и без. Данные представлены в таблице 4.
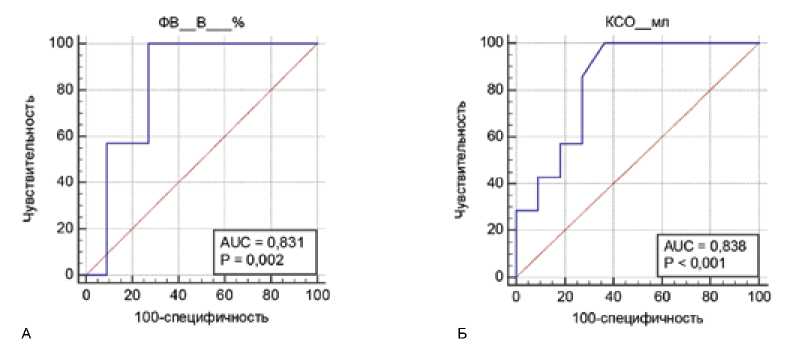
Рис. 2. А. ROC-анализ показателей фракции выброса (А) и конечного систолического объема (Б). AUC – площадь под кривой, p – уровень статистической значимости
Fig. 2. A. ROC analysis of ejection fraction (A) and end-systolic volume (Б). AUC – area under the curve, p – level of statistical significance
Таблица 4. Сравнение групп пациентов с наличием выявленного миокардита и без него Table 4. Comparison of patient groups with and without detected myocarditis
|
Показатели Index |
Есть миокардит, n = 9 Myocarditis, n = 9 |
Нет миокардита, n = 9 No myocarditis, n = 9 |
р |
|
Возраст, лет Age, years |
48,00 ± 13,48 |
45,88 ± 9,72 |
0,70 |
|
ИМТ, кг/м2 BMI, kg/m2 |
26,34 ± 2,00 |
30,45 ± 5,15 |
0,04 |
|
Общий холестерин, ммоль/л Total cholesterol, mmol/L |
4,85 ± 0,61 |
4,75 ± 2,09 |
0,88 |
|
Триглицериды, ммоль/л Triglycerides, mmol/L |
0,48 ± 0,78 |
0,51 ± 0,95 |
0,94 |
|
Глюкоза, ммоль/л Glucose, mmol/L |
5,41 ± 0,39 |
5,74 ± 0,74 |
0,27 |
|
Креатинин, мкМ/л Creatinine, μmol/L |
89,88 ± 11,55 |
80,41 ± 30,88 |
0,40 |
|
ФВ (В), % EF, % |
60,88 ± 13,71 |
52,00 ± 12,75 |
0,17 |
|
ПЖ, мм RV, mm |
23,55 ± 3,57 |
23,11 ± 3,018 |
0,77 |
|
ЛП, мм LA, mm |
41,00 ± 2,54 |
45,00 ± 4,50 |
0,03 |
|
МЖП, мм IVS, mm |
10,20 ± 0,92 |
9,61 ± 0,89 |
0,18 |
|
ЗСЛЖ, мм PWLV, mm |
9,77 ± 0,79 |
9,61 ± 0,74 |
0,65 |
|
КСО, мл ESV, ml |
44,22 ± 21,55 |
67,33 ± 35,12 |
0,11 |
|
КДО, мл EDV, ml |
107,88 ± 18,07 |
131,44 ± 36,54 |
0,10 |
|
КДР, мм EDV, mm |
50,66 ± 4,55 |
53,16 ± 6,07 |
0,33 |
|
КСР, мм ESD, mm |
34,55 ± 7,01 |
39,33 ± 8,93 |
0,22 |
|
Время операции, мин Operation time, min |
94,00 ± 11,40 |
75,57 ± 14,04 |
0,03 |
|
Время рентгеноскопии, мин Fluoroscopy time, min |
7,20 ± 2,28 |
7,42 ± 1,71 |
0,84 |
По результатам анализа этих данных выявлено, что у больных с диагностированным миокардитом оказались статистически значимо ниже показатели индекса массы тела и размера ЛП. Увеличение времени операции обусловлено проведением ЭМБ. Несмотря на достоверные различия в этих показателях, их связь с наличием и предрасположенностью к возникновению воспалительных изменений в миокарде довольно сомнительная.
В биоптатах, полученных при ЭМБ, у больных в исследуемой выборке выраженность фиброза составила в среднем 1 балл (при максимальном количестве в классификаторе 4 балла), с документированным наличием субэндокардиального фиброза и фиброэластоза эндокарда. При картировании всего у двух больных выявлены области со сниженным потенциалом по ЗСЛП (рис. 3).
А
Б
Проведены иммунногистохимические исследования полученных биоптатов. В результате этой работы выявлена экспрессия антигенов следующих вирусов: вирус герпеса 2-го типа в 5,5%, вирус герпеса 6-го типа – в 11,1%, энтеровирус – в 16,6% случаев, чаще всего встречалась совместная экспрессия вируса герпеса 6-го типа и энтеровируса – 61,1% случаев. Исследовались и другие антигены – аденовируса, парвовируса, вируса герпеса 1-го типа, цитомегаловируса, вируса Эпштейна-Барра, однако выявить их не удалось.
Обсуждение
Воспаление, возможно, является наиболее важным фактором, определяющим развитие фиброза c последующим развитием различных сердечных аритмий, в том числе и ФП. Ранее была установлена ассоциация фиброза предсердий (особенно ЛП) с развитием их фибрилляции и значимым увеличением концентрации предсердных натрийуретических пептидов в крови [7].
Патогенез фиброза миокарда – процесс довольно сложный, включающий в себя несколько этапов. На фоне вирусной инвазии за счет прямого и опосредованного ци-топатического действия происходит активация каскада провоспалительных цитокинов (ИЛ-6, ИЛ-8 и ИЛ-10), а также инфламмасом, которые представляют собой внутриклеточные белковые комплексы, активирующие передачу сигналов воспаления. Инфламмасомы формируются в ответ на обнаружение клетками широкого спектра сигналов, включая микробные агенты, сигналы опасности и раздражители окружающей среды, и служат первой линией защиты от патогенов [8, 9].
Активация инфламмасом (NOD-подобный пирин-до-мен-содержащий белок-3 (NLRP3)) может усиливать активность других воспалительных цитокинов, таких как ИЛ-6 и ФНО-α. Последний в свою очередь наряду с ИЛ-1R приводит к усиленной работе ядерного фактора (NF-κB), который является основным фактором транскрипции, контролирующим экспрессию многих воспалительных цитокинов. Доказано, что многие из перечисленных маркеров воспаления ассоциированы с развитием и прогрессированием ФП [10, 11].
В ответ на воспаление и повреждение кардиомиоцитов происходит стимуляция экспрессии таких факторов, как эндотелин-1, трансформирующий 1β-фактор роста (TGF-1β) и ангиотензин II. При этом семейство факторов роста фибробластов (FGF) играет в этом процессе ключевую роль, способствуя гипертрофии и фиброзу миокарда через стимуляцию митогенактивируемых протеинкиназ [11]. Повышение экспрессии различных провоспалитель-ных цитокинов и профибротических факторов приводит к активация сердечных фибробластов, что сопровождается приобретением ими экспрессии α-гладкомышечного актина и других контрактильных маркеров для частичного замещения сократительной функции кардиомиоцитов, а также повышением количества синтезируемых и выделяемых ими структурных (коллагены I, III и V типа, фибронектин, ламинины), ремоделирующих белков экстрацеллюлярного матрикса (матриксные металлопротеиназы). В дебюте гипоксии и хронической сердечной недостаточности подобные изменения имеют адаптивный характер, способствуя замещению сократительной способности и репарации структурной целостности сердца, но в конечном итоге они приводят к развитию патологического структурного и функционального ремоделирования камер сердца и аритмиям.
В ряде исследований, проведенных ранее, продемонстрировано, что эффективность катетерного лечения ФП снижается у больных с наличием активного миокардита и тем более снижается у больных с наличием выраженного фиброза миокарда [12, 13]. В нашей работе получены другие данные, однако накопленные на сегодняшний день знания о роли воспаления миокарда в аритмогенезе не позволяют установить причины данных результатов.
Одним из возможных вариантов объяснения является то, что пациенты с миокардитом более склонны к образованию рубцов. На фоне описанных выше изменений при воспалении «готовность» миокарда к фибро-генезу повышена, в миокарде есть все предпосылки для образования рубца. Учитывая, что суть методики аблации ЛВ заключается в создании рубцов в области устьев этих вен, возможно, эта повышенная «готовность» миокарда приводит к формированию более гомогенного и трансмурального рубца. Это в свою очередь приводит к более стойкой изоляции ЛВ и уменьшению риска электрической реконнекции предсердия и ЛВ. В исследовании мы не выявили значимого влияния фиброза на эффективность катетерного лечения. Это может быть связано с умеренной степенью фиброза в биоптатах, полученных при ЭМБ.
Выводы
Эффективность катетерного лечения ФП у пациентов с признаками миокардита составила 88,9%, что оказалось выше, чем у пациентов без признаков миокардита (67,5%). Показатели ФВ и КСО выступили как значимые предикторы успешной аблации в исследуемой выборке.
Список литературы Эффективность аблации фибрилляции предсердий при наличии хронического миокардита
- Киргизова М.А., Эшматов О.Р., Богданов Ю.И., Баталов Р.Е., Попов С.В. Антитромботическая терапия у пациентов с ишемической болезнью сердца и фибрилляцией предсердий после прямой реваскуляризации миокарда. Сибирский журнал клинической и экспериментальной медицины. 2020;35(4):49-56 https://doi.org/10.29001/2073-8552-2020-35-4-49-56.
- Арутюнов Г.П., Палеев Ф.Н., Моисеева О.М., Драгунов Д.О., Соколова А.В., Арутюнов А.Г. и др. Миокардиты у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(11):4790. https://doi.org/10.15829/1560-4071-2021-4790.
- Muslimova E., Rebrova T., Kondratieva D., Korepanov V., Sonduev E., Kozlov B. et al. Expression of the β1-adrenergic receptor (ADRB1) gene in the myocardium and β-adrenergic reactivity of the body in patients with a history of myocardium infraction. Gene. 2022;844:146820. https://doi.org/10.1016/j.gene.2022.146820.
- Basso C., Calabrese F., Angelini A., Carturan E., Thiene G. Classification and histological, immunohistochemical, and molecular diagnosis of inflammatory myocardial disease. Heart Fail. Rev. 2013;18(6):673-681. https://doi.org/10.1007/s10741-012-9355-6.
- Caforio A.L., Pankuweit S., Arbustini E., Basso C., Gimeno-Blanes J., Felix S.B. et al. European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur. Heart J. 2013;34(33):2636- 2648. https://doi.org/10.1093/eurheartj/eht210.
- Mitrofanova L.B., Orshanskaya V., Ho S.Y., Platonov P.G. Histological evidence of inflammatory reaction associated with fibrosis in the atrial and ventricular walls in a case-control study of patients with history of atrial fibrillation. Europace. 2016;18(Suppl. 4):iv156-iv162. https://doi.org/10.1093/europace/euw361.
- Ichiki T., Huntley B.K., Sangaralingham S.J., Harty G.J., Burnett J.C. Atrium fibrosis and inflammation: impaired atrial natriuretic peptide system in experimental heart failure. Circulation. 2014;130(Suppl. 2):A12651. https://doi.org/10.1161/circ.130.suppl_2.12651.
- Matsumori A. Management of atrial fibrillation using immunoglobulin free light chains, novel biomarkers of inflammation. Eur. Cardiol. 2022;17:e22. https://doi.org/10.15420/ecr.2022.30.
- Kugler S., Onodi Z., Ruppert M., Sayour A.A., Oláh A., Benke K. et al. Inflammasome activation in end-stage heart failure-associated atrial fibrillation. ESC Heart Fail. 2022;9:2747-2752. https://doi.org/10.1002/ehf2.13972.
- Li N., Brundel B.J.J.M. Inflammasomes and proteostasis novel molecular mechanisms associated with atrial fibrillation. Circ. Res. 2020;127:73- 90. https://doi.org/10.1161/CIRCRESAHA.119.316364.
- Weymann A., Popov A.F., Sabashnikov A., Ali-Hasan-Al-Saegh S., Ryazanov M., Tse G., Mirhosseini S.J. et al. Baseline and postoperative levels of C-reactive protein and interleukins as inflammatory predictors of atrial fibrillation following cardiac surgery: a systematic review and meta-analysis. Kardiol. Pol. 2018;76:440-451. https://doi.org/10.5603/KP.a2017.0242.
- Шелемехов А.Е., Баталов Р.Е., Роговская Ю.В., Усенков С., Арчаков Е., Гусакова А. и др. Клиническая эффективность катетерного лечения фибрилляции предсердий в зависимости от динамики гистологических изменений в миокарде по результатам эндомиокардиальной биопсии правого желудочка. Патология кровообращения и кардиохирургия. 2020;24(3):90-106. https://doi.org/10.21688/1681-34722020-3-90-106.
- Batalov R.E., Khlynin M.S., Rogovskaya Y.V., Sazonova S.I., Tatarskiy R.B., Anfinogenova N. et al. Isolated atrial fibrillation, inflammation and efficacy of radiofrequency ablation: Preliminary insights based on a single-center endomyocardial biopsy study. J. Clin. Med. 2023;12(4):1254. https://doi.org/10.3390/jcm12041254.


