Эффективность дексмедетомидина у пациентов с тяжелым течением COVID-19
Автор: Андрейченко Сергей Александрович, Бычинин Михаил Владимирович, Мандель Ирина Аркадьевна, Клыпа Татьяна Валерьевна
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.12, 2021 года.
Бесплатный доступ
Обоснование. Летальность у пациентов с тяжелым течением COVID-19 остается высокой. Поиск методов лечения, которые могут улучшить исход у таких пациентов, является актуальной задачей. Цель исследования - оценить клиническую эффективность дексмедетомидина в комплексном лечении пациентов с тяжелым течением COVID-19. Методы. В ретроспективное исследование включены 50 взрослых пациентов (n=29, группа лечения, седация дексмедетомидином; n=21, контрольная группа, седация пропофолом/мидазоламом) с тяжелым течением COVID-19, госпитализированных в отделение интенсивной терапии и реанимации (ОРИТ). Первичной конечной точкой исследования была частота развития делирия, вторичными - динамика показателей газообмена (PaO2 и PaCO2) и маркеров воспаления (С-реактивный белок; прокальцитонин; число лимфоцитов и нейтрофил-лимфоцитарное соотношение) на 3-и и 5-е сутки лечения, а также продолжительность искусственной вентиляции легких (ИВЛ), длительность госпитализации в ОРИТ и стационаре, летальность. Результаты. Частота делирия не различалась между группой лечения и контрольной группой (41 и 48% соответственно; p=0,661). Длительность пребывания в ОРИТ и стационаре, а также продолжительность ИВЛ были сопоставимы между группами. Тем не менее госпитальная летальность в группе лечения дексмедетомидином оказалась существенно ниже, чем в контрольной группе (10,3 и 42,9% соответственно; p=0,008). Добавление к комплексу терапии дексмедетомидина не повлияло на изменение газового состава крови, но сопровождалось повышением числа лимфоцитов (p=0,006) и снижением нейтрофил-лимфоцитарного соотношения (p=0,002) к 5-м суткам лечения. При этом значимых изменений уровней С-реактивного белка и прокальцитонина не наблюдалось. Заключение. В группе лечения летальность была статистически значимо меньше, чем в группе контроля. При этом использование дексмедетомидина не сопровождалось снижением частоты делирия, длительности пребывания в ОРИТ и в стационаре, продолжительности ИВЛ у пациентов с тяжелым течением COVID-19. Выявленная взаимосвязь применения дексмедетомидина с нейтрофил-лимфоцитарным соотношением и числом лимфоцитов позволяет предположить иммуноопосредованное влияние на исход болезни у этой категории пациентов. Необходимо проведение проспективных рандомизированных исследований для подтверждения положительного влияния дексмедетомидина на иммунную систему и летальность.
Covid-19, дексмедетомидин, делирий, иммунная система
Короткий адрес: https://sciup.org/143178089
IDR: 143178089 | DOI: 10.17816/clinpract88180
Текст научной статьи Эффективность дексмедетомидина у пациентов с тяжелым течением COVID-19
Одним из наиболее опасных и частых осложнений острого инфаркта миокарда является аневризма левого желудочка. С точки зрения патологической анатомии, постинфарктная аневризма левого желудочка (ПАЛЖ) представляет собой фиброзный рубец с характерной гладкой внутренней поверхностью без трабекулярного аппарата. Как правило, толщина стенки аневризматического образования значимо тоньше толщины нормального миокарда в данной зоне. Разделяют истинные и ложные ПАЛЖ: первые представляют собой выпячивание стенки левого желудочка с замещением миокардиальной ткани фиброзом и, соответственно, включают все слои; ложные аневризмы фактически являются разрывом стенки левого желудочка и ограничены окружающим перикардом [1, 2]. Классически определение ПАЛЖ подразумевало зону патологического диастолического контура левого желудочка с парадоксальной деформацией или систолической дискинезией, в настоящее время ее рассматривают как обширную зону левого желудочка с господствующей дискинезией или акинезией, которая приводит к значимому снижению фракции выброса левого желудочка [3, 4].
Наиболее распространенная локализация ПАЛЖ — переднеперегородочная область левого желудочка (до 90% случаев), что соответствует окклюзии передней нисходящей артерии. Гораздо реже встречаются ПАЛЖ по боковой и задней стенке левого желудочка (около 10% случаев), однако именно в этих позициях чаще всего встречаются ложные аневризмы [5, 6].
ИЗ ИСТОРИИ ИЗУЧЕНИЯ ПОСТИНФАРКТНОЙАНЕВРИЗМЫ ЛЕВОГО ЖЕЛУДОЧКА
Историю изучения ПАЛЖ можно условно разбить на 3 этапа: описательный, диагностический и хирургический. Описательный этап начался с 1740 г., когда I. Lancini впервые предложил термин «аневризма» левого желудочка сердца. J. Hunter и D. Galeati в 1757 г. выполнили первое анатомическое описание ПАЛЖ. В 1896 г. R. Marie отметил, что возникновению ПАЛЖ всег-
Лицензия CC BY-NC-ND 4 / The article can be used under the CC BY-NC-ND 4 license
A NEW CLASSIFICATION OF CHRONIC POSTINFARCTIONANEURYSMS OF THE LEFT VENTRICLE IN PATIENTSWITH CORONARY ARTERY DISEASE
A.V. Bocharov1, 2, L.V. Popov3, A.K. Mittsiev2, 4, M.D. Lagkuev2
-
1 Republican Clinical Hospital, Vladikavkaz, Russian Federation
-
2 Kostroma Regional Clinical Hospital named after Korolev E.I., Kostroma, Russian Federation
-
3 National Medical and Surgical Center named after N.I. Pirogov, Moscow, Russian Federation
-
4 North-Ossetian State Medical Academy, Vladikavkaz, Russian Federation
The article highlights the historical moments of how the concepts for the diagnosis and treatment of postinfarction aneurysms of the left ventricle were developed, and the possibilities of the main diagnostic methods. As a rule, patients with chronic postinfarction aneurysms of the left ventricle have severe damage to their coronary bed, requiring invasive correction (coronary artery stenting or coronary artery bypass grafting), which must be performed either before or during the intervention to eliminate the left ventricular aneurysm. A new classification of chronic postinfarction aneurysms of the left ventricle is proposed, which takes into account rather the type of myocardial blood supply and the severity of damage to the coronary bed, than the actual features of aneurysms. It determines the stages and tactics of treatment of patients with chronic postinfarction aneurysms of the left ventricle, focusing on the problem of coronary revascularization.
Submitted 15.09.2021 Revised 13.12.2021 Published 17.12.2021
да предшествует тромбоз коронарной артерии. В этом же году P. Remlinger впервые установил прижизненный диагноз аневризмы левого желудочка. Наиболее полно клиническую симптоматику при ПАЛЖ описал в 1926 г. русский терапевт Д.Д. Плетнев: «нарастающая сердечная недостаточность практически не поддающаяся медикаментозному лечению» [7]. В последующем были описаны 3 фазы возникновения аневризмы, а именно: острая окклюзия инфарктзависи-мой коронарной артерии в зоне возникновения аневризмы; ишемическая дегенерация миокарда; замещение миокардиальной ткани фиброзной и формирование аневризмы [8].
Диагностический этап изучения ПАЛЖ неразрывно связан с развитием медицинской техники — рентгенографии (F. Kraus, 1919), электрокардиографии (Д.М. Гротель, 1929), кардиовентрикулографии (E. Derra, 1959), а также эхокардиографии и мульти-спиральной компьютерной томографии.
Хирургический этап начался в 1912 г., когда ПАЛЖ впервые был прооперирован лигатурным методом [9]. C.S. Back в 1944 г. применил в качест- ве замещающей ткани при лечении ПАЛЖ фасцию [10]. Следующей важной вехой стала удачно выполненная в 1955 г. C.P. Baily и W. Likoff операция по резекции аневризмы левого желудочка без использования искусственного кровообращения при помощи специального зажима [11]. Через небольшой промежуток времени, в 1958 г., D.A. Cooley впервые успешно выполнил резекцию ПАЛЖ с применением искусственного кровообращения [12].
ДИАГНОСТИКА И ЛЕЧЕНИЕ
ПОСТИНФАРКТНОЙ АНЕВРИЗМЫ
ЛЕВОГО ЖЕЛУДОЧКА
В клинической картине у больных ПАЛЖ наиболее характерным симптомом является стенокардия, что объясняется прежде всего тяжелым поражением коронарного русла у данной категории пациентов [13]. Другой наиболее распространенный симптом — одышка, которая возникает при поражении более 20% миокарда и свидетельствует о достаточно тяжелой систолической и диастолической дисфункции [14]. Однако наиболее грозным симптомом ПАЛЖ являются нарушения ритма

предсердий и желудочков, а также эмболии тромботическими массами [15].
На современном этапе в первичной диагностике ПАЛЖ наиболее часто используются неинвазивные методы диагностики, такие как электро- и эхокардиография, мультиспиральная компьютерная томография. Прямая коронаровентрикулография остается золотым стандартом диагностики патологии, однако самостоятельно данная методика не применяется и выполняется как заключительный этап селективной коронарографии.
Самым доступным методом диагностики ПАЛЖ является электрокардиография, по результатам которой можно заподозрить наличие болезни, однако отсутствует возможность ее верификации. Для аневризмы левого желудочка характерен застывший подъем сегмента ST на электрокардиограмме.
Наиболее оптимальным и массовым методом неинвазивной визуализации аневризм левого желудочка является эхокардиография. Исследование позволяет не только подтвердить наличие ПАЛЖ, но и определить тяжесть систолической и диагностической дисфункции, наличие тромботических масс в аневризме, предикторы неблагоприятного исхода (конечный диастолический размер левого желудочка более 7,6 см; конечный систолический размер левого желудочка более 4,5 см; фракция выброса левого желудочка менее 35%; псевдонор-мальный и рестриктивный трансмитральный кровоток; выраженная митральная недостаточность; легочная гипертензия более 50 мм рт.ст.) [16, 17].
Основным методом лечения ПАЛЖ в настоящее время является хирургическое, цели ко- торого — уменьшение конечно-диастолического объема за счет удаления несокращающейся и парадоксально пульсирующей части левого желудочка [18, 19]; сопутствующая реваскуляризация миокарда [1, 20]; уменьшение нагрузки на сохранную часть миокардиальной ткани [21, 22]; уменьшение степени относительной митральной недостаточности вследствие уменьшения объема полости левого желудочка [5, 18]; устранение аритмических очагов в зоне рубца [23, 24].
КЛАССИФИКАЦИЯ ПОСТИНФАРКТНОЙ АНЕВРИЗМЫ ЛЕВОГО ЖЕЛУДОЧКА
В настоящее время хронические ПАЛЖ классифицируются в зависимости от анатомической локализации (переднезадние, переднелатеральные, задние), формы (диффузные, шарообразные, мешкообразные), морфологии (фиброзные и фибромышечные) [25]. Как правило, пациенты с хрони-
Таблица 1 / Table 1
Классификация постинфарктных аневризм левого желудочка у больных с поражением коронарного русла / Classification of postinfarction left ventricular aneurysms in patients with coronary artery disease
ческими ПАЛЖ имеют тяжелое поражение коронарного русла, что требует инвазивной коррекции (стентирование коронарных артерий или аортокоронарное шунтирование), которую необходимо провести либо до, либо во время вмешательства по устранению аневризмы левого желудочка. Необходимую информацию о состоянии коронарного русла позволяет получить коронароангиография, она же определяет и тип кровоснабжения миокарда.
Среди существующих классификаций ПАЛЖ отсутствует классификация, позволяющая определить совместно с данными других исследований (эхокардиография, сцинтиграфия и др.) оптимальную тактику хирургического лечения; учитывающая не только тяжесть поражения коронарного русла, но и тип кровоснабжения миокарда. Для восполнения существующего пробела предлагаем следующую классификацию ПАЛЖ у больных с поражением коронарного русла (табл. 1).
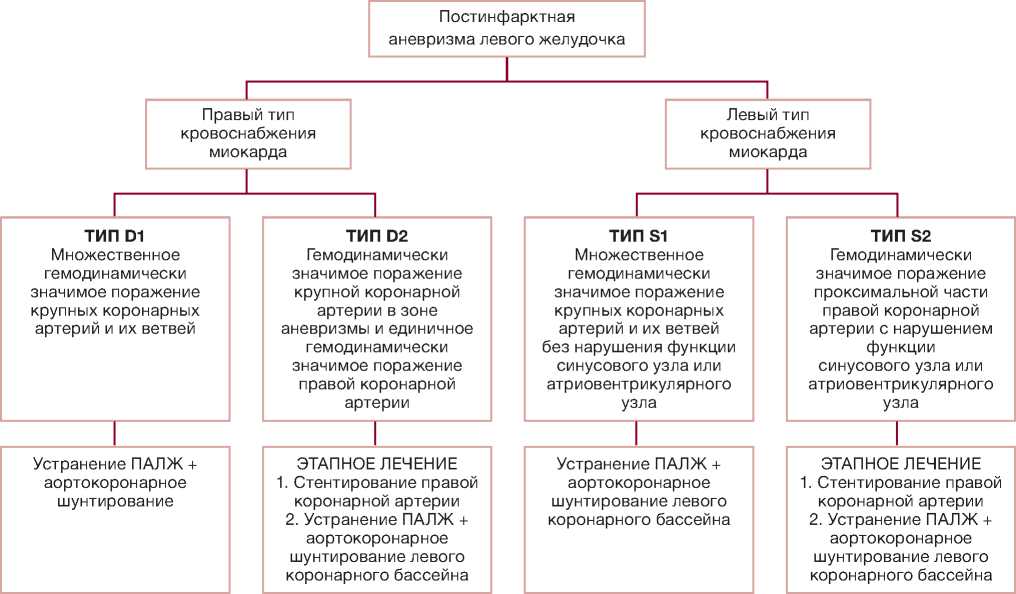
Tип D1 — ПАЛЖ и множественное гемодинамически значимое поражение крупных коронарных артерий и их ветвей при правом типе кровоснабжения миокарда. Типичная коронарографическая картина представлена на рис. 1.
Tип D2 — ПАЛЖ в сочетании с гемодинамически значимым поражением крупной коронарной артерии в зоне аневризмы и единичным гемодинамически значимым поражением правой коронарной артерии при правом типе кровоснабжения миокарда (рис. 2).
Тип S1 — ПАЛЖ и множественное гемодинамически значимое поражение крупных коронарных артерий и их ветвей без нарушения функции синусового узла или атриовентрикулярного узла при левом типе кровоснабжения миокарда (рис. 3).
Тип S2 — ПАЛЖ и гемодинамически значимое поражение проксимальной части правой коронарной артерии с нарушением ритма ишемического генеза при левом типе кровоснабжения миокарда (рис. 4).
Приведенная выше классификация ПАЛЖ не только удобна для применения в повседневной клинической практике, но и позволяет определить стратегию лечения рентгенэндоваскулярным хирургам, сердечно-сосудистым хирургам, врачам первичного звена и врачам-кардиологам.
ЗАКЛЮЧЕНИЕ
Таким образом, предложенная классификация постинфарктных аневризм левого желудочка с учетом типа кровоснабжения и характера поражения коронарного русла позволяет не только широко применять ее в повседневной практической
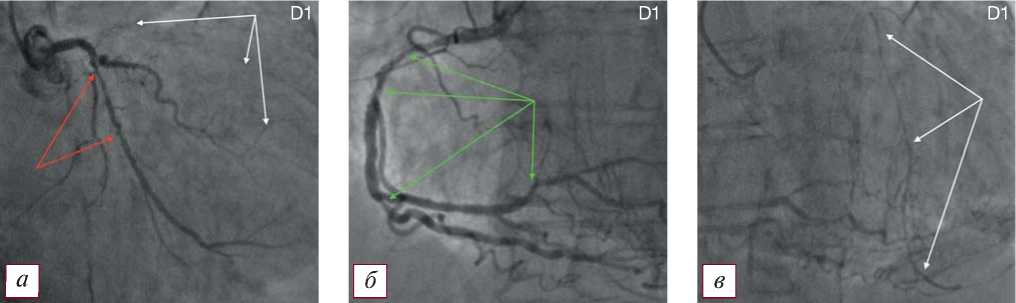
Рис. 1. Коронароангиографическая картина поражения коронарного русла и постинфарктной аневризмы левого желудочка по типу D1: а — коронароангиография левой венечной артерии (белые стрелки — русло передней нисходящей артерии, окклюзированное в проксимальной трети; красные стрелки — гемодинамически значимое поражение огибающей артерии, протяженные эшелонированные стенозы до 75% огибающей артерии); б — протяженные эшелонированные стенозы до 85% проксимальной и средней части правой коронарной артерии, а также ее ветвей (указаны зелеными стрелками); в — ретроградное заполнение дистальной и средней трети передней нисходящей артерии из бассейна правой коронарной артерии, коллатеральный кровоток Rentrop III (указано белыми стрелками).
Fig. 1. Coronary angiographic picture of lesions of the coronary bed and postinfarction aneurysm of the left ventricle according to type D1: a — coronary angiography of the left coronary artery (white arrows — the bed of the anterior descending artery occluded in the proximal third; red arrows — hemodynamically significant lesion of the envelope artery, extended echeloned stenoses up to 75% of the envelope artery); б — extended echeloned stenoses up to 85% of the proximal and middle parts of the right coronary artery, as well as its branches (indicated by green arrows); в — retrograde filling of the distal and middle third of the anterior descending artery from the basin of the right coronary artery, collateral blood flow Rentrop III (indicated by white arrows).

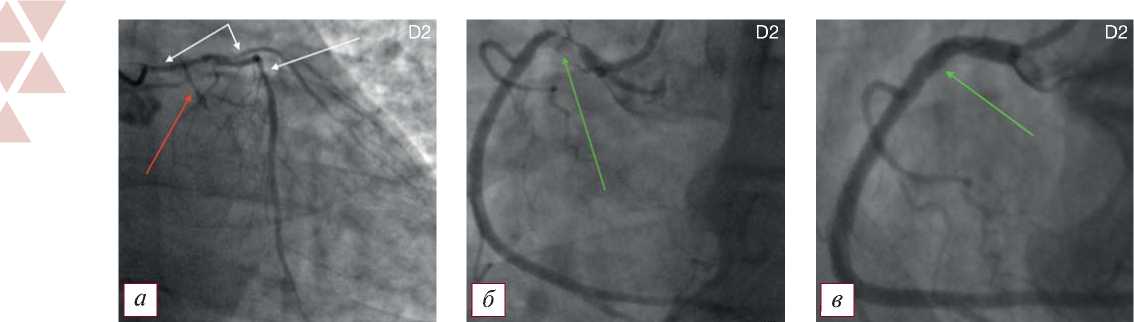
Рис. 2. Коронароангиографическая картина поражения коронарного русла и постинфарктной аневризмы левого желудочка по типу D2: а — гемодинамически значимый стеноз ствола левой коронарной артерии 70%, эшелонированные стенозы передней нисходящей артерии до 70%, субокклюзия устья 1-й диагональной ветви (указаны белыми стрелками); окклюзия проксимальной половины огибающей артерии (указана красной стрелкой); б — дискретная субокклюзия проксимальной трети правой коронарной артерии (указана зеленой стрелкой); в — правая коронарная артерия после выполнения первого этапа лечения — стентирования проксимальной трети (зона стентирования указана стрелкой).
Fig. 2. Coronary angiographic picture of the lesion of the coronary bed and postinfarction aneurysm of the left ventricle according to type D2: a — hemodynamically significant stenosis of the trunk of the left coronary artery 70%, echeloned stenosis of the anterior descending artery up to 70%, subocclusion of the mouth of the 1st diagonal branch (indicated by white arrows); occlusion of the proximal half of the envelope artery (indicated by red arrow); б — discrete subocclusion of the proximal third of the right coronary artery (indicated by the green arrow); в — the right coronary artery after performing the first stage of treatment — stenting of the proximal third (the stenting zone is indicated by an arrow).
Рис. 3. Коронароангиографическая картина поражения коронарного русла и постинфарктной аневризмы левого желудочка по типу S1: а — гемодинамически значимые стенозы проксимального и дистального отделов передней нисходящей артерии, проксимальной части 1-й диагональной артерии (указаны белыми стрелками), проксимальной половины огибающей артерии и ее ветвей (указаны красными стрелками); б — правая коронарная артерия.
Fig. 3. Coronary angiographic picture of the lesion of the coronary bed and postinfarction aneurysm of the left ventricle type S1: а — hemodynamically significant stenoses of the proximal and distal parts of the anterior descending artery, the proximal part of the 1st diagonal artery (indicated by white arrows), the proximal half of the envelope artery and its branches (indicated by red arrows); б — the right coronary artery.
деятельности, но и определять оптимальную стратегию лечения.
Несмотря на то, что представленная классификация касается в большей степени типа кровоснабжения миокарда и тяжести поражения коронарно- го русла, а не собственно особенностей аневризм, она определяет этапность и тактику лечения пациентов с постинфарктными аневризмами левого желудочка, ставя во главу угла проблему реваскуляризации коронарного русла.
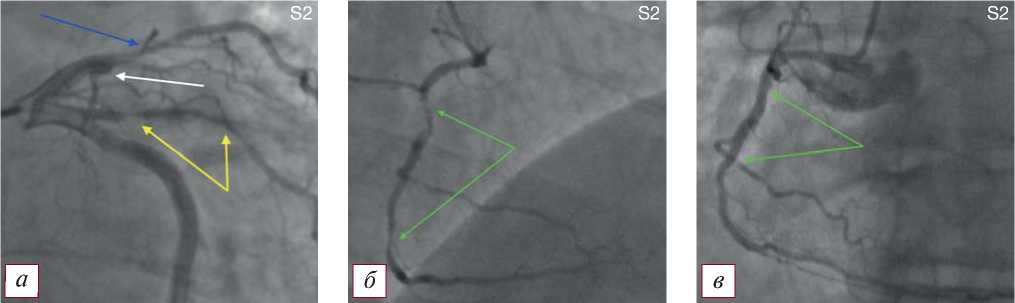
Рис. 4. Коронароангиографическая картина поражения коронарного русла и постинфарктной аневризмы левого желудочка по типу S2: а — окклюзия передней нисходящей артерии в проксимальной трети (белая стрелка), стеноз 1-й диагональной артерии в проксимальном сегменте 70% (синяя стрелка), субокклюзия интермедианной артерии в проксимальном сегменте (желтые стрелки); б — гемодинамически значимые стенозы на границе проксимальной и средней трети (90%), а также средней и дистальной трети (85%) правой коронарной артерии (зеленые стрелки); в — правая коронарная артерия после стентирования (зоны стентирования указаны зелеными стрелками).
Fig. 4. Coronary angiographic picture of the lesion of the coronary bed and postinfarction aneurysm of the left ventricle type S2: а — occlusion of the anterior descending artery in the proximal third (white arrow), stenosis of the 1st diagonal artery in the proximal segment 70% (blue arrow), subocclusion of the intermediate artery in the proximal segment (yellow arrows); б — hemodynamically significant stenoses at the border of the proximal and middle thirds ( 90%), as well as the middle and distal third (85%) of the right coronary artery (green arrows); в — the right coronary artery after stenting (stenting zones are indicated by green arrows).
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. А.В. Бочаров, Л.В. Попов, А.К. Митциев — концепция и дизайн; А.В. Бочаров, М.Д. Лагкуев, Л.В. Попов, А.К. Митциев — поисковоаналитическая работа, написание текста. Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Список литературы Эффективность дексмедетомидина у пациентов с тяжелым течением COVID-19
- Carley S, Horner D, Body R, Mackway-Jones K. Evidence-based medicine and COVID-19: what to believe and when to change. Emergency Med J. 2020;37(9):572-575. doi: 10.1136/emermed-2020-210098
- Pasin L, Landoni G, Nardelli P, et al. Dexmedetomidine reduces the risk of delirium, agitation and confusion in critically Ill patients: a meta-analysis of randomized controlled trials. J Cardiothorac Vasc Anesth. 2014;28(6):1459-1466. doi: 10.1053/j.jvca.2014.03.010
- Stockton J, Kyle-Sidell C. Dexmedetomidine and worsening hypoxemia in the setting of COVID-19: a case report. Am J Emerg Med. 2020;38(10):2247.e1-2247.e2. doi: 10.1016/j.ajem.2020.05.066
- Zhao H, Davies R, Ma D. Potential therapeutic value of dexmedetomidine in COVID-19 patients admitted to ICU. Br J Anaesth. 2021;126(1):e33-e35. doi: 10.1016/j.bja.2020.09.031
- Liu J, Shi K, Hong J, et al. Dexmedetomidine protects against acute kidney injury in patients with septic shock. Ann Palliat Med. 2020;9(2):224-230. doi: 10.21037/apm.2020.02.08
- Castillo RL, Ibacache M, Cortinez I, et al. Dexmedetomidine improves cardiovascular and ventilatory outcomes in critically ill patients: basic and clinical approaches. Front Pharmacol. 2020;10:1641. doi: 10.3389/fphar.2019.01641
- Klypa TV, Bychinin MV, Mandel IA, et al. Clinical characteristics of patients admitted to an ICU with COVID-19. Predictors of the severe disease. Journal of Clinical Practice. 2020; 11(2):6-20. doi: 10.17816/clinpract34182
- Izcovich A, Ragusa MA, Tortosa F, et al. Prognostic factors for severity and mortality in patients infected with COVID-19: a systematic review. PLoS One. 2020;15(11):e0241955. doi: 10.1371/journal.pone.0241955
- The WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) Working Group. Association Between Administration of Systemic Corticosteroids and Mortality Among Critically Ill Patients With COVID-19: A Meta-analysis. JAMA. 2020;324(13):1330-1341. doi: 10.1001/jama.2020.17023
- Flükiger J, Hollinger A, Speich B, et al. Dexmedetomidine in prevention and treatment of postoperative and intensive care unit delirium: a systematic review and meta-analysis. Ann Intensive Care. 2018;8(1):92. doi: 10.1186/s13613-018-0437-z
- Arumugam S, El-Menyar A, Al-Hassani A, et al. Delirium in the intensive care unit. J Emerg Trauma Shock. 2017;10(1):37-46. doi: 10.4103/0974-2700.199520
- Hughes CG, Mailloux PT, Devlin JW, et al. Dexmedetomidine or propofol for sedation in mechanically ventilated adults with sepsis. N Engl J Med. 2021;384(15):1424-1436. doi: 10.1056/NEJMoa2024922
- Bao N, Tang B. Organ-protective effects and the underlying mechanism of dexmedetomidine. Mediators Inflamm. 2020;2020: 6136105. doi: 10.1155/2020/6136105
- Cai J, Li H, Zhang C, et al. The neutrophil-to-lymphocyte ratio determines clinical efficacy of corticosteroid therapy in patients with COVID-19. Cell Metab. 2021;33(2):258-269.e3. doi: 10.1016/j.cmet.2021.01.002
- Magoon R. Dexmedetomidine in COVID-19: probing promises with prudence! Am J Emerg Med. 2020;46:708-709. doi: 10.1016/j.ajem.2020.10.034


