Эффективность филграстима в лечении цитостатических миелосупрессий у больных раком молочной железы
Автор: Хричкова Т.Ю., Гольдберг В.Е., Жданов В.В., Матяш М.Г., Высоцкая В.В., Симолина Е.И., Шаталова В.А., Попова Н.О., Мирошниченко Л.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (25), 2008 года.
Бесплатный доступ
Изучали гематологические эффекты препарата гранулоцитарного колониестимулирующего фактора - филграстима (нейпогена) при его включении в химиотерапию больных раком молочной железы III-IV стадии по схеме адриабластин + таксотер. Проведенные исследования продемонстрировали стимуляцию подавленного цитостатиками костномозгового гранулоцитопоэза под действием нейпогена на уровне коммитированных предшественников, морфологически дифференцируемых элементов костного мозга и периферической крови.
Рак молочной железы, химиотерапия, миелосупрессия, филграстим (нейпоген)
Короткий адрес: https://sciup.org/14056739
IDR: 14056739 | УДК: 618.19-006.6+615.28+616.155.344
Текст научной статьи Эффективность филграстима в лечении цитостатических миелосупрессий у больных раком молочной железы
Многочисленные клинические исследования продемонстрировали высокую эффективность доцетаксела в комбинации с антрациклинами в лечении диссеминированного рака молочной железы (РМЖ), что, по мнению ряда авторов, позволяет считать вышеназванную комбинацию новым стандартом химиотерапии распространенных форм РМЖ [4, 10]. Частым осложнением при использовании как доцетаксела, так и доксорубицина является угнетение костномозгового кроветворения, в большей степени гранулоцитарного ростка, что проявляется, соответственно, развитием лейкопении с преимущественным снижением в периферической крови количества нейтрофильных гранулоцитов. Анализ данных, полученных многочисленными исследователями, подтверждает факт развития нейтропении III–IV степени у 85–100 % больных, а фебрильной нейтропении – у 30–40 % пациентов, подвергнутых цитостатической терапии в указанном режиме [8]. Учитывая несомненную клиническую значимость последствий миелосупрессии, назначение филграстима как гемостимулирующего средства довольно часто оказывается необходимым и оправданным [9, 11].
В связи с изложенным целью настоящей работы явилось изучение эффективности фил- грастима в качестве корректора нарушений, возникающих в системе крови у больных раком молочной железы (РМЖ) III–IV стадии при проведении противоопухолевой химиотерапии по схеме доксорубицин + доцетаксел, и вскрытие механизмов, лежащих в основе гемостимулирующего эффекта препарата.
Материал и методы
В исследование включены результаты изучения системы крови 77 больных раком молочной железы III–IV стадии в возрасте от 35 до 55 лет. Все пациентки получали противоопухолевую полихимиотерапию, включающую внутривенное введение 50 мг/м2 доксорубицина (адриа-бластина) в 1-й день и 75 мг/м2 доцетаксела (таксотера) – во 2-й день. Длительность цикла составляла два дня, интервал между курсами – 3 нед. Показатели системы крови оценивали на протяжении 3 курсов химиотерапии. Наряду с указанным лечением, 30 больных в перерывах между курсами специального лечения получали филграстим (нейпоген) подкожно в дозе 300 мкг двукратно на 8-й и 12-й день от последнего введения таксотера [11]. Больные, не получавшие нейпогена в процессе химиотерапии, составили контрольную группу.
Материал для исследования (капиллярную и венозную кровь) забирали до и после каждого цикла цитостатического лечения. Проведение преднизолоновых проб и стернальных пункций было запланировано до начала специального лечения, а также перед II и III курсами химиотерапии. Определение показателей периферической крови (гемоглобин, эритроциты, лейкоциты, лейкоцитарная формула, тромбоциты) и дифференциальный подсчет миело-грамм в стернальных пунктатах производили стандартными гематологическими методами [3]. Колониеобразующую способность костного мозга и периферической крови определяли путем клонирования клеток – предшественников грануломоноцитопоэза (КОЕ-ГМ) и эритропоэза (КОЕ-Э) в полувязкой питательной среде на основе метилцеллюлозы [2].
Для оценки костномозгового резерва нейтрофильных гранулоцитов использовали преднизолоновую пробу [6]. Преднизолон (фирма «Гедеон Рихтер», Венгрия) вводили внутривен- но в дозе 60 мг. Общее количество лейкоцитов (ОКЛ) и содержание сегментоядерных форм нейтрофилов определяли до, а также через 2, 3, 4, 5 и 6 ч после введения препарата. Результат пробы оценивали по величине выброса нейтрофильных гранулоцитов в процентах от исходного уровня, отмечали величину максимального выброса нейтрофилов в процентах и абсолютных числах.
Статистическую обработку полученных данных проводили методом вариационной статистики с использованием t-критерия Стьюдента.
Результаты и обсуждение
Проведенные исследования показали, что общее количество лейкоцитов у обследованных пациентов закономерно уменьшилось (на 49,1 % от исходного) уже после I курса химиотерапии (рис. 1А). Развившаяся лейкопения была обусловлена преимущественно снижением абсолютного числа сегментоядерных нейтрофилов (рис. 1Б). К началу второго курса лечения ОКЛ в группе пациентов, получавших нейпоген, оказалось достоверно выше как исходного уровня, так и значений данного показателя в контрольной группе (на 2,44 Г/л), благодаря увеличению содержания в периферической крови сегментоядерных форм нейтрофильных гранулоцитов (рис. 1А, Б).
После 2-го курса химиотерапии также был зафиксирован достоверно более высокий уровень лейкоцитов в периферической крови больных, леченных нейпогеном, за счет не только сегментоядерных нейтрофилов, но также лимфоцитов и моноцитов. В динамике дальнейшего лечения, после второго курса введения препарата-корректора, уровни ОКЛ и их сегментоядерных форм в периферической крови больных, получавших инъекции гемопоэтина, статистически значимо превышали аналогичные показатели в контрольной группе (рис. 1А, Б). В то же время препарат гранулоцитарного колониестимулирующего фактора практически не оказывал влияния на содержание в периферической крови больных РМЖ эритроцитов, гемоглобина и тромбоцитов в процессе химиотерапии.
Анализ стернальных пунктатов выявил увеличение содержания незрелых нейтрофильных
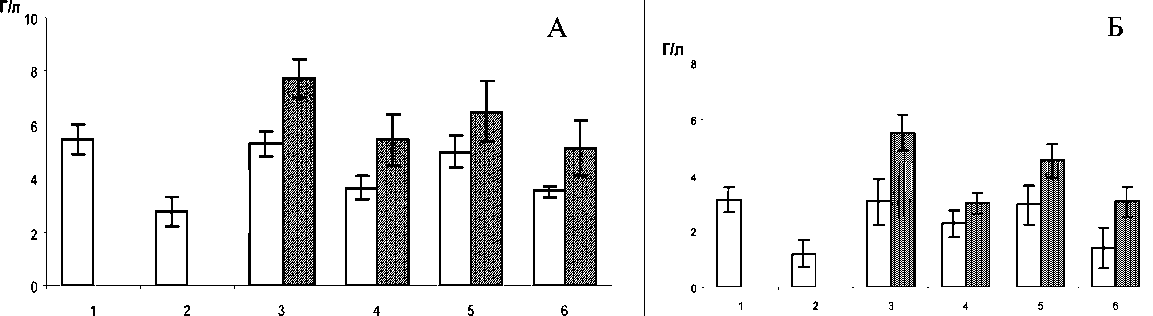

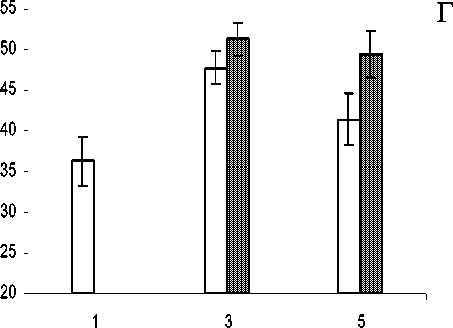
Рис. 1. Изменения общего количества лейкоцитов (А), сегментоядерных нейтрофилов (Б) в периферической крови, незрелых (В) и зрелых форм нейтрофильных гранулоцитов (Г) в костном мозге у больных РМЖ в динамике противоопухолевой химиотерапии по схеме адриабластин + таксотер ( z ) и адриабластин + таксотер + нейпоген ( ). По оси абсцисс – сроки исследования (1 – до лечения, 2 – после 1-го курса, 3 – перед 2-м курсом, 4 – после 2-го курса, 5 – перед 3-м курсом, 6 – после 3-го курса), по оси ординат – значения показателя; доверительные интервалы при р<0,05
гранулоцитов (миелобласты, промиелоциты, миелоциты, метамиелоциты) в кроветворной ткани больных РМЖ после введения нейпогена к началу второго курса химиотерапии на 14,3 % (p<0,05) по сравнению с таковым в контрольной группе (рис. 1В). При этом наблюдалось достоверное увеличение количества зрелых нейтрофильных гранулоцитов как перед вторым (на 7,4 %), так и перед третьим (на 19,4 %) курсами специального лечения (рис. 1Г). Это обстоятельство, возможно, обусловлено отсутствием значительных повреждений комбинацией адриабластина с таксотером способных к митозу предшественников гранулоцитопоэза, что создает основу для активации в костном мозге регенераторных процессов под влиянием гемостимулятора на ранних этапах цитостатической болезни [1]. В то же время со стороны эритроидного ростка костномозгового кроветворения отмечалась депрессия числа незрелых и зрелых эритрокариоцитов (в среднем в 1,45 раза), по сравнению с группой контроля, что, вероятно, связано со смещением баланса процессов кроветворения в сторону гранулоцито-поэза под влиянием нейпогена.
Определение колониеобразующей способности костного мозга подтвердило высказанные предположения, продемонстрировав достоверное увеличение содержания к началу второго и третьего курсов полихимиотерапии в комбинации с нейпогеном числа КОЕ-ГМ на 14 % и 56,6 % соответственно в сравнении с контрольной группой, что свидетельствует об активации процессов пролиферации гемопоэтических прекурсоров под влиянием препарата цитокина. В то же время в группе больных, не
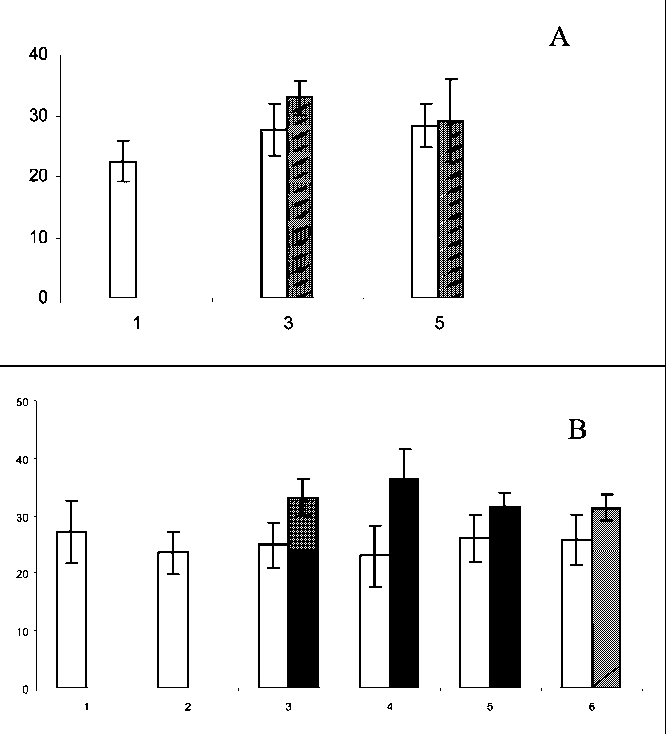
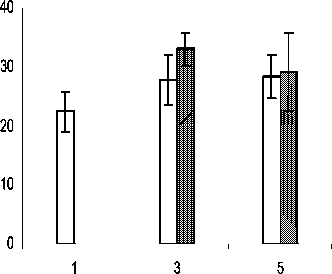
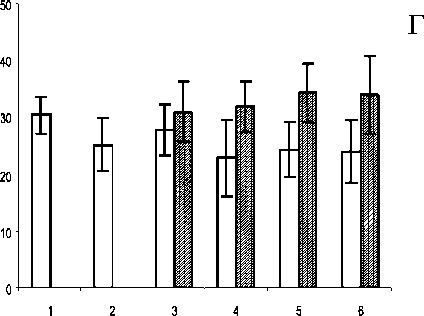
Рис. 2. Количество КОЕ-ГМ (А) и КОЕ-Э (Б) в костном мозге, а также КОЕ-ГМ (В) и КОЕ-Э (Г) в периферической крови больных раком молочной железы в динамике противоопухолевой химиотерапии с использованием режимов адриабластин + таксотер ( z ), либо адриабластин + таксотер + нейпоген ( ■ ). По оси абсцисс – сроки исследования (1 – до лечения, 2 – после 1-го курса, 3 – перед 2-м курсом, 4 – после 2-го курса, 5 – перед 3-м курсом, 6 – после 3-го курса), по оси ординат – значения показателя; доверительные интервалы при р<0,05
получавших препарата-корректора, значения вышеназванных показателей достоверно превышали исходный уровень лишь перед вторым курсом специального лечения (рис. 2А). Что касается клеток-предшественников эритропоэза, то, несмотря на некоторую тенденцию к росту числа КОЕ-Э в исследуемой группе по сравнению с контрольной, изменения оказались недостоверными (рис. 2Б).
Динамике возрастания числа гранулоцитомакрофагальных клеток-предшественников в костном мозге под влиянием нейпогена соответствовали изменения их количества в периферической крови, что проявлялось достоверным ростом (с максимумом после второго курса в 1,6 раза) числа циркулирующих КОЕ-ГМ во все сроки исследования в сравнении с контрольной группой (рис. 2В). Подобная тенденция имела место и в отделе циркулирующих клеток-пред- шественников эритропоэза – число КОЕ-Э в периферической крови больных, леченных нейпогеном, в среднем в 1,4 раза превышало аналогичный показатель в контрольной группе практически во все сроки наблюдения. Приведенные факты могут быть обусловлены, наряду с усилением пролиферативной активности коммитированных предшественников в костном мозге, перераспределительными реакциями в системе крови под действием нейпогена, поскольку обнаруженные изменения соответствуют картине мобилизации кроветворных прекурсоров из костного мозга в периферическую кровь. Как известно, мобилизирующий эффект препарата гранулоцитарного колониестимулирующего фактора достаточно широко используется в клинической практике с целью сбора CD34+ клеток для последующей аутологичной трансплантации [7].
Таблица
Прирост содержания нейтрофилов (Г/л) и их максимальный выброс в периферическуюкровь в ответ на введение преднизолона в процессе химиотерапии РМЖ (X¯±m)
|
Показатели |
Cроки исследования |
||||
|
До лечения |
Перед 2-м курсом |
Перед 3-м курсом |
|||
|
Динамика реакции (ч) |
До введения |
2,21 ±0,38 |
А |
3,10 ± 0,33 |
3,19 ± 0,38 |
|
Б |
3,40 ± 0,63 |
3,79 ± 0,58* |
|||
|
2-й |
3,88 ± 0,63 |
А |
5,93 ± 0,72* |
6,38 ± 0,71* |
|
|
Б |
9,76 ± 1,09*# |
8,55 ± 0,51*# |
|||
|
3-й |
4,27 ± 0,75 |
А |
6,23 ± 0,67 |
7,06 ± 0,78* |
|
|
Б |
9,23 ± 0,74*# |
9,65 ± 0,41*# |
|||
|
4-й |
4,51 ± 0,72 |
А |
6,57 ± 0,90 |
7,15 ± 0,92* |
|
|
Б |
8,70 ± 0,44*# |
9,41 ± 0,55*# |
|||
|
5-й |
4,22 ± 0,65 |
А |
7,88 ± 1,29* |
6,88 ± 0,82* |
|
|
Б |
8,16 ± 0,54* |
9,54 ± 0,96*# |
|||
|
6-й |
3,80 ± 0,70 |
А |
7,05 ± 1,03* |
6,42 ± 0,58* |
|
|
Б |
7,53 ± 0,48* |
8,73 ± 0,89*# |
|||
|
Максимальный выброс |
Г/л |
2,53 ± 0,43 |
А |
4,66 ± 0,84* |
5,42 ± 0,60* |
|
Б |
6,79 ± 0,53*# |
6,89 ± 0,35*# |
|||
|
% |
116,80 ± 17,06 |
А |
136,60 ± 23,15 |
181,50 ± 21,55* |
|
|
Б |
225,01 ± 29,04*# |
196,58 ± 24,22* |
|||
Примечание: А – режим адриабластин + таксотер; Б – режим адриабластин + таксотер + нейпоген; * – отличия от значения показателя до лечения достоверны (р<0,05); # – отличия между группами достоверны (р<0,05).
Одной из наиболее важных функциональных особенностей нейтрофилов костномозгового пула является их способность выходить в большом количестве в циркуляцию в ответ на введение глюкокортикоидов [6]. При введении преднизолона больным РМЖ нами было выявлено преходящее повышение числа нейтрофилов в периферической крови, что свидетельствует о наличии типичной реакции на гормональный препарат. При сравнительном анализе реакции на преднизолон костномозгового пула нейтрофильных гранулоцитов было установлено, что выраженность ее значительно возрастает (как перед 2-м, так и перед 3-м курсами химиотерапии) при использовании схемы адриабластин + таксотер в комбинации с нейпогеном по сравнению не только с исходными показателями (в 2–2,5 раза), но и с «чистой» схемой (в 1,4–1,5 раза). При этом достоверно выше в 1,5 раза перед вторым и в 1,3 раза – перед третьим курсами химиотерапии в комбинации с нейпогеном оказалась и величина максимального выброса нейтрофилов в ответ на введение преднизолона по сравнению с аналогичными показателями у больных, леченных по схеме адриабластин + таксотер без включения препарата-корректора (таблица).
Обсуждая возможные механизмы данного феномена, следует иметь в виду, что Г-КСФ стимулирует выработку ряда протеаз фермен- тативными системами нейтрофилов, ослабляющих связь клеток с внеклеточным матриксом, с одной стороны, а с другой – способствует наработке ростовых факторов, увеличивающих проницаемость эндотелия кровеносных сосудов костного мозга [5]. Кроме того, фактом, играющим немаловажную роль в усилении реакции на преднизолон на фоне включения нейпогена в программу цитостатического лечения, является накопление в костном мозге под влиянием гемопоэтина зрелых элементов гранулоцитарного ряда.
Таким образом, применение нейпогена на фоне химиотерапии по схеме адриабластин + таксотер приводит к возрастанию ОКЛ, подавленного цитостатическими препаратами, причем в большей степени за счет увеличения числа их сегментоядерных форм. В основе указанных изменений лежит стимуляция гранулоцитопоэза в костном мозге, обусловленная повышением активности морфологически дифференцируемых клеток и коммитированных предшественников. Кроме того, введение нейпогена приводит к усилению выхода в периферическую кровь гемопоэтических прекурсоров различных классов, возрастанию реакции костномозговых нейтрофилов на гормональный препарат и увеличению их пула.


