Эффективность функциональных ингредиентов пребиотического действия в коррекции микробиоты человека
Автор: Кретова Ю.И., Зурочка В.А., Иванова Д.А.
Рубрика: Питание и здоровье
Статья в выпуске: 2 т.12, 2024 года.
Бесплатный доступ
Резкое увеличение техногенной и антропогенной нагрузки на окружающую среду в последнее время обусловило снижение устойчивости организма человека к различным заболеваниям. Многие заболевания, а также патологические состояния человека сопровождаются, как правило, нарушением нормального микробиоценоза кишечника и нежелательными изменениями состава и количественного соотношения микроорганизмов, находящихся в кишечнике. По мнению ученых, причиной такого нарушения является следствие влияния различных неблагоприятных факторов, в том числе вызванных на фоне стресса. Признаваемое негативное следствие стресса ставит задачу разработки эффективных профилактических, терапевтических и реабилитационных методов работы с повседневным и, особенно, с разрушительным стрессом и его последствиями. Многочисленные исследования в области коррекции микробиоты человека показывают, что применение пребиотических компонентов способствует улучшению работы пищеварительной системы, росту собственной микрофлоры кишечника, повышению иммунитета, улучшению усвоения кальция и снижению уровня холестерина в крови. Целью настоящего исследования являлась оценка эффективности применения пребиотических компонентов на основе фруктополисахаридов (инулина) в компенсации нарушений микробиоты желудочно-кишечного тракта, вызванных различными факторами, в том числе на фоне стресса. В исследовании принимали участие добровольцы, часть из которых подвергались единичному стрессовому воздействию, после которого часть добровольцев употребляли пищевую добавку пребиотического действия. В ходе данного исследования нами была установлена эффективность биологически активной добавки пребиотического действия, содержащего инулин (волокна цикория) в качестве стимулятора роста бифидобактерий у практически здоровых лиц, а также для профилактики и устранения нарушений микробиоценоза, связанных с адаптацией организма к стрессу. Данный протеиновый продукт можно применять не только как профилактическое и корригирующее дисбиотические нарушения средство во время проведения функциональной пищевой терапии и после нее, но и рекомендовать использовать его для коррекции микробиоты человека.
Пребиотики, фруктополисахариды, инулин, нарушение микробиоты, дисбиотические проявления, стресс
Короткий адрес: https://sciup.org/147243930
IDR: 147243930 | УДК: 664.649 | DOI: 10.14529/food240209
Текст научной статьи Эффективность функциональных ингредиентов пребиотического действия в коррекции микробиоты человека
В последнее время резкое увеличение техногенной и антропогенной нагрузки на окружающую среду обусловило снижение устойчивости организма человека к различным заболеваниям. Многие заболевания, а также патологические состояния человека сопровождаются, как правило, нарушением нормального микробиоценоза кишечника [1– 3]. В результате этого процесса происходят нежелательные изменения состава и количественного соотношения микроорганизмов, находящихся в кишечнике. По мнению ученых, причиной нарушения микробиоценоза является следствие влияния на него различных неблагоприятных факторов, в том числе вызванных на фоне стресса [4, 5].
В современном мире стресс является неотъемлемой частью повседневной жизни человека и имеет различную природу. При этом важно отметить, что стрессогенным эффектом обладают как положительные, так и отрицательные по своей психологической оценке события, либо воздействия со стороны среды. Стрессовое воздействие осуществляется как на весь организм, психику и личность человека, так и на его отдельные органы и системы, а также населяющий его микробиом [6–8].
Принимая во внимание, что организм человека достаточно обильно заселен микроорганизмами, численность которых составляет 1013–15 особей, а их видовой состав приближается к численности до 1000 различных видов, важно помнить, что микробиом человека иг- рает важную роль в поддержании нашего здоровья [8–12].
Кроме того, микробиота кишечника является не только источником иммунитета, но и выполняет множество важных для организма функций, включая защитную, метаболическую, детоксикационную, а также участвует в молекулярно-генетических процессах, регуляции перистальтики кишечника и других (рис. 1) [9], тем самым способствуя снижению провоспалительного ответа, минимизируя риск развития негативных состояний или воспалительных заболеваний кишечника [13].
Поддержание количественного и структурного состава микрофлоры, а также ее функциональной активности в различных отделах пищеварительного тракта является актуальной задачей.
С учетом широкой распространенности неблагоприятных факторов, оказывающих негативное влияние на организм и состояние микрофлоры, остро стоит вопрос коррекции и профилактики нарушений микробиозеноза кишечника.
Поддержание количественного и структурного состава микрофлоры, а также ее функциональной активности в различных отделах пищеварительного тракта является актуальной задачей.
С учетом широкой распространенности неблагоприятных факторов, оказывающих негативное влияние на организм и состояние микрофлоры, остро стоит вопрос коррекции и профилактики нарушений микробиозеноза кишечника.
В качестве одного из эффективных способов профилактики стресса может рассматриваться функционально-пищевая терапия при условии, что для этих целей используются специально разрабатываемые имеющие лечебный эффект ремедиумы (от лат. Remedium – средство от чего-либо, лекарство) – в частном случае – продукты питания, имеющие в своем составе «антистрессовые» компоненты [14–17]. Такого рода компоненты непосредственно могут противостоять стрессу и индуцируемым им процессам путем, например, непосредственного вмешательства в физиологические, биохимические, эндокринные и тому подобные процессы, «запускающиеся» вследствие стрессового воздействия.
При этом следует отметить, что у некоторых представителей этого класса ремедиумов наблюдается высокая стресс-протекторная и, в силу этого, высокая адаптогенная (улучшающая адаптацию) эффективность.
На сегодняшний день спектр средств, используемых для восстановления микробиоти-
МЕТАБОЛИЧЕСКАЯ (участие в биосинтезе витаминов В1, В2, В3, В5, В6, В12, К, аминокислот, короткоцепочечных жирных кислот)
ИММУННАЯ (участие в синтезе интерферонов, иммуноглобулина А, развитие лимфоидного аппарата кишечника)

РЕГУЛЯТОРНАЯ (регуляция работы иммунной, эндокринной, нервной систем)
ПИЩЕВАРИТЕЛЬНАЯ (участие в расщеплении пищевых волокон, в обмене желчных кислот и синтезе ферментов)
ДЕЗИНТОКСИКАЦИОННАЯ (инактивация ксенобиотиков и лекарственных препаратов)
Рис. 1. Функции кишечной микробиоты человека [9]
ческого гомеостаза, включает в себя две большие группы препаратов - пробиотики и пребиотики. Результаты научных исследований разных ученых [18-24] показали, что своевременное их применение способно привести к уменьшению риска развития воспалительных процессов в кишечнике, профилактике или коррекции различных заболеваний, так или иначе связанных с нарушением микрофлоры.
Наиболее известные в настоящее время пребиотики - лактулоза и пектин - уже давно применяются в клинической практике. В то же время существуют и менее популярные в настоящее время во всем мире пребиотики растительного происхождения, например, фруктополисахариды (инулин) и фруктоолигосахариды (олигофруктоза), которые показали свою эффективность [25-31].
Целью настоящего исследования являлась оценка влияния пищевой добавки пребиоти-ческого действия (ПП), содержащего инулин, в качестве стимулятора роста бифидобактерий у здоровых людей, принимающих участие в качестве испытуемых-добровольцев.
Материалы и методы
Условия в процессе исследования:
-
- соблюдение всех этических норм и принципов;
-
- исключение приема антибиотиков, а также других про- и пребиотических препаратов у испытуемых-добровольцев на период исследования.
Исследуемые группы:
-
1) экспериментальная группа: добровольцы, которые подверглись единичному стрессовому воздействию; причем часть добровольцев в процессе исследования после стресса употребляли пищевую добавку пре-биотического действия (ПП) (группа А), а часть добровольцев в процессе исследования после стресса не употребляли пищевую добавку (группа Б);
-
2) контрольная группа (обозначена буквой «В»): добровольцы, которые не подверглись единичному стрессовому воздействию и не употребляли ПП.
Возраст добровольцев - 20-21 год.
В исследовании принимали участие 24 добровольца (20 девушек и 4 юноши), из них 15 (3 юноши и 12 девушек) участников подверглись единичному стрессовому воздействию (экспериментальная группа).
Этапы исследования:
-
1) этап «0» - исследование микробиоты у добровольцев на начало исследования;
-
2) этап «1» - исследование микробиоты через 14 дней у добровольцев, не подвергавшихся стрессу, и микробиоты у добровольцев после стресса;
-
3) этап «2» - исследование микробиоты у добровольцев после стресса и исследование микробиоты у добровольцев после стресса, употребляющих в течение 30 дней пищевую добавку на основе волокон цикория.
Критерии оценки эффективности употребления пищевой добавки на основе волокон цикория:
-
- динамика состава кишечной микробиоты;
-
- динамика состава оральной микробиоты.
Методы исследования:
-
- стандартный бактериологический метод исследования состава кишечной микробиоты;
-
- стандартный бактериологический метод исследования состава оральной микробиоты.
Результаты исследования и их обсуждение
На начальном этапе нашего исследования под наблюдением находились испытуемые преимущественно в возрасте старше 20 лет, которые приняли участие на основе добровольно высказанного согласия.
Для проведения анализа данных, полученных в ходе бактериологического исследования, использовали нормативные значения показателей для исследуемой возрастной группы (табл. 1).
Дальнейшее описание результатов по всем исследуемым группам будет представлено относительно общепринятых нормативных показателей для возрастной группы на основе принятых критериев.
Критерии, которые использовали при анализе экспериментальных данных:
-
1) «положительное воздействие» - повышение бифидобактерий, лактобактерий и кишечной палочки с нормальными свойствами (лактозопозитивной палочки), энтерококков меньше или равно нормативным показателям;
-
2) «отрицательное воздействие» - выявление лактозонегативных и гемолитических кишечных палочек и рост их количества, выявление клебсиелл и других энтеробактерий, увеличение количества энтерококков выше нормы, появление стафилококков, увеличение количества дрожжеподобных грибов, сниже-
- Таблица 1
Нормативные показатели для возрастной группы людей, принимающих участие в исследовании
Данные критерии оценивались на разных этапах эксперимента (рис. 2). При сравнительном анализе групп между собой на определённых этапах исследовали изменения кишечной облигатной и факультативной микрофлоры. Также оценивалось положительное и отрицательное воздействие на кишечную микрофлору как стресса, так и приема пищевой добавки.
На начальном этапе исследования (до стресса – этап «0») и через 14 дней после начала эксперимента (после без стресса – этап «1») нами был установлен микробиотический статус добровольцев, входящих в контрольную группу.
Результаты, полученные в ходе лабораторных исследований, показали, что все испытуемые-добровольцы на момент проведения исследования были здоровы и не имели хронических заболеваний. Контрольная группа соответствовала общепринятым (общероссийским) нормативным показателям для данной возрастной группы, за исключением от- сутствия лактобактерий у 44 % обследуемых, относительного снижения количества бифидобактерий у испытуемых (в среднем 33,3 %) и незначительного отклонения в составе факультативной флоры у испытуемых (в среднем 12 %), что характерно для населения Челябинской области (согласно региональным нормативам), проживающего в промышленном регионе с постоянным воздействием экотоксикантов.
Результаты анализа показателей оральной микрофлоры в контрольной группе добровольцев (табл. 2) показывают, что у контрольной группы в ротовой полости отмечается увеличение числа патогенных стафилококков, что свидетельствует о выраженном носительстве данных микроорганизмов и увеличении их концентрации в исследуемой группе.
Далее экспериментальная группа добровольцев подвергалась воздействию заданного фактора стресса. После воздействия устанавливали микробиотический потрет добровольцев. В табл. 3 представлены результаты анализа кишечной микрофлоры групп добровольцев до стресса (этап «0») и после (этап «1»).
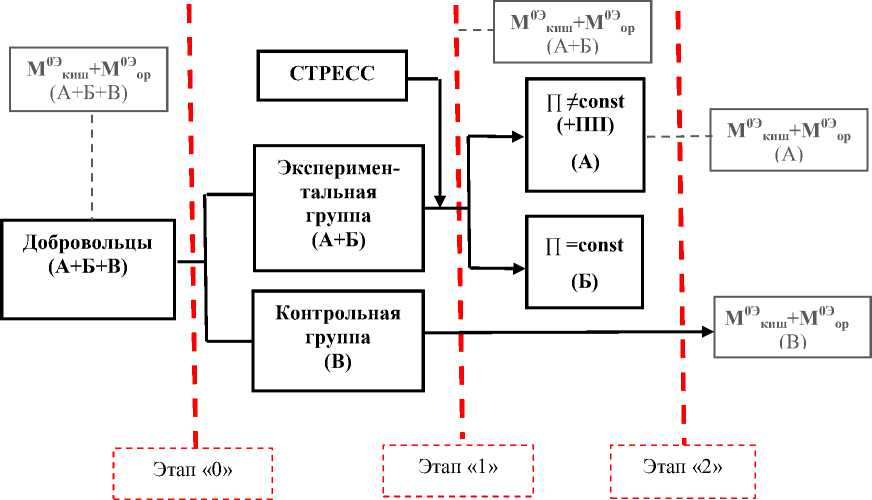
М0Эор: Микробиота оральная (патогенная, условно-патогенная, нормальная флора)
М0Экиш: Микробиота кишечная
∏: Введение пищевой добавки (ПП) в рацион добровольцев
Рис. 2. Условная схема экспериментального исследования
Анализируя данные, представленные в табл. 3, и сравнивая значения кишечной микрофлоры на разных этапах у обследуемых в экспериментальных группах (А и Б) и объединенной контрольной группе В, мы видим отрицательное воздействие стресса на состав облигатной микрофлоры: отмечено снижение общего количества выявляемых бифидобактерий с 16,6 до 26,5 % обследуемых, а также уменьшение абсолютного количества лактобактерий у обследуемых с 29,15 до 20 %, при этом количество энтерококков, наоборот, увеличилось с 8 до 21 % у обследуемых. Также значительные изменения наблюдались и в со- ставе факультативной флоры (увеличилось абсолютное количество кишечной палочки гемолитической с 4,15 до 21 % обследуемых, клебсиеллы с 20,75 до 27 % обследуемых) на фоне изменения состава других условнопатогенных энтеробактерий без изменения процентного соотношения и снижения концентрации Candida albicans.
Вместе с тем мы видим и положительное воздействие в отношении неферментирующих бактерий и патогенных энтеробактерий – в виде снижения их концентрации, что говорит о системном стресс-воздействии на все виды микроорганизмов, то есть стресс привел к
Таблица 2
Результаты анализа оральной микрофлоры (ОМ) контрольной группы добровольцев
|
Показатели оральной микрофлоры (ОМ) |
Значения показателей ОМ (КОЕ) у испытуемых (%), относящихся к контрольной группе на разных этапах исследования |
|||
|
этап «0» |
этап «1» |
|||
|
Выявленные патогены |
Не обнаружено |
80 |
Не обнаружено |
40 |
|
Обнаружено Staphylococcus aureus 105 |
20 |
Обнаружено Staphylococcus aureus 104/105 |
20/40 |
|
Таблица 3
Результаты анализа кишечной микрофлоры (КМ) групп добровольцев до и после стресса по показателям, значения которых критически превышают норму (в таблице ячейки выделены серым цветом)
Следующий этап исследования предполагает изменения в пищевом поведении добровольцев путем включения в рацион питания пищевой пребиотической добавки. Экспериментальная группа добровольцев (А) в течение 30 дней принимала пищевую пребиотиче-скую добавку на основе волокон цикория.
Результаты исследования кишечной микрофлоры (КМ) экспериментальной группы А после употребления пищевой добавки и после стресса представлены в табл. 4.
Анализируя полученные данные кишечной микрофлоры, были отмечено, что прием пищевой добавки оказал положительное воздействие и привел к увеличению количественного и качественного состава облигатной микрофлоры у обследуемых после перенесенного стресса.
Для установления влияния пищевого воздействия на организм человека необходимо проанализировать, насколько прием пищевой добавки компенсировал воздействие стресса на обследуемых. Для этого мы сравнили группу А на этапе «0» до получения стресса и после приема пищевой добавки (табл. 5).
Анализ полученных данных кишечной микрофлоры у экспериментальной группы А до получения стресса и после приема пищевой добавки показал следующие изменения: в составе облигатной микрофлоры отмечено увеличение общего количества выявляемых бифидобактерий у 20 % обследуемых от исходных показателей, при этом увеличилось и абсолютное их количество, отдельно было отмечено значительное увеличение как абсолютного количества лактобактерий, так и процентного соотношения с 20 до 80 % обследуемых, на фоне 10 % снижения количества энтерококков. Это говорит в целом о положительном воздействии и нормализации количества облигатной микрофлоры.
Таким образом, в результате исследований получили следующие выводы:
-
- стресс оказывал отрицательное воздействие и приводил к снижению количественного и качественного состава облигатной микрофлоры у обследуемых после перенесенного стресса (наблюдали снижение общего количе-
- Таблица 4
Результаты анализа кишечной микрофлоры экспериментальной группы А после употребления пищевой добавки и после стресса по показателям, значения которых критически превышают норму (в таблице ячейки выделены серым цветом)
|
Показатели кишечной микрофлоры (КМ) |
Значения показателей КМ (КОЕ) у испытуемых (%), входящих в группу А на определенных этапах исследования |
|||
|
после стресса |
после пищевой добавки |
|||
|
Бифидобактерии |
Не обнаружены 107 |
20 |
Не обнаружены 107 |
10 |
|
Лактобактерии |
Не обнаружены 105 |
80 |
Не обнаружены 105 |
20 |
Таблица 5
Результаты анализа кишечной микрофлоры (КМ) экспериментальной группы А до стресса и после употребления пищевой добавки по показателям, значения которых критически превышают норму (в таблице ячейки выделены серым цветом)
-
- было зафиксировано и положительное воздействие стресса в отношении неферментирующих бактерий и патогенных энтеробактерий в виде снижения их концентрации, что говорит о системном воздействии на все виды микроорганизмов, то есть стресс привел к снижению не только нормальной микрофлоры, но и частично патогенной, но не условнопатогенной флоры;
-
- прием пищевой добавки оказывал положительное воздействие на количественный и качественный состав как облигатной, так и факультативной микрофлоры у обследуемых после перенесенного стресса;
-
- прием пищевой добавки приводил к улучшению большинства показателей в сторону нормализации количества содержания микрофлоры до общепринятых нормативных показателей для данной возрастной группы у обследуемых до получения ими стресса.
Заключение
Можно констатировать высокую эффективность биологически активной добавки пребиотического действия путем включения ее в рацион питания, поскольку данные, полученные в ходе анализа оральной и кишечной микробиоты, свидетельствуют о тенденции к восстановлению (в ряде случаев – нормализации) качественного состава микроорганизмов, восстановлению баланса анаэробных популяций микрофлоры и нормализации окислительно-восстановительного потенциала внутрипросветной кишечной среды. Данная пищевая добавка обладает высокой эффективностью в качестве стимулятора роста бифидобактерий у практически здоровых лиц как с измененным составом кишечной микрофлоры, так и без него.
Данный протеиновый продукт можно назначать в качестве профилактического и корригирующего дисбиотические нарушения средства как во время проведения антибактериальной терапии, так и после нее. Продукт, содержащий инулин, устраняет явления ки- шечной диспепсии (урчание, метеоризм), опосредованно приводит к устранению болевого синдрома и восстановлению двигательной активности кишечника, характеризуется хорошей переносимостью и отсутствием побочных эффектов. Все это позволяет рекомендо- вать использовать его с целью стимуляции роста бифидобактерий у практически здоровых лиц, а также для профилактики и устранения нарушений микробиоценоза, связанных с адаптацией организма к стрессу.
Список литературы Эффективность функциональных ингредиентов пребиотического действия в коррекции микробиоты человека
- Ивашкин В.Т., Шелыгин Ю.А., Баранская Е.К. и др. Синдром раздраженного кишечника // Колопроктология. 2022. Т. 21, № 1. С. 10-25. DOI: 10.33878/2073-7556-2022-21-1-10-25
- Яковенко Э.П., Иванов А.Н., Казарина А.В. и др. Нарушение нормального состава кишечных бактерий: клиническое значение и вопросы терапии // РМЖ. Болезни органов пищеварения. 2008. Т. 10, № 2. С. 41-46.
- Маев И.В., Бордин Д.С., Еремина Е.Ю. и др. Синдром раздраженного кишечника. Современные аспекты эпидемиологии, патогенеза и лечения (обзор) // Экспериментальная и клиническая гастроэнтерология. 2018. № 10. С. 68-73. DOI: 10.31146/1682-8658-ecg-158-10-68-73
- Комарова О.Н., Хавкин А.И. Взаимосвязь стресса, иммунитета и кишечной микробиоты // Педиатрическая фармакология. 2020. Т. 17(1). С. 18-24. DOI: 10.15690/pf.v17i1.2078.
- Lutgendorff F., Akkermans L.M., Soderholm J.D. The role of microbiota and probiotics in stress-induced gastroinstetinal damage // Current Molecular Medicine. 2008. Vol. 8. Р. 282-298. DOI: 10.2174/156652408784533779
- Devaraj S. The human gut microbiome and body metabolism: implications for obesity and diabetes // Clinical Chemistry. 2013. Vol. 59. P. 617-628. DOI: 10.1373/clinchem.2012.187617.
- Sebra J.J. Influences of microbiota on intestinal immune system development // The American Journal of Clinical Nutrition. 1999. Vol. 69. Р. 1046-1051. DOI: 10.1093/ajcn/69.5.1046s
- Diaz Heijtz R., Wang S., Anuar F. Normal gut microbiota modulates brain development and behavior // Proceedings of the National Academy of Sciences. 2011. Vol. 108. Р. 3047-3052. DOI: 10.1073/pnas.1010529108
- Харитонова Л. А., Григорьев К. И., Борзакова С. Н. Микробиота человека: как новая научная парадигма меняет медицинскую практику // Экспериментальная и клиническая гастроэнтерология. 2019. № 161(1). С. 55-63. DOI: 10.31146/1682-8658-ecg-161-1-55-63.
- Чаплин А.В., Ребриков Д.В., Болдырева М.Н. Микробиом человека // Вестник РГМУ. 2017. № 2. С. 5-13.
- Хайтович А.Б., Воеводкина А.Ю. Микробиом и его влияние на здоровье человека // Крымский журнал экспериментальной и клинической медицины. 2019. Т. 9. № 1. С. 61-70.
- Юдин С.М., Егорова А.М., Макаров В.В. Анализ микробиоты человека. Российский и зарубежный опыт // Международный журнал прикладных и фундаментальных исследований. 2018. № 11(1). С. 175-180. URL: https:// applied-research.ru/ru/article/view?id=12472
- ^stic A., Xavier R., Gevers D. The microbiome in infl ammatory bowel disease: current status and the future ahead // Gastroenterology. 2014. Vol. 146(6). Р. 1489-1499. DOI: 10.1053/j.gastro.2014.02.009
- Bosscher D., Breynaert A., Pieters L. Food based strategies to modulate the composition of the intestinal microbiota and their associated health effects // Journal of physiology and pharmacology: an official journal of the Polish Physiological Society. 2009. Vol. 60. Р. 5-11.
- Kau A.L., Ahern P.P., Griffin N.W. et al. Human nutrition, the gut microbiome and the immune system // Nature. 2011. Vol. 474 (7351). Р. 327-336. DOI: 10.1038/nature10213
- Cummings J.H., Macfarlane G.T. Gastrointestinal effects of prebiotics // British Journal of Nutrition. 2002. Vol. 87(2). Р. 145-151. DOI: 10.1079/BJNBJN/2002530
- Gibson G.R., Probert H.M., Van Loo J., Rastall R.A., Roberfroid M.B. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics // Nutrition research reviews. 2004. Vol. 17(2). Р.259-275. DOI: 10.1079/NRR200479
- Hatakka K., Saxelin M. Probiotics in intestinal and non-intestinal infectious diseases-clinical evidence // Current Pharmaceutical Design. 2008. Vol. 14. Р. 1351-1367. DOI: 10.2174/138161208784480162
- Langlands S.J., Hopkins M.J., Coleman N., Cummings J.H. Prebiotic arbohydrates modify the mucosa associated microflora of the human large bowel // Gut. 2004. Vol. 53. Р. 1610-1616. DOI: 10.1136/gut.2003.037580
- Shanahan F. Probiotics in inflammotory bowel disease // Gut. 2001. Vol. 48 (5). Р. 609. DOI: 10.1097/00054725-200005000-00007
- Boirivant M., Strober W. The mechanism of action of probiotics // Current Opinion in Gastroenterology. 2007. Vol. 23. Р. 679-692. DOI: 10.1097/MOG.0b013e3282f0cffc
- Дроздов В.Н., Ших Е.В., Астаповский А.А. и др. Клиническая эффективность современного пробиотика для коррекции кишечной микрофлоры у пациентов с синдромом раздраженного кишечника с диареей и c антибиотик-ассоциированной диареей // Вопросы питания. 2023. Т. 92. № 4. C. 92-103. DOI: 10.33029/0042-8833-2023-92-4-92-103
- Тарасенко Н.А., Филиппова Е.В. Кратко о пребиотиках: история, классификация, получение, применение // Фундаментальные исследования. 2014. № 6(1). С. 45-48.
- Saavedra J.M., Tschernia A. Human studies with prebiotics: clinical implications // British Journal of Nutrition. 2002. Vol. 87. Р. 241-246. DOI: 10.1079/BJNBJN/2002543
- Abrams S.A., Hawthorne K.M., Aliuo, Hicks P.D., Chen Z., Griffin I.J. An inulin-type fructan enhances calcium absorption primarily via an effect on colonic absorption in humans // Journal of Nutrition. 2007. Vol. 137. Р. 2208-2212. DOI: 10.1093/jn/137.10.2208
- Beylot M. Effects of inulin-type fructans on lipid metabolism in man and in animal models // British Journal of Nutrition. 2005. Vol. 93. Р.163-168. DOI: 10.1079/bjn20041339
- Holloway L., Moynihan S., Abrams S.A., Kent K., Hsua R., Friedlandera L. Effects of oligofructose-enriched inulin on intestinal absorption of calcium and magnesium and bone turnover markers in postmenopausal women // The British journal of nutrition. 2007. Vol. 97. Р. 365-372. DOI: 10.1017/S000711450733674X
- Letexier D., Diraison F., Beylot M. Addition of inulin to a moderately highcarbohydrate diet reduces hepatic lipogenesis and plasma triacylglycerol concentrations in humans // American Journal of Clinical Nutrition. 2003. Vol. 77. Р. 559-564. DOI: 10.1093/ajcn/77.3.559
- Roberfroid M.B. Concepts in functional foods: The case of inulin and oligofructose // The Journal of nutrition. 2007. Vol. 137. Р. 2709-2716. DOI: 10.1093/jn/129.7.1398S
- Tahiri M., Tressolj C., Arnaud J. et al. Five-week intake of short-chain fructo-oligosaccharides increases intestinal absorption and status of magnesium in postmenopausal women // Journal of Bone and Mineral Research. Res. 2001. Vol. 16. Р. 2152-2160. DOI: 10.1359/jbmr.2001.16.11.2152
- Tuohyk M., Finlayr K., Wynne A.G., Gibson G.R. A human volunteer study on the prebiotic effects of HP-inulin - faecal bacteria enumerated using fluorescent in situ hybridisation (FISH) // Anaerobe. 2001. Vol. 7. Р. 113-118. DOI: 10.1006/anae.2001.0368


