Эффективность использования бусульфана для элиминации примордиальных зародышевых клеток в гонадах у эмбрионов кур
Автор: Ветох А.Н., Волкова Н.А., Томгорова Е.К., Волкова Л.А., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Репродуктивные технологии
Статья в выпуске: 6 т.52, 2017 года.
Бесплатный доступ
Использование примордиальных зародышевых клеток для получения генетически модифицированной и химерной сельскохозяйственной птицы - одно из перспективных направлений биотехнологии, которое рассматривается как альтернатива традиционным методам селекции и модификации генома. Получение трансгенных и химерных особей с использованием этой технологии предусматривает введение донорских примордиальных зародышевых клеток в дорсальную аорту эмбрионов-реципиентов в период миграции из крови в гонады. В случае колонизации донорскими зародышевыми клетками гонад эмбрионов-реципиентов возможна их дальнейшая дифференцировка до зрелых мужских и женских половых клеток. Один из основных факторов, определяющих эффективность проводимых манипуляций, - результативность элиминации собственных примордиальных зародышевых клеток у эмбрионов-реципиентов. В этой связи остается актуальной разработка приемов по удалению такого типа клеток. Целью наших исследований стала оптимизация методических подходов по элиминации примордиальных зародышевых клеток в гонадах у эмбрионов кур породы Первомайская. В качестве алкилирующего агента использовали бусульфан в дозах 10, 40, 70, 100, 150, 200 и 250 мкг/эмбрион. Для разведения бусульфана применяли диметилсульфоксид (ДМСО), а также его сочетание со средой DМЕМ в различных соотношениях. Введение бусульфана в эмбрионы осуществляли двумя способами: через прокол в скорлупе в тупом конце яйца до закладки яиц на инкубацию и посредством нанесения раствора препарата на зародышевый диск через окно в скорлупе в тупом конце яйца на 24-й ч инкубации. Эффективность элиминации примордиальных зародышевых клеток в гонадах оценивали на 7-е сут инкубации на основании гистологических исследований с использованием иммуногистохимич на экспрессию гена SSEA-1 (stage-specific embryonic antigen-1). Установлено, что результативность элиминации примордиальных зародышевых клеток определяется способом подготовки и введения бусульфана в эмбрионы, а также дозой препарата. Показано снижение негативного действия на развитие эмбрионов кур ДМСО, используемого для разведения бусульфана, при включении в состав раствора препарата среды DМЕМ в концентрации 10 %. Высокая эффективность элиминации примордиальных зародышевых клеток установлена при использовании бусульфана в концентрации 100 мкг/эмбрион: снижение числа зародышевых клеток в гонадах достигало 92 % по сравнению с контролем. Использование бусульфана в большей концентрации приводило к повышению эмбриональной смертности. При этом более высокую результативность элиминации примордиальных зародышевых клеток отмечали при введении бусульфана на 24-й час инкубации эмбрионов: количество зародышевых клеток в гонадах у 7-суточных эмбрионов кур было на 12,5 % меньше по сравнению с аналогичным показателем, установленным при инъекции препарата перед началом инкубации.
Примордиальные зародышевые клетки, куры, эмбрионы, бусульфан
Короткий адрес: https://sciup.org/142214098
IDR: 142214098 | УДК: 636.52/.58:636.082:57.085.23 | DOI: 10.15389/agrobiology.2017.6.1194rus
Текст научной статьи Эффективность использования бусульфана для элиминации примордиальных зародышевых клеток в гонадах у эмбрионов кур
Получение трансгенных (1-3) и химерных (4-6) особей посредством трансплантация донорских примордиальных зародышевых клеток рассматривается в качестве альтернативы традиционным методам селекции и модификации генома. Ввиду особенностей воспроизводства и развития сельскохозяйственной птицы использование этой технологии открывает новые возможности для направленной модификации генома (7-9) и воссоздания ценных пород и линий, сохраняемых в условиях криобанков (10-12).
Первичные зародышевые клетки (ПКЗ) служат предшественниками половых клеток. В процессе эмбриогенеза они дифференцируются в мужские и женские половые клетки, что значительно расширяет возможности реализации их потенциала при создании трансгенных и химерных особей с заданными свойствами. У эмбрионов кур примордиальные зародышевые клетки образуются в эпибласте и мигрируют через гипобласт в кровь, затем в гонады (13). В связи с этим при введении донорских ПЗК в дорсальную аорту эм-
∗ Работа выполнена при финансовой поддержке гранта РНФ ¹ 16-16-10059.
брионов-реципиентов в период миграции собственных ПЗК из крови в гонады возможна колонизация гонад реципиентов донорскими клетками (14-15).
Эффективность трансплантации донорских ПЗК может быть повышена посредством предварительной подготовки эмбрионов-реципиентов, направленной на элиминацию собственных зародышевых клеток в гонадах. Существует несколько методов удаления эндогенных зародышевых клеток у разных видов позвоночных: у -облучение, рентгеновское облучение (16-18), химическая стерилизация (19). В последнем случае используют препарат бусульфан. Он представляет собой алкилирующий агент, вызывающий повреждение ДНК в клетках-мишенях, что приводит к выключению всех клеточных механизмов и разрушению клеток. В экспериментах на лабораторных и сельскохозяйственных животных показано избирательное действие бусульфана на половые клетки самцов (20-22).
В настоящем исследовании изучена эффективность использования бусульфана для элиминации примордиальных зародышевых клеток в гонадах у эмбрионов кур. Впервые оценена результативность элиминации примордиальных зародышевых клеток при различных способах подготовки инъекционного раствора бусульфана, его введения в эмбрионы кур и при разной концентрации препарата.
Цель работы заключалась в оптимизации методических подходов по элиминации примордиальных зародышевых клеток в гонадах у эмбрионов кур при использовании бусульфана в рамках разработки отдельных этапов технологии получения трансгенных особей с заданными свойствами.
Методика. Объектом исследований служили эмбрионы кур породы Первомайская. Для удаления эндогенных примордиальных зародышевых клеток использовали раствор бусульфана в диметилсульфоксиде (ДМСО) и питательной среде DMEM (минимальная среда Игла в модификации Дюль-беко) («Invitrogen», США). Полученные растворы стерилизовали, пропуская через фильтр с диаметром пор 22 мкм. Перед введением бусульфана яйца обрабатывали 70 % спиртом. Последующие манипуляции с эмбрионами проводили в асептических условиях (в ламинарном боксе). Введение бу-сульфана в количестве 10 мкг/эмбрион осуществляли двумя способами: через прокол в скорлупе в тупом конце яйца до закладки яиц на инкубацию или посредством нанесения раствора препарата на зародышевый диск через окно в скорлупе в тупом конце яйца на 24-й ч инкубации. Объем вводимого препарата в первом случае составлял 100 мкл, во втором — 50 мкл. Яйца инкубировали (Rcom Maru 190 Deluxe, «Rcom», Корея) при соблюдении стандартных для куриных яиц условий (температура 37,5 ° С, влажность 55 %). При определении дозы бусульфана, оптимальной для эффективной элиминации примордиальных зародышевых клеток, изучали их наличие в гонадах при введении бусульфана в количестве 40, 70, 100, 150, 200 и 250 мкг/эмбрион.
Эффективность препарата оценивали на основании гистологических исследований гонад эмбрионов. В качестве контроля использовали эмбрионы, не обработанные бусульфаном. Отбор эмбрионов осуществляли на 7-е сут инкубации. Фиксацию материала проводили в растворе Буэна (пикриновая кислота:уксусная кислота:формалин в соотношении 15:1:5) в течение 48 ч. Гистологические препараты готовили по общепринятой методике, включающей дегидратацию ткани в спиртах возрастающей концентрации, пропитку в смеси ксилол-парафин и заключение в парафин (23). Препараты окрашивали гематоксилином и эозином. Для анализа использовали поперечные срезы эмбрионов в области расположения гонад (поясничная область, место локализации первичных почек). Гистологический анализ осуществляли на микроскопе Ni-U («Nikon», Япония), обработ- ку и анализ изображений — с применением пакета программ NIS-Elements («Nikon», Япония). ПЗК на гистологических срезах идентифицировали иммуногистохимически с применением авидин-биотиновой системы («Vector Laboratories», США) (21). Первыми антителами служили анти-SSEA-1 (stage-specific embryonic antigen-1). Комплекс антиген-антитело идентифицировали с помощью пероксидазы хрена, для выявления которой использовали 3,3-диаминобензидин-тетрахлорат (ДАБ) («Vector Laboratories», США).
Статистическую обработку данных проводили с помощью методов вариационной статистики в MS Excel. В таблицах представлены средние значения ( X ) и ошибки средних (± х ).
Результаты. Перед введением бусульфана в эмбрионы кур был оптимизирован состав среды для разведения препарата. Бусульфан разводят в диметилсульфоксиде (ДМСО); при использовании водных растворов бу-сульфан может частично выпадать в осадок. В связи с тем, что ДМСО токсичен для клеток, мы изучили влияние раствора бусульфана, полученного на основе ДМСО и среды DМЕМ в различных соотношениях, на развитие эмбрионов и эффективность элиминации примордиальных зародышевых клеток (табл. 1).
1. Развитие эмбрионов кур породы Первомайская и эффективность элиминации примордиальных зародышевых клеток в зависимости от состава и способа введения раствора бусульфана ( Х ± х )
|
Состав инъекционного раствора |
Обработано эмбрионов, n |
Развилось эмбрионов до 7-х сут инкубации, n (%) |
Исследовано гонад, n |
Диаметр гонад, мкм |
Число ПЗК в гонадах (ги-стологический срез), n |
|
Введение бусульфана до на |
ч ал а и нку б ац ии я и ц (100 мкл/эмбрион) |
||||
|
Контроль (без обработки) |
15 |
15 (100) |
30 |
218±10 |
14±1 |
|
Bu + ДМСО |
20 |
15 (75) |
30 |
185±11 |
8±1 |
|
Bu + 90 % ДМСО + 10 % DМЕМ |
20 |
16 (80) |
32 |
191±9 |
8±1 |
|
Bu + 70 % ДМСО + 30 % DМЕМ |
20 |
17 (85) |
34 |
190±10 |
10±1 |
|
Bu + 50 % ДМСО + 50 % DМЕМ |
20 |
17 (85) |
34 |
201±12 |
10±2 |
|
В вед е ни е бусуль ф ана на 24-й ч и нкуб аци и (50 мкл/эмбрион) |
|||||
|
Контроль (без обработки) |
15 |
14 (93) |
28 |
211±9 |
12±1 |
|
Bu + ДМСО |
20 |
12 (60) |
24 |
172±12 |
7±1 |
|
Bu + 90 % ДМСО + 10 % DМЕМ |
20 |
14 (70) |
28 |
178±8 |
7±1 |
|
Bu + 70 % ДМСО + 30 % DМЕМ |
20 |
15 (75) |
30 |
188±10 |
9±1 |
|
Bu + 50 % ДМСО + 50 % DМЕМ |
20 |
16 (80) |
32 |
190±14 |
10±1 |
П р и м еч а ни е. Bu — бусульфан (10 мкг/эмбрион), ПЗК — примордиальные зародышевые клетки.
При введении раствора бусульфана, полученного на основе ДМСО, эмбриональная смертность была на 18-23 % выше по сравнению с контролем. Включение в состав инъекционного раствора бусульфана среды DМЕМ позволило снизить негативное влияние ДМСО на развитие эмбрионов до 20 %. Однако при увеличении содержания DМЕМ в инъекционном растворе препарата до 30 % и более результативность действия бу-сульфана снижалась. Оптимальные показатели, характеризующие эффективность развития эмбрионов и элиминации примордиальных зародышевых клеток, были получены при использовании инъекционного раствора, включавшего 10 мкг бусульфана, 90 % ДМСО и 10 % среды DМЕМ. При этом введение бусульфана на 24-й ч инкубации оказалось эффективнее по сравнению с инъекцией препарата до ее начала. Количество примордиальных зародышевых клеток в гонадах было на 12,5 % меньше аналогичного показателя при обработке эмбрионов бусульфаном на более раннем сроке инкубации. В дальнейших исследованиях для разведения бу-сульфана мы использовали раствор, включающий 90 % ДМСО и 10 % среды DМЕМ. Бусульфан вводили на 24-й ч инкубации эмбрионов.
Гистологические исследования 7-суточных эмбрионов кур выявили изменение размеров гонад и наличия в них примордиальных зародышевых клеток в зависимости от концентрации вводимого препарата (табл. 2). Так, при введении бусульфана в дозе 40 мкг средний диаметр гонад был на 17 % меньше, чем в контроле. При увеличении количества бусульфана отмечали уменьшение их диаметра. При использовании бусульфана в дозах 70, 100, 150 и 200 мкг/эмбрион разница с контролем достигала соответственно 27, 47, 53 и 55 %. При введении бусульфана в дозе 250 мкг не наблюдалось дальнейшего развития ни одного из 20 обработанных эмбрионов.
2. Эффективность элиминации примордиальных зародышевых клеток (ПЗК) в гонадах у эмбрионов кур породы Первомайская при введении бусульфана в разных дозах ( Х ± х )
|
Показатель |
Доза бусульфана, мкг/эмбрион |
||||||
|
контроль |
40 1 |
70 |
100 1 |
150 1 |
200 |
250 |
|
|
Обработано эмбрионов, n |
15 |
20 |
20 |
20 |
20 |
20 |
20 |
|
Развилось эмбрионов до 7-х сут инкубации, n (%) |
14 (93) |
10 (50) |
8 (40) |
5 (25) |
2 (10) |
1 (5) |
0 (0) |
|
Исследовано гонад, n |
28 |
20 |
16 |
10 |
4 |
2 |
0 |
|
Диаметр гонад, мкм Число ПЗК в 1 гонаде (гистологический срез), n : |
211±9 |
176±6 |
154±4 |
111±7 |
99±3 |
96±1 |
|
|
минимальное |
4 |
1 |
0 |
0 |
0 |
0 |
|
|
максимальное |
22 |
13 |
11 |
2 |
1 |
1 |
|
|
в среднем |
12±1 |
6±1 |
4±1 |
1±1 |
1±1 |
1±1 |
|
Уменьшение диаметра гонад у эмбрионов было обусловлено значительным снижением в них числа примордиальных зародышевых клеток (рис.). При введении бусульфана в дозе 40 и 70 мкг этот показатель снижался по сравнению с контролем соответственно в 2 и 3 раза (табл. 2). При количестве бусульфана более 100 мкг/эмбрион отмечалось наличие в гонадах единичных примордиальных зародышевых клеток. В исследованиях, проведенных на лабораторных животных и петухах, у особей при введении бусульфана также отмечалось уменьшение размеров семенников и семенных канальцев по сравнению с контролем (24, 25).
А
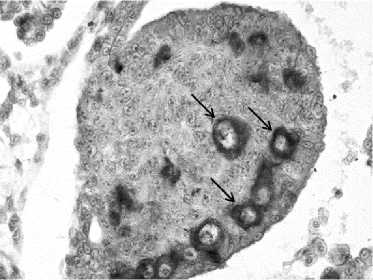
Б
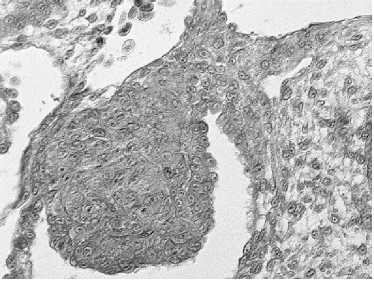
Иммуногистохимическое окрашивание гонад 7-суточных эмбрионов кур (порода Первомайская): А — контроль, без введения бусульфана, видны окрашенные примордиальные зародышевые клетки (показаны стрелкой); Б — опыт, введение бусульфана в дозе 100 мкг/эмбрион, отсутствие примордиальных зародышевых клеток. Увеличение ½400. Световая микроскопия («Nikon», Япония).
Таким образом, полученные данные свидетельствуют о результативности использования бусульфана для элиминации примордиальных зародышевых клеток в гонадах эмбрионов кур. Оптимальным количеством препарата можно считать 100 мкг на эмбрион. Использование бусульфана в указанной дозе способствовало уменьшению диаметра гонад и снижению количества примордиальных зародышевых клеток в них по сравне-1197
нию с контролем соответственно на 53 и 92 %. При введении в эмбрионы бусульфана в большей концентрации (до 250 мкг) отмечались нарушения в их развитии, обусловливающие высокую эмбриональную смертность.
Список литературы Эффективность использования бусульфана для элиминации примордиальных зародышевых клеток в гонадах у эмбрионов кур
- Chojnacka-Puchta L., Kasperczyk K., Płucienniczak G., Sawicka D., Bednarczyk M. Primordial germ cells (PGCs) as a tool for creating transgenic chickens. Pol. J. Vet. Sci., 2012, 15(1): 181-188 ( ) DOI: 10.2478/v10181-011-0132-6
- Hong Y.H., Moon Y.K., Jeong D.K., Han J.Y. Improved transfection efficiency of chicken gonadal primordial germ cells for the production of transgenic poultry. Transgenic Res., 1998, 7(4): 247-252 ( ) DOI: 10.1023/A:1008861826681
- Tyack S.G., Jenkins K.A., O’Neil T.E., Wise T.G., Morris K.R., Bruce M.P., McLeod S., Wade A.J., McKay J., Moore R.J., Schat K.A., Lowenthal J.W., Doran T.J. A new method for producing transgenic birds via direct in vivo transfection of primordial germ cells. Transgenic Res., 2013, 22(6): 1257-1264 ( ) DOI: 10.1007/s11248-013-9727-2
- Han J.Y. Germ cells and transgenesis in chickens. Comp. Immunol. Microb., 2009, 32: 61-80 ( ) DOI: 10.1016/j.cimid.2007.11.010
- Park T.S., Hong Y.H., Kwon S.C., Lim J.M., Han J.Y. Birth of germline chimeras by transfer of chicken embryonic germ (EG) cells into recipient embryos. Mol. Reprod. Dev., 2003, 65: 389-395 ( ) DOI: 10.1002/mrd.10304
- D’Costa S., Pardue S.L., Petitte J.N. Comparative development of avian primordial germ cells and production of germ line chimeras. Avian Poult. Biol. Rev., 2001, 12(4): 151-168 ( ) DOI: 10.3184/147020601783698477
- Petitte J.N., Karagenc L., Ginsburg M. The origin of the avian germ line and transgenesis in birds. Poultry Sci., 1997, 76: 1084-1092 ( ) DOI: 10.1093/ps/76.8.1084
- Ginsburg M. Primordial germ cell development in avians. Poultry Sci., 1997, 76: 91-95 ( ) DOI: 10.1093/ps/76.1.91
- Naito M., Tajima A., Tagami T., Yasuda Y., Kuwana T. Preservation of chick primordial germ cells in liquid nitrogen and subsequent production of viable offspring. J. Reprod. Fertil., 1994, 102: 321-325 ( ) DOI: 10.1530/jrf.0.1020321
- Naito M., Harumi T., Kuwana T. Long term in vitro culture of chicken primordial germ cells isolated from embryonic blood and incorporation into germline of recipient embryo. J. Poult. Sci., 2010, 47: 57-64 ( ) DOI: 10.2141/jpsa.009058
- Nakamura Y., Usui F., Miyahara D., Mori T., Ono T., Takeda K., Nirasawa K., Kagami H., Tagami T. Efficient system for preservation and regeneration of genetic resources in chicken: concurrent storage of primordial germ cells and live animals from early embryos of a rare indigenous fowl (Gifujidori). Reproduction, Fertility and Development, 2010, 22: 1237-1246 ( ) DOI: 10.1071/RD10056
- Kuwana T., Kawashima T., Naito M., Yamashita H., Matsuzaki M., Takano T. Conservation of a threatened indigenous fowl (Kureko dori) using the germline chimeras transplanted from primordial germ cells. J. Poult. Sci., 2006, 43: 60-66 ( ) DOI: 10.2141/jpsa.43.60
- Eyal-Giladi H., Kochav S. From cleavage to primitive streak formation: a complementary normal table and a new look at the first stages of the development of the chick. I. General morphology. Dev. Biol., 1976, 49: 321-337.
- Kang S.J., Choi J.W., Kim S.Y., Park K.J., Kim T.M., Lee Y.M., Kim H., Lim J.M., Han J.Y. Reproduction of wild birds via interspecies germ cell transplantation. Biol. Reprod., 2008, 79: 931-937 ( ) DOI: 10.1095/biolreprod.108.069989
- Wernery U., Liu C., Baskar V., Guerineche Z., Khazanehdari K.A., Saleem S., Kinne J., Wernery R., Griffin D.K., Chang I.K. Primordial germ cell-mediated chimera technology produces viable pure-line Houbara bustard offspring: potential for repopulating an endangered species. PLoS ONE, 2010, 5: e15824 ( ) DOI: 10.1371/journal.pone.0015824
- Campion S.N., Sandrof M.A., Yamasaki H., Boekelheide K. Suppression of radiation-induced testicular germ cell apoptosis by 2,5-hexanedione pretreatment. III. Candidate gene analysis identifies a role for fas in the attenuation of X-ray-induced apoptosis. Toxicol. Sci., 2010, 117: 466-474 ( ) DOI: 10.1093/toxsci/kfq205
- Park K.J., Kang S.J., Kim T.M., Lee Y.M., Lee H.C., Song G., Han J.Y. Gammairradiation depletes endogenous germ cells and increases donor cell distribution in chimeric chickens. In Vitro Cell. Dev. Biol.-Animal, 2010, 46: 828-833 ( ) DOI: 10.1007/s11626-010-9361-8
- Van Buul P.P., De Rooij D.G., Zandman I.M., Grigorova M., Van Duyn-Goedhart A. X-ray-induced chromosomal aberrations and cell killing in somatic and germ cells of the scid mouse. Int. J. Radiat. Biol., 1995, 67: 549-555.
- Bucci L.R., Meistrich M.L. Effects of busulfan on murine spermatogenesis: Cytotoxicity, sterility, sperm abnormalities, and dominant lethal mutations. Mutat. Res., 1987, 176: 259-268.
- Dobrinski I., Avarbock M.R., Brinster R.L. Germ cell transplantation from large domestic animals into mouse testes. Mol. Reprod. Dev., 2000, 57: 270-279 (doi: 10.1002/1098-2795(200011)57:33.0.CO;2-Z).
- Panahi M., Keshavarz S., Rahmanifar F., Tamadon A., Mehrabani D., Karimaghai N., Sepehrimanesh M., Aqababa H. Busulfan induced azoospermia: Stereological evaluation of testes in rat. Vet. Res. Forum, 2015, 6: 273-278.
- Kim J.H., Jung-Ha H.S., Lee H.T. Development of a positive method for male stem cell-mediated gene transfer in mouse and pig. Mol. Reprod. Dev., 1997, 46: 515-526 (doi: 10.1002/(SICI)1098-2795(199704)46:43.0.CO;2-V).
- Микроскопическая техника/Под ред. Д.С. Саркизова, Ю.П. Перова. М., 1996.
- Tagirov M., Golovan S. The effect of busulfan treatment on endogenous spermatogonial stem cells in immature roosters. Poultry Sci., 2012, 91: 1680-1685 ( ) DOI: 10.3382/ps.2011-02014
- Panahi M., Keshavarz S., Rahmanifar F., Tamadon A., Mehrabani D., Karimaghai N., Sepehrimanesh M., Aqababa H. Busulfan induced azoospermia: Stereological evaluation of testes in rat. Vet. Res. Forum, 2015, 6(4): 273-278.


