Эффективность криовоздействия в зависимости от количественных и качественных режимов замораживания и оттаивания
Автор: Говоров А.В., Васильев А.О., Ковылина М.В., Прилепская Е.А., Ковнацкая Г.А., Пушкарь Д.Ю.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 1, 2015 года.
Бесплатный доступ
Эффективность криодеструкции зависит от качества визуализации процесса, быстрого замораживания и медленного оттаивания ткани, а также от проведения повторного цикла замораживания-оттаивания. Основными факторами, оказывающими повреждающее действие на ткань при воздействии низких температур, являются формирование внутриклеточных и внеклеточных кристаллов льда, повышение концентрации электролитов, а также механическое повреждение структурных компонентов клетки. Тепловые параметры, используемые в прошлом при криотерапии, были неточны, что приводило к неэффективности лечения. Проведенные современные теоретические и экспериментальные исследования как in vitro так и in vivo показали, что достижение температуры ниже минус 40 °С является летальным для раковых клеток. Экспериментальные работы на биологических моделях связаны с ограничениями, которые обусловлены активизацией гидролитических ферментов в ответ на угасание жизнедеятельности организма. Дезорганизация ферментных систем приводит к сдвигу рН в кислую сторону, вызывая распад биологических структур организм. Несмотря на то, что в настоящее время криохирургия становится перспективным методом лечения различных онкологических заболеваний, ее применение невозможно без экспериментального обоснования. В результате проведенных собственных исследований впервые получены данные об особенностях криоповреждающего действия низкой температуры, а также выявлена зависимость результата криовоздействия от использованных различных методических приемов и указаний. Определение пороговых значений критической температуры для гибели клеток, а также понимание процессов замораживания и оттаивания способны значительно повысить эффективность проводимой процедуры.
Криотерапия, криодеструкция, процессы замораживания и оттаивания, эксперимент
Короткий адрес: https://sciup.org/142187996
IDR: 142187996
Текст научной статьи Эффективность криовоздействия в зависимости от количественных и качественных режимов замораживания и оттаивания
The effectiveness of cryodestruction of the tissues depends on the quality of visualization of the process, of fast freezing and slow process of thawing, and also of repeating of the freeze-thaw cycles. The main factors that have a damaging effect on the tissue under the influence of low temperatures are: formation of intracellular and extracellular ice crystals, increase of the concentration of electrolytes and mechanical damage of structural components of cells. Thermal parameters used in the past with cryotherapy were inaccurate, leading to treatment failure. Conducted modern theoretical and experimental studies in vitro/in vivo showed that the achievement a temperature minus 40° C is lethal to cancer cells. Experimental studies on biological models have related to the limitations that are caused by the activation of hydrolytic enzymes in response to the extinction of the life of the organism. Disorganization of enzyme systems are leading to a shift of the pH to the acid side and causing the collapse of the biological structures of the body (autolysis). Despite the fact that currently becomes cryosurgery a perspective treatment of various cancers, its application is not possible without experimental verification. According to the results of our own research, first facts were obtained on the characteristics of low temperature cryodestruction effect, also there were revealed dependence of cryogenic treatment results on the used variety of instructional techniques and guidance. Determination of the critical temperature threshold values for the cell death, as well as understanding the processes of freezing and thawing can significantly increase the effectiveness of the procedure.
А.В. Говоров1, А.О. Васильев1, М.В. Ковылина1, Е.А. Прилепская1,
Г.А. Ковнацкая2, Д.Ю. Пушкарь1
1 Кафедра урологии Московского государственного медикостоматологического университета им. А.И. ЕвдокимоваМинздрава России 2 Городская клиническая больница № 50, Москва
овременная криохирургия берет свое начало с работы, описанной I.S. Cooper и соавт. в 1961 г. [1]. В работе было представлено изобретение для замораживания ткани мозга. Описанный авторами криохирургический зонд с вакуумной термоизоляцией для лечения паркинсонизма по сути явился прототипом для последующих криозондов широкого применения, в том числе в урологии.
Первая криоаблация предстательной железы (ПЖ) была проведена в 1966 г. M. Gonder и соавт. с использованием одного трансуретрального датчика (иглы) 26 Fr для лечения инфравезикальной обструкции, вызванной увеличением ПЖ [2]. В 1974 г. M. Megalli и соавт. впервые применили введение криоиглы через прокол кожи промежности [3].
В связи с отсутствием точного контроля над процессом замораживания, частота осложнений (недержание мочи, отхождение струпа слизистой оболочки уретры, формирование ректальной фистулы) была достаточно велика. Данный факт привел к значительному снижению интереса к криохирургии вплоть до конца 1980-х годов. Тем не менее, принимая во внимание потенциальные выгоды от проведения криоаблации, работы по изучению данной методики были продолжены. В 1988 г. G.M. Onik и соавт. опубликовали данные о введении игл и контроле за формированием «ледяного шара» при помощи ультразвукового исследования [4]. В 1994 г. были разработаны температурные сенсоры, обеспечившие точное достижение требуемой температуры, что привело к значительному повышению эффективности лечения [5]. Внедрение J. K. Cohen в середине 1990-х годов в практику уретрального катетера, согревающего слизистую оболочку уретры, привело к снижению частоты недержания мочи и отхождения струпа уретры [6].
В 1996 г. Американская ассоциация урологов признала криоаблацию предстательной железы методом терапии локализованного рака предстательной железы (РПЖ) и перестала считать данную методику экспериментальной, рекомендовав последнюю как вариант первичной и сальважной терапии. В «Клинических рекомендациях» Европейской ассоциации урологов 2010 г. криоаблация ПЖ отнесена к альтернативным методам лечения злокачественной опухоли ПЖ. В настоящее время криоаблация ПЖ проводится стационарно и амбулаторно, сопровождается небольшим количеством осложнений и позволяет добиться высокой безрецидивной выживаемости [7, 8].
Имеющиеся литературные данные свидетельствуют о зависимости повреждения и гибели раковых клеток от таких параметров криовоздействия, как скорость охлаждения и последующего оттаивания, достигнутой температуры, продолжительность воздействия низкой температуры, а также от проведения повтор- ного цикла криовоздействия. Количественные пороговые значения указанных параметров играют важную роль в повреждении клеток. Результаты проведенных исследований подчас трудно сопоставимы и зачастую противоречивы, так как получены при проведении экспериментов с использованием различных методик и условий криовоздействия. В этой связи, изучение особенностей криодеструкции биологических тканей в эксперименте по-прежнему остается актуальным.
Экспериментальные работы на трупных органах связаны с ограничениями, которые обусловлены активизацией гидролитических ферментов в ответ на угасание жизнедеятельности организма [9, 10, 11]. Дезорганизация ферментных систем приводит к сдвигу рН в кислую сторону, вызывая распад биологических структур организма (аутолиз). Выраженность явлений, характерных для процесса аутолиза, зависит от количественного содержания протеолитических ферментов в конкретных органах и тканях. Так, например, повышенное содержание лизосомальных ферментов в поджелудочной железе, селезенке, печени и надпочечниках обусловливает появление первоначальных признаков аутолиза именно в этих органах.
В предстательной железе аутолиз проявляется десквамацией железистого эпителия под действием фибринолизина и кислой фосфатазы. Макроскопически трупная ПЖ выглядит дряблой, лишенной тургора; при микроскопическом исследовании можно обнаружить отслоение внутренней оболочки кровеносных сосудов, набухание и помутнение клеток с растворенными клеточными ядрами, зернистость и изменение окраски протоплазмы и др.
Проведенный анализ мировой литературы показал отсутствие экспериментальных работ, оценивающих эффективность криоаблации на трупной предстательной железе. Большинство экспериментальных работ по данной тематике сконцентрированы на исследованиях in vitro и in vivo.
Некоторые авторы доказали эффективность криодеструкции у больных с РПЖ, проведя им в последующем радикальную простатэктомию. Исследования ex vivo единичны и описывают опыт проведения криоаблации других органов.
Цель исследования – изучение эффекта криодеструкции предстательной железы в эксперименте в зависимости от использования различных температурных и временных режимов.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальное исследование проведено нами на предстательной железе людей, умерших от различных заболеваний. Учитывая, что процессы аутолиза начинаются в трупной ПЖ в первые часы после смерти, мы старались забирать орган в максимально короткие сроки (от одного до трех часов после исхода). Исследование проведено на 10 трупных ПЖ.
В качестве криоаппарата при проведении эксперимента нами использовался аппарат для криотерапии 3-го поколения SeedNet Gold, криоиглы различных модификаций (IceSeed или IceRod, 17 G – 1,5 мм), позволяющие создавать «ледяной шар» различной формы и диаметра, а также температурные датчики для контроля за достигнутой температурой в ходе эксперимента. В качестве криогена использовался аргон, для размораживания ткани применялся гелий. Давление газов в системе составляло 240 бар для аргона и 150 бар для гелия [12]. Хладопроизводительность криоаппарата корректировалась в зависимости от необходимого температурного режима (100% – максимальная, 20% – минимальная хладопроизводи-тельность). С целью моделирования «естественности» эксперимента в мочевой пузырь вводился катетер, согревающий слизистую оболочку уретры, по которому на протяжении всего эксперимента циркулировал подогретый до 43,2°C физиологический раствор (со скоростью около 550 мл/мин). Во всех случаях было выполнено по 2 цикла замораживания. Оттаивание было активным, учитывая отсутствие кровоснабжения в ПЖ и окружающих тканях.
Согласно рекомендации фирмы-изготовителя, для замораживания ПЖ, длина которой составляла менее 3,5 см, нами были использованы криоиглы IceSeed, создающие «ледяной шар» размером 19х26,5 мм. Для замораживания ПЖ, длина которой больше или равна 3,5 см, нами использовались криоиглы IceRod, создающие «ледяной шар» размером 27х50 мм. Замораживание предстательной железы проводилось по схеме: быстрое замораживание – активное оттаивание.
Длительность первого и второго цикла замораживания зависела от скорости замораживания и, как следствие, хладопроизводительности криоаппарата, а также от объема ПЖ и достигнутой температуры (минус 40°C). При максимальной хладо-производительности криоаппарата каждый из циклов замораживания в среднем составил 5 минут. Активное оттаивание ПЖ проводилось до плюс 10°С, интервалы между циклами замораживания составили в среднем 20 минут.
Принимая во внимание тот факт, что начавшиеся процессы аутолиза могут исказить данные, полученные при микроскопическом исследовании замороженной ткани, эффективность криоаблации была проанализирована путем последующей оценки макроскопической картины замороженной ткани.
РЕЗУЛЬТАТЫ
Целесообразность проведения повторного цикла замораживания-оттаивания подтверждена результатами многочисленных экспериментальных работ, по данным которых установлено, что эффективность использования повторного цикла замораживания-оттаивания состоит в увеличении степени криодеструкции и зоны некроза [13]. При объеме □
ПЖ более 100 см3 и/или длине предстательной железы больше или равной 4,5 см может быть проведено более 2-х циклов замораживания-оттаивания (количество циклов определяется объемом ПЖ, ее длиной и картиной трансректального ультразвукового исследования). Ограничением для использования многократных циклов замораживания-оттаивания является сравнительно большая продолжительность процедуры, а также разная характеристика теплофизических свойств замораживаемых тканей (ПЖ, семенные пузырьки и т.д.). По данным ряда авторов, моделирование условий криовоздействия (достижение температуры минус 50, минус 70°С) при проведении однократного цикла замораживания-оттаивания не приводит к существенному улучшению результата [14, 15].
Эффективность криовоздействия изучена нами при проведении одного и двух циклов замораживания-оттаивания. Криовоздействие проводили по схеме: быстрое замораживание – активное оттаивание. Использована максимальная хладопроизводи-тельность криоаппарата (100%). Замораживание ткани ПЖ прекращалось при достижении температуры минус 40°C. После активного оттаивания цикл замораживание-оттаивание повторялся. Для проведения эксперимента в правую и левую доли трупной ПЖ нами было введено по 1 крио-игле IseSeed и по 1 термодатчику для контроля за достигнутой температурой (рис. 1).
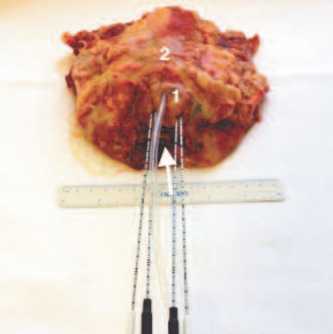
Рис. 1. Макропрепарат трупной ПЖ (1) и мочевого пузыря (2) и прямой кишки (указана стрелкой). В правую и левую доли ПЖ введено по 1 криоигле IseSeed и по 1 термодатчику. По уретре проведен катетер Нелатона № 14 Ch
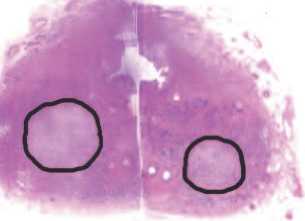
Было показано, что при проведении однократного цикла замораживания формируется «ледяной шар» размером 15х23 мм, тогда как при проведении повторного цикла замораживания формировался «ледяной шар» диаметром 18х26 мм (рис. 2).
t "11™
Рис. 2. Зона полного клеточного некроза и частичной криодеструкции после однократного (на рисунке справа) и повторного цикла замораживания-оттаивания (на рисунке слева)
Проведенные различными авторами исследования in vivo/ in vitro показали, что при быстром замораживании опухолевых клеток происходит достоверное усиление криоповреждающего эффекта. Морфологические исследования показали, что выраженность деструктивных изменений в опухолевых клетках в зоне прямого некроза и зоне частичной криодеструкции, а также распространенность необратимых повреждений были большими после криовоздействия с быстрым замораживанием [16, 17].
В ходе эксперимента нами также было изучено влияние скорости замораживания на эффективность криодеструкции. Коррекция скорости замораживания в пределах всей зоны криовоздействия достигалась путем снижения хладопроизводительности криоаппарата в отдельной группе криоигл. Максимальная скорость замораживания реализовывалась при давлении аргона 240 бар и хладопроиз-водительности криоаппарата 60-40%. Замораживание ткани ПЖ прекращалось при достижении температуры минус 40°C. После активного оттаивания проводился повторный цикл замораживания-оттаивания. Эксперимент проведен с использованием
1 криоиглы IceRod и 1 термодатчика, введенных в левую долю трупной ПЖ (рис. 3).
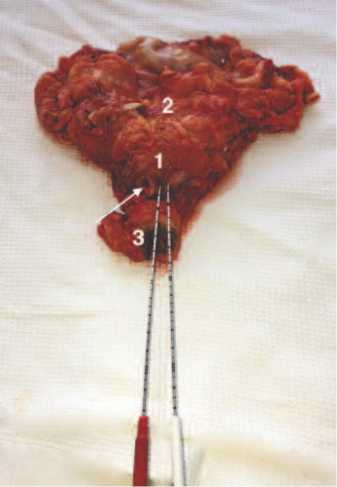
Рис. 3. Макропрепарат трупной ПЖ (1), мочевого пузыря (2) и прямой кишки (3). В левую долю предстательной железы введена криоигла IseRod и термодатчик. Стрелкой указана уретра
В ходе нашего исследования было отмечено, что снижение скорости замораживания приводит к увеличению продолжительности и, как следствие, к снижению эффективности криовоздействия. Данный факт подтверждает гипотезу о том, что эффективность криодеструкции пропорциональна скорости замораживания [17].
Снижение температуры на периферии криовоздействия было сопряжено с распространением «ледяного шара» за пределы капсулы ПЖ, что было отчетливо видно макроскопически на передней поверхности
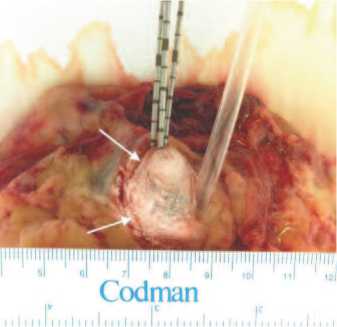
Рис. 4. Макропрепарат трупной ПЖ. Визуализация ледяного шара (указан стрелками)
ПЖ (рис. 4). Данной методике проведения криовоздействия может быть присуще ограничение ввиду возможной травматизации окружающих тканей.
Как было отмечено ранее, оттаивание в ходе нашего эксперимента было активным, учитывая отсутствие кровоснабжения в самой трупной ПЖ и окружающих ее тканях. Проведенные ранее эксперименты in vivo/in vitro подтверждают, что при активном оттаивании отмечается достоверное снижение терапевтического эффекта [18, 19]. Выживание большего числа клеток ПЖ в пределах зоны криодеструкции в последующем может явиться источником рецидивирова-ния.
ОБСУЖДЕНИЕ
Основными параметрами, коррелирующими с гибелью опухолевых клеток, являются быстрота замораживания, достигнутая минимальная температура и скорость оттаивания. На практике быстрая скорость замораживания (больше 50°С/мин) может быть достигнута только вблизи криодатчика [16]. В исследовании, проведенном P.L. Steponkus и соавт. [17], было показано, что чем выше скорость замораживания, тем больше количество клеток, погибших от внутриклеточной кристаллизации. Оттаивание, наоборот, должно происходить медленнее, т.к. при этом клеточная дегидратация выражена в большей степени [18]. Под медленным оттаиванием принято понимать полное исчезновение акустической тени не ранее, чем через 30 минут. Медленное оттаивание можно назвать более важным механизмом гибели клетки, чем быстрое замораживание, т.к. во время оттаивания происходит процесс рекристаллизации – слияние отдельных кристаллов льда, приводящих к созданию гипотоничной внеклеточной среды и дополнительному разрушению клеточных мембран [19].
В проведенных экспериментах с различными тканями животных исследователям удалось установить оптимальную летальную температуру для опухолевых клеток, которая находится в диапазоне от минус 40 до минус 50 ° C. Тем не менее, разные мнения об оптимальной летальной температуре злокачественных клеток и времени замораживания в криохирургии рака сохраняются и по сей день [20]. Причина расхождения во мнениях заключается в использовании различных клеток и тканей при проведении экспериментов in vivo, что связано с их различной чувствительностью к низкой температуре.
Оптимальная продолжительность цикла замораживания не установлена, однако проведенные эксперименты показали, что длительное по времени замораживание производит больший деструктивный эффект на опухолевые клетки [21]. Продолжительность цикла замораживания может и не иметь такого значения, если оно проводится при температуре ниже минус 50°C [22]. P. Mazur в своем исследовании установил, что эффективность криовоздействия будет такой же, как при минус 50°C, если длительное по времени замораживание будет происходить в диапазоне от минус 10 до минус 25 °C [14].
K. Tatsutani и соавт. провели серию экспериментов in vitro на культуре клеток РПЖ и показали, что для полного уничтожения раковых клеток необходимо достижение температуры минус 40°С, и что двойной цикл замораживания более эффективен, чем одиночный [13]. По данным авторов, повторный процесс замораживания усиливает степень криодеструкции ткани, увеличивая период ее нахождения в так называемой зоне «критических температур» и интенсифицируя процессы кристаллизации и рекристаллизации.
К подобному выводу также пришел D.K. Whittaker, доказавший, что внутриклеточных кристаллов льда образуется больше при втором цикле замораживания, что связано с проведением длительного по времени оттаивания [23]. Автором было доказано, что длительное пассивное оттаивание, проводимое между циклами, может значительно повысить эффективность данной методики, а проведение повторного цикла замораживания способствует расширению границ «ледяного шара» по периферии.
По данным B. Gowardhan и соавт. при замораживании ткани формируется центральная зона полного клеточного некроза, величина которой зависит от выбранного типа криодатчика. Повреждение клеток в этой зоне выражено в наибольшей степени. По периферии центральная зона окружена зоной клеточного повреждения (зона частичной криодеструкции) и зоной гипотермии (зона дегидратации клеток) [24]. S. Cytron и соавт. в своем исследовании показали, что зона центрального некроза также может быть существенно расширена при втором цикле замораживания, когда повторное снижение температуры ткани до минус 40 °С усиливает некроз [25].
ВЫВОДЫ
В результате проведенных собственных исследований впервые в России в эксперименте получены данные об особенностях криоповреждающего действия низкой температуры, а также выявлена зависимость результата криовоздействия от использованных различных методических приемов. Продемонстрировано, что снижение скорости замораживания ткани ПЖ приводит к увеличению времени криоаблации, что, по данным большинства авторов, снижает распространенность необратимых повреждений по сравнению с быстрым замораживанием. Использование длительной экспозиции может привести к распространению «ледяного шара» за пределы ПЖ, что может иметь значение у пациентов с РПЖ T3. Однако, существующие ограничения ввиду возможности повреждения соседних органов и тканей, должны быть приняты во внимание. Проведение повторных циклов замораживания-оттаивания увеличивает «эффективную» зону криодеструкции, что позволяет добиться уничтожения большего числа клеток, чем при однократном цикле. □
Работа выполнена по проекту РНФ 14-15-01120
Резюме:
Список литературы Эффективность криовоздействия в зависимости от количественных и качественных режимов замораживания и оттаивания
- Cooper IS, Lee AS. Cryostatic congelation: a system for producing a limited, controlled region of cooling or freezing of biologic tissues. // J Nerv Ment Dis. 1961. Vol. 133. P. 259-263.
- Gonder MJ, Soanes WA, Schulman S. Cryosurgical treatment of the prostate. // Invest Urol. 1966. Vol. 3. P. 372-378.
- Megalli MR, Gursel EO, Veenema RJ. Closed perineal cryosurgery in prostate cancer. New probe and technique. // Urology. 1974. Vol. 4. P. 220-222.
- Onik GM, Cohen K, Reyes GD, Rubinsky B, Chang Z, Baust J. Transrectal ultrasound-guided percutaneous radical cryosurgical ablation of the prostate. // J Cancer. 1993. Vol. 72. P. 1291-1299.
- Lee F. US-guided percutaneous cryoablation of the prostate cancer. // Radiology. 1994. Vol. 192. P. 769-776.
- Cohen JK, Miller RJ, Shuman BA. Urethral warming catheter for use during cryoablation of the prostate. // Urology. 1995. Vol. 45. P. 861-864.
- Lam JS, Shvarts O, Belldegrun AS. A new era for cryotherapy of prostate cancer?//Cont Urol. 2004. Vol. 16, N 10. P. 46-61.
- Babaian RJ, Donnelly B, Bahn D, Baust JG, Dineen M, Ellis D, Katz A, Pisters L, Rukstalis D, Shinohara K, Thrasher JB. Best practice policy statement on Cryosurgery for the treatment of localized prostate cancer. // Journal of Urology. 2008. Vol. 180. P. 1993-2004.
- Rivoire ML, Voiglio EJ, Kaemmerlen P. Hepatic cryosurgery precision: evaluation of ultrasonography, thermometry, and impedancemetry in a pig model. // J Surg Oncol. 1996. Vol. 61. P. 242-248.
- Robilotto AT, Clarke D, Baust JM. Development of a tissue engineered human pros-tate tumor equivalent for use in the evaluation of cryoablative techniques. // Technol Cancer Res Treat. 2007. Vol. 6. P. 81-89.
- Smith JJ, Fraser J, Maclver AG. Ultrastructure after cryosurgery of rat liver. // Cryo-biology. 1978. Vol. 15. P. 426-432.
- Говоров А.В., Васильев А.О., Пушкарь Д.Ю. Особенности криодеструкции предстательной железы. // Ж. Медицинская техника. 2015. Vol. 1. P. 40-45.
- Tatsutani K, Rubinsky M, Onik G, Dahiya R. Effect of thermal variables on frozen human primary prostatic adenocarcinoma cells. // Urology. 1996. Vol. 48. P. 441-447.
- Mazur P. Physical-chemical factors underlying cell injury in cryosurgical freezing. In: Rand R, Rinfret A, von Leden H, editors.//Cryosurgery. Charles C. Thomas; Springfield, IL.: 1968. P. 32-51.
- Staren ED, Sabel MS, Gianakakis LM, Wiener GA, Hart VM, Gorski M, Dowlatshahi K, Corning BF, Haklin MF, Koukoulis G. Cryosurgery of breast cancer//Arch Surg. 1997. Vol. 132. P. 28-33.
- Mazur P. Freezing of living cells: mechanisms and implications. // Am J Physiol. - 1984. Vol. 143. P. 125-142.
- Steponkus PL, Lynch DV. Freeze/thaw induced destabilization of the plasma mem-brane and the effects of cold acclimation.//J Bioenerg Biomembr. 1989. Vol. 21. P. 21-41.
- McGrath JJ, Caravalho EG, Huggins CE. An experimental comparison of intracellular ice formation and freeze-thaw survival of HeLa S-3 cells. // Cryobiology. 1975. Vol. 12. P. 540-550.
- Gage AA, Guest K, Montes M, Caruana JA, Whalen DA Jr. Effect of varying freezing and thawing rates in experimental cryosurgery. // Cryobiology. 1985. Vol. 22. P. 175-182.
- Neel HB, DeSanto LW. Cryosurgical control of cancer: effects of freeze rates, tumor temperatures, and ischemia.//Ann Otol Rhinol Laryngol. 1973. ol. 82. P. 716-723.
- Burge SM, Shepherd JP, Dawber RP. Effect of freezing the helix and the rim or edge of the human and pig ear. // J Dermatol Surg Oncol. 1984. Vol. 10. P. 816-819.
- Staren ED, Sabel MS, Gianakakis LM, Wiener GA, Hart VM, Gorski M, Dowlatshahi K, Corning BF, Haklin MF, Koukoulis G. Cryosurgery of breast cancer. // Arch Surg. 1997. Vol. 132. P. 28-33.
- Whittaker DK. Repeat freeze cycles in cryosurgery of oral tissues. // Br Dent J. 1975. Vol. 139. P. 459-465.
- Gowardhan B., Greene D. Cryotherapy for the prostate: an in vitro and clinical study of two new developments; advanced cryoneedles and a temperature monitoring system.//BJU Int. 2007. Vol. 100. Suppl. 2. P. 295-302.
- Cytron S, Greene D, Witzsch U, Nylund P, Bjerklund Johansen TE. Cryoab-lation of the prostate: technical recommendations. // Prostate Cancer Prostatic Dis. 2009. Vol. 1. P. 1-8.


